小桐子MYB基因家族的鉴定及JcMYB308基因的克隆与低温表达分析
2018-01-31辛胡颜岳辉丁雪梅刘潮高永代冬琴唐利洲王海波
辛胡 颜岳辉 丁雪梅 刘潮 高永 代冬琴唐利洲 王海波
(1. 西南林业大学林学院,昆明 650224;2. 曲靖师范学院 云南高原生物资源保护与利用研究中心 云南省高校云贵高原动植物遗传多样性及生态适应性重点实验室,曲靖 655011)
小桐子(Jatropha curcas L.)又名麻疯树、黄肿树(广东)、膏桐(云南)、桐油树(台湾)、假花生(广西),发源于加勒比海的海岛,现广泛分布和栽培于热带、亚热带等地区[1-2],在我国主要分布于广西西南部和西部、云南南部和东南部等地区[3]。它属大戟科(Euphorbiaceae)麻疯树属(Jatropha)多年生木本油料植物,其种子含油量高,流动性好,是加工生物柴油的优质原料,且耐干旱贫瘠,是干热河谷地区理想的生态造林树种[4-5],被世界公认为生物能源树种。其油被改性后适用于各种柴油机,并在闪点、凝固点、硫含量、一氧化碳排量及颗粒值等关键技术均优于国内零号柴油,达到欧洲二号排放标准。另外,其种仁可作为传统的肥皂及润滑油原料[6],有泻下和催吐功效[7-8],油麸可作农药及肥料[9],兼具经济价值及良好的开发前景[10]。
生物与非生物逆境胁迫下,植物通过一系列信号转导途径激活相应的转录因子,并结合靶基因上游特定顺式作用元件从而激活或抑制抗逆相关基因以特定的时空与强度进行转录表达,进而抵抗不利环境[11]。目前,已经鉴定的植物抗逆转录因子包括 MYB、WRKY、ZFP、AP2/ERF、bHLH、NAC、VOZ、CAMTA及 EIN3等[12-13]。其中,MYB基因家族及MYB结构域基因进化时间较长,且存在于所有真核生物中,是植物界最大的转录因子家族之一[14],参与植物细胞分化、叶片等器官的形态建成、次生物质代谢、细胞周期调节及环境因子的应答等过程[15]。根据MYB结构域的数量及分布,MYB基因一般分为4种类型,其中,R2R3-MYB是植物中分布最为广泛的一种MYB基因[16-17],而R1R2R3-MYB(3R-MYB)主要存在于动物体中,参与动物细胞周期的调节等过程[18-19],但在植物中数量较少,一般含有4-5个[20],4R-MYB在大部分动植物中仅含有1个,而且人们对其功能的了解甚少。本研究基于小桐子基因组数据库,对MYB基因家族在全基因组水平进行了鉴定,并克隆到一个MYB基因家族基因JcMYB308,顺式作用元件与qRT-PCR分析显示其可能参与小桐子多种非生物胁迫如低温的应答过程,本研究为进一步对该基因进行功能验证及转基因研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 实验材料及处理 本实验选用的小桐子种子取自云南省楚雄州元谋县。选取饱满的小桐子种子,1.5% CuSO4溶液消毒15 min后,用无菌水漂洗3-5次,置于26℃的恒温培养箱中吸涨24 h。随后,将吸涨的种子于无菌水中漂洗2-3次后,置于垫有5层无菌水湿润滤纸的托盘中,在相对湿度(RH)为75%、26/20℃、16/8 h光周期的恒温培养箱中萌发5 d。选取发芽较好的种子播于消毒的培养土中,并于相同条件的恒温培养箱中生长约15 d,直至第2片真叶展开。随后将生长15 d后的小桐子幼苗置于相对湿度(RH)为75%、12℃、16/8 h光周期的低温培养箱中进行低温胁迫处理,分别取低温胁迫0.5、3、12、24、48 h与对照(正常培养)的第2片真叶、茎及根,置于贴好标签的自封袋中,液氮速冻后存于-80℃冰箱中用于RNA的提取。
1.1.2 实验的主要试剂 本研究中大肠杆菌 Trans1-T1(DH5α)、TransZol Up、DNase I、TransStart Taq DNAPolymerase、氨苄青霉素(Amp)、X-gal、IPTG、2× Easy Taq PCR SuperMix(+dye)、EasyPure Plasmid MiniPrep Kit、pEASY-T1 Cloning Kit、Trans 2K Plus II DNA Marker、TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix、TransStart Top Green qPCR SuperMix等购自北京全式金生物技术有限公司;引物合成及测序由华大基因有限公司完成。
1.2 方法
1.2.1 小桐子MYB基因家族全基因组成员鉴定及序列分析 从GenBank下载小桐子最新注释蛋白质数据库,通过Pfam(http://pfam.xfam.org/)下载MYB结构域的隐马可夫模型(PF02701),利用Hmmer3.0软件的Hmmsearch程序对小桐子蛋白质数据库进行比对(阈值E<1e-10,序列相似性>50%),得到候选的小桐子MYB蛋白质序列,并手工去除重复序列。将非冗余的候选序列利用Pfam与CDD在线工具分析MYB蛋白结构域做进一步筛选,得到最终的小桐子MYB家族蛋白序列。将鉴定的小桐子MYB蛋白序列利用ClustalX(Version2.0)进行序列相似性比对,然后用MEGA6.0软件通过邻接法(NJ)构建系统进化树,并采用自展法(Bootstrap)进行检验。
1.2.2 总RNA的提取及cDNA第一链的合成 利用两步裂解法提取小桐子对照与12℃低温胁迫0.5、3、12、24、48 h的根、茎及叶片的总RNA,并利用DNase I消化RNA中的残余基因组DNA,得到纯化的总RNA。分别取3 μg总RNA,以Anchored Oligo(dT)为逆转录引物,利用 TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix合成第一链 cDNA。
1.2.3 小桐子JcMYB308基因cDNA片段的克隆 以1.2.2反转录cDNA为模板,使用双封闭热启动DNA聚合酶TransStart Taq DNA Polymerase进行PCR扩增,引物序列为:JcMYB308_F1:5'-AACCCATTTGCCTTGTCT-3';JcMYB308_R1:5'-CTCCATCGCCAGTCTTCA-3'。扩增条件为:94℃预变性5 min;94℃变性30 s,51.8℃退火30 s,72℃延伸1 min,35个循环;72℃后延伸20 min。切胶回收目的条带(约700 bp),与克隆载体pEASY-T1连接后,转化大肠杆菌感受态细胞,涂Amp抗性LB平板,过夜培养,进行蓝白斑筛选。挑取单菌落进行菌落PCR验证阳性克隆,提取重组质粒命名为pEASY-T1-JcMYB308。
1.2.4 小桐子JcMYB308基因的序列分析 利用BioEdit软件将克隆的小桐子JcMYB308基因cDNA序列翻译成氨基酸序列,用在线工具ProtParam计算其理论分子量、等电点等基本参数。将获得的小桐子JcMYB308基因对GenBank小桐子基因组序列(Annotation release 101)进行tblastn检索得到其基因与CDS序列,同时下载其它植物的MYB308基因序列、CDS序列及氨基酸序列。利用在线软件GSDS(Gene Structure Display Server,http://gsds.cbi.pku.edu.cn/)进行CDS序列与基因序列比对以确定基因内含子与外显子的结构并绘制基因结构图。将小桐子JcMYB308蛋白序列与其它植物MYB308进行序列相似性比对,然后用MEGA6.0软件通过邻接法(NJ)构建系统进化树。利用GenBank的CDD工具对比对文件进行结构域分析并利用GenDOC软件绘图。
1.2.5 小桐子JcMYB308基因的荧光定量表达分析 利用1.2.2中获得的小桐子各器官低温胁迫条件下的cDNA为模板,以18S rRNA为内 参(GenBank登 录 号:AY823528), 利 用TransStart Top Green qPCR SuperMix进 行 小 桐子JcMYB308基因的qRT-PCR扩增,使用仪器为 Roche Lightcycler 96,20 μL反 应 体 系, 每 个样品重复3次。JcMYB308基因扩增引物序列JcMYB308_F2(5'-AACCCATTTGCCTTGT-3'),JcMYB308_R2(5'-CAGCAGCCTTCACCAT-3');内参基因18S rRNA扩增引物序列18S rRNA_F(5'-AGAAACGGCTACCACATC-3'),18S rRNA_R(5'-CCAAGGTCCAACTACGAG-3')。 扩 增 条 件 为 :94℃预变性30 s;94℃变性10 s,50.8℃退火15 s,72℃延伸15 s,45个循环,之后增加溶解曲线程序:95℃ 10 s,65℃ 60 s,97℃ 1 s,连续检测信号。采用2-ΔΔCt方法进行基因差异表达分析。组织差异表达分析以叶片的表达量为基准,低温差异表达分析以对照(CK)的表达量为基准。
2 结果
2.1 小桐子MYB基因家族全基因组成员鉴定及序列分析
自GenBank下载小桐子最新注释蛋白质数据库,结合Pfam与CDD结构域分析共鉴定到213个小桐子MYB基因家族成员,其中1R-MYB 86个、R2R3-MYB 122个、3R-MYB 4个、4R-MYB 1个,JcMYB-308基因属于R2R3-MYB亚家族中的一员。同时,对小桐子MYB家族进行理化性质分析表明:小桐子213个MYB转录因子蛋白质序列长度分布在88-2 039 aa之间,等电点分布在4.49-10.33之间。聚类分析显示小桐子MYB家族分为6个亚家族(图1)。
2.2 小桐子JcMYB308基因片段cDNA的克隆
以小桐子低温胁迫48 h的叶片提取总RNA并反转录的cDNA为模板扩增JcMYB308基因片段。结果表明,扩增产物约713 bp,与预期设计引物结果一致(图2-A)。将目的条带切胶回收后与T/A克隆载体pEASY-T1连接、转化大肠杆菌,经菌落PCR 鉴定阳性克隆(图2-B),之后阳性克隆过夜培养,提取重组质粒(图2-C)。
2.3 小桐子JcMYB308基因的序列分析
利用BioEdit 软件将克隆的小桐子 JcMYB308 基因的部分 cDNA序列翻译成氨基酸序列(图 3)。
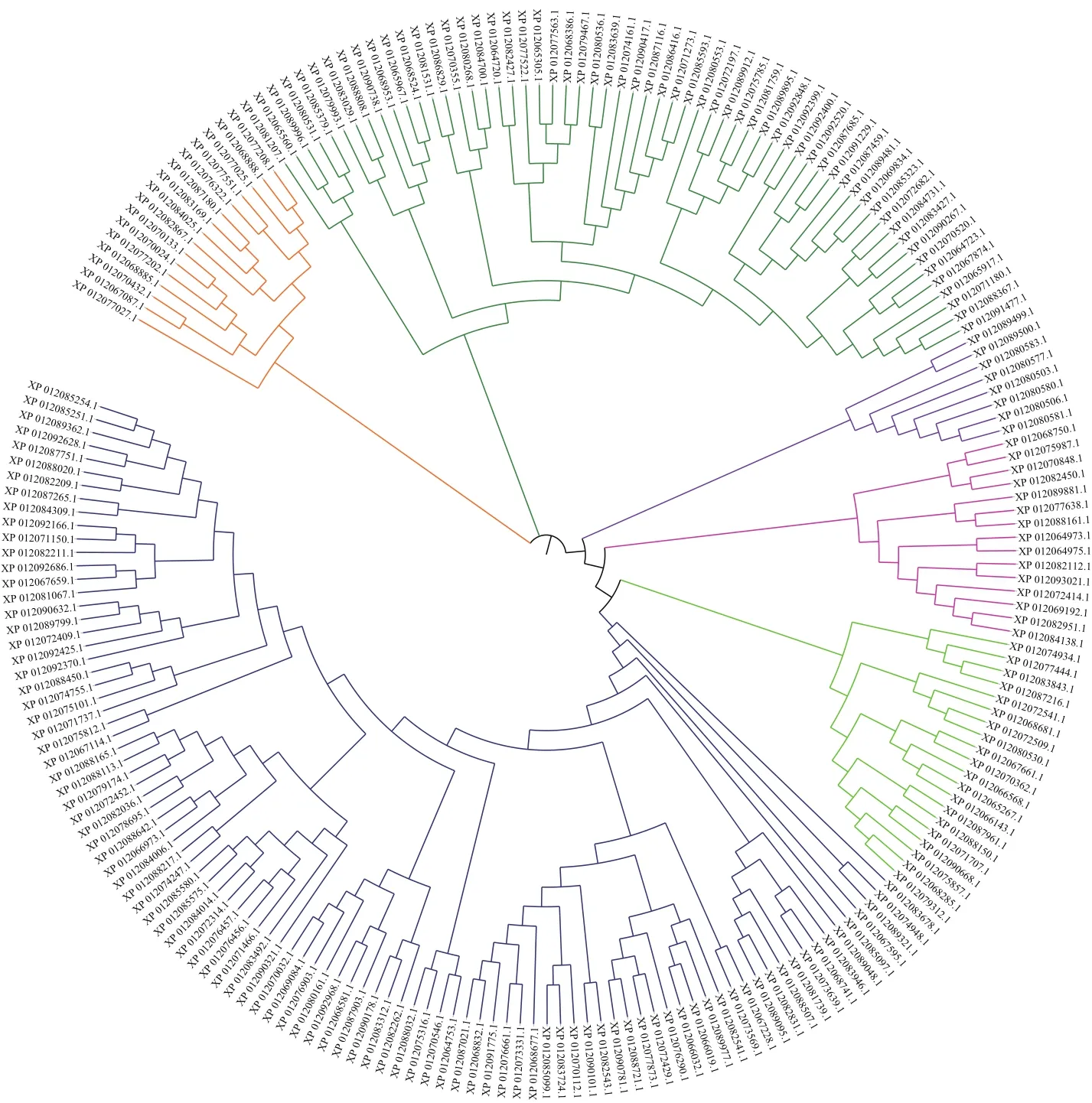
图1 通过ClustalX序列比对MEGA6.0邻接法构建的小桐子MYB基因家族进化树
从GenBank下载其它植物的MYB308蛋白序列,通过ClustalX2.0序列比对,并利用MEGA5.0构建系统进化树显示,MYB308蛋白在N端序列保守性较高,分别鉴定到2个MYB结构域,而中部与C端的序列一致性相对较小(图4)。单子叶植物和双子叶植物单独聚类为两个分支,而小桐子与同属大戟科的蓖麻亲缘关系最近,序列一致性为62.7%(图5)。
为了分析小桐子JcMYB308基因的结构特征,构建了JcMYB308与其它物种MYB308基因内含子-外显子结构图和系统发育树,结果表明,所有考察的植物MYB308基因都含有2个外显子,且都包含5'和3'非编码区(5'-UTR和3'-UTR)。其中,小桐子JcMYB308基因5'-UTR区域长度约为1 791 bp,与其它植物MYB308基因结构差异较为显著(图6)。
2.4 小桐子JcMYB308基因的表达分析
据文献报道,MYB类转录因子中包含与植物抗逆性相关的基因[21]。通过实时荧光定量PCR对小桐子JcMYB308基因进行组织差异与低温胁迫表达分析。结果表明,JcMYB308基因在根、茎、叶器官中均有表达,但存在组织差异性。其中,在小桐子根中表达量较高;其次是茎,而在叶片中表达量相对较低(图7-A)。另外,小桐子JcMYB308基因在叶片、茎及根中都属于低温诱导表达基因,在叶中,在低温胁迫的0.5 h-12 h持续诱导高表达,并在低温胁迫12 h达到最大表达量,较对照提高6.73倍(图7-B),而在茎与根中,均在低温胁迫24 h达到最大表达量,分别较对照提高18.17倍与10.93倍(图7-C、D),说明JcMYB308基因与小桐子的抗冷性形成直接相关。
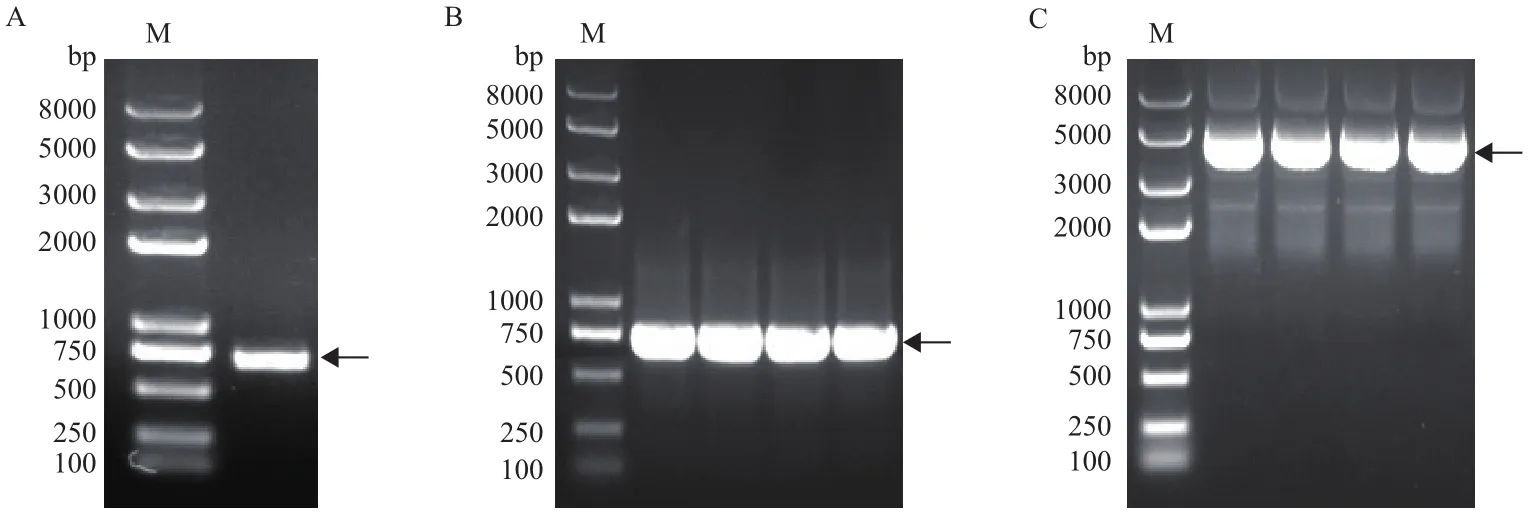
图2 小桐子JcMYB308基因cDNA片段克隆

图3 小桐子JcMYB308基因的部分cDNA及对应的氨基酸序列
3 讨论
MYB类转录因子家族特有的MYB结构域是一段含有约51-53个氨基酸残基的肽段,包含一系列高度保守的氨基酸残基和间隔序列[22]。其广泛分布于真核生物中,也是植物中最大的转录因子家族之一[23]。生物信息学分析发现,小桐子MYB基因家族包含213个成员,其中R2R3-MYB成员122个。目前Katiyar 等[24]报道水稻和拟南芥中分别包含155和197个MYB成员,其中发现水稻中含R2R3-MYB基因109个;Du等[25-27]在玉米和大豆中分别鉴定到157和244个R2R3-MYB成员;Willcins等[28]在杨树中鉴定到192个R2R3-MYB成员;Li等[22]在黄瓜基因组中鉴定到55个R2R3-MYB基因。而本研究构建进化树分析显示,胡杨、黄瓜与小桐子同属双子叶分支,表明它们的亲缘关系、生物学功能比较近,但数据剖析结果与之相反,数量相差较大,反而与单子叶植物相接近。但一些研究者也发现,有些双子叶植物与小桐子R2R3-MYB成员数量相差甚少,如Matus等[29]在葡萄中鉴定到108个R2R3-MYB成员;Katiyar[24]等于拟南芥中发现其有126个R2R3-MYB成员。因此,可以推知,MYB基因家族成员虽然分布在不同物种中,随着亲缘关系的近与远其数量有一定的变化,但对于大多数单、双子叶植物来说,它们的亲缘关系出现交叉性。
MYB基因家族不仅参与植物的大部分生长发育过程[31],还在植物体内参与调控其生物的合成及信号传导的过程,如调节花青素、类黄酮、木质素的合成、毛状体的分化、抗逆信号的传导等[16-17]。在研究中我们发现,小桐子JcMYB308基因属于R2R3-MYB亚家族中的一员。诸多文献报道,R2R3-MYB亚家族所含转录因子与植物的多种非生物胁迫应答如低温密切相关。如Cominelli等和Seo等[32-33]研究发现在拟南芥中AtMYB60和AtMYB96在ABA信号传递过程中起调控作用,具有调控气孔导度、提
高植物抗旱和抗病能力的功能;其中AtMYB30、AtMYB60、AtMYB96及VvMYB60的共同特点是都参与抗逆信号的传递与调控过程;Ding等[34]报道了拟南芥基因AtMYB15的过量表达可以提高拟南芥对ABA的敏感性,并提高了植物的抗旱性。本研究通过基因结构和进化分析显示及qRT-PCR分析结果初步断定JcMYB308基因可能参与小桐子抗冷性的形成过程,它在不同组织中均有表达,其中于叶中,在低温胁迫0.5 h-12 h持续诱导高表达;还发现它的表达于某一时段或时刻高表达后又开始趋于下降,若作图呈现钟罩性。对此现象我们认为,小桐子生活于干热河谷地区,由于缺乏对低温的适应能力,对其植株于12℃进行低温处理,达到最大抗性的低温训化时间后其体内的生理生化活动依次减弱,所以表达量下降。此外,Agarwal等[21]在拟南芥中也发现AtMYB15参与抗寒基因的表达调控;Van等[35]研究表明与之聚类于同一亚家族的AtMYB72与植物诱导系统性抗性获得有关。虽然本实验研究的小桐子R2R3-MYB亚家族成员之一MYB308基因在其它物种中报道甚少,但基于以上研究充分证实,MYB
类转录因子家族与植物的耐胁迫性密切相关。就当前的研究而言,MYB基因家族虽作为一个大家族,数量甚多,但与植物抗冷性相关的基因仅有一小部分。本研究结果有助于更好地了解MYB转录因子在小桐子中对低温响应的作用。

图4 植物MYB308氨基酸多序列比对
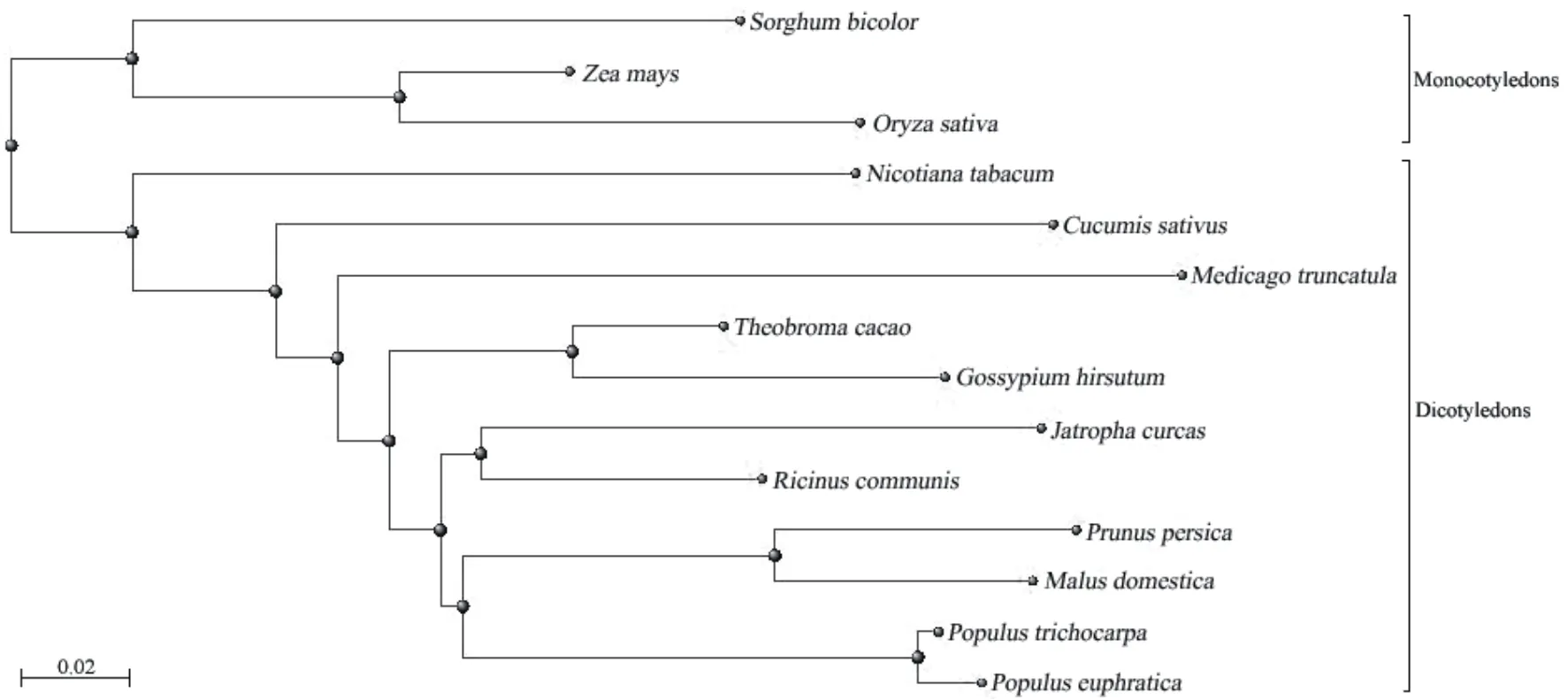
图5 小桐子JcMYB308与其他物种MYB308转录因子的进化分析
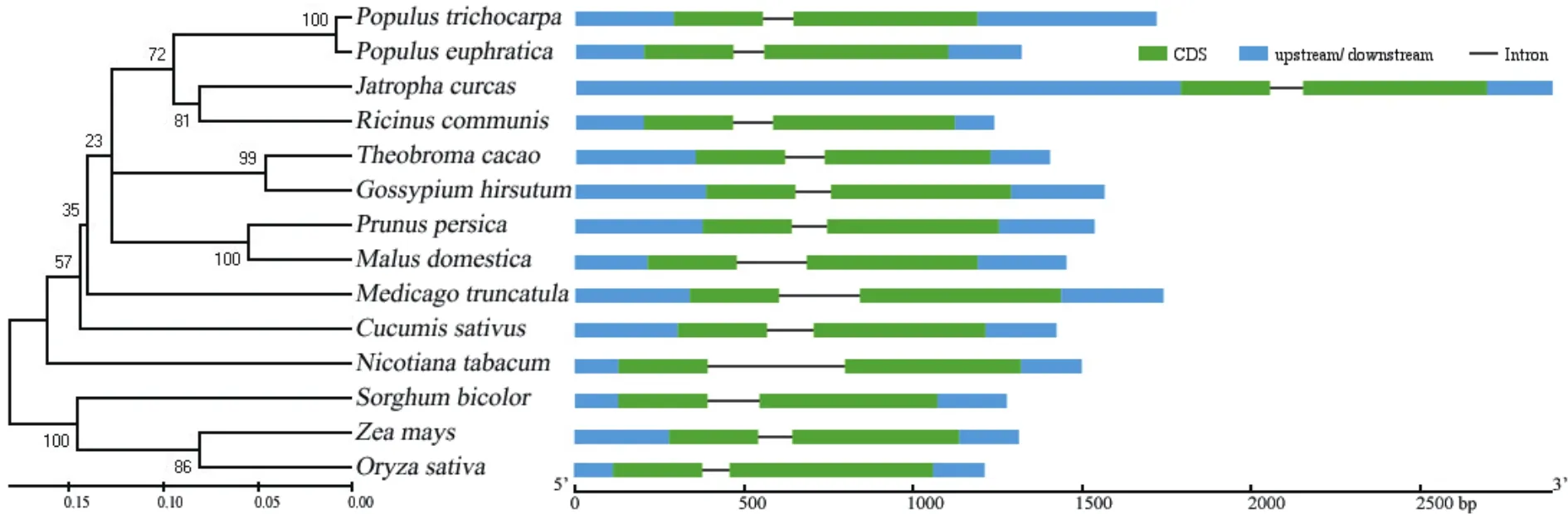
图6 植物MYB308的基因结构分析
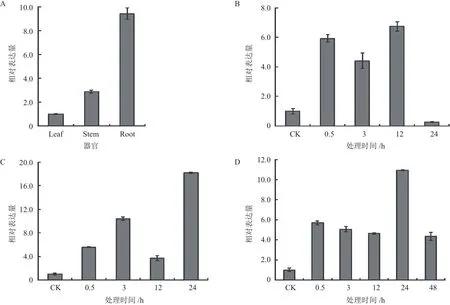
图7 小桐子JcMYB308基因的表达模式分析
4 结论
本研究基于小桐子最新注释全基因组数据库,通过生物信息学鉴定得知小桐子全基因组共含213个MYB基因家族成员,聚类为6个亚家族,其中MYB308基因属于R2R3-MYB亚家族成员。利用RTPCR成功克隆了小桐子JcMYB308基因,其克隆片段长度为713 bp,基因结构具有较高的保守性,均含有两个外显子,进化树显示其与同属大戟科的蓖麻亲缘关系最近,序列一致性为62.7%。qRT-PCR表达分析表明,小桐子JcMYB308基因的表达存在组织表达特异性,在根中表达量较高,而在叶片中表达量相对较低,在根与茎中低温胁迫24 h时达到最大表达量。
[1]张无敌, 宋洪川, 伟小岿, 等. 元谋县小桐子种植的适应性研究[J]. 农业与技术 , 2001, 21(2):22-25.
[2]曾觉民. 可大力发展的生物质能源植物-膏桐[J]. 云南林业,2006, 27(2):21-22.
[3]陈丽, 吴军, 曾妮, 等. 用GC-MS分析不同采收和贮存时期的麻疯种子油的脂肪酸[J]. 热带亚热带植物学报, 2007, 15(5):443-446.
[4] 王涛. 中国主要生物质燃料油木本能源植物资源概况与展望[J]. 科技导报 , 2005, 23(5):12-14.
[5]Nakashima K, Ito Y, Yamaguchi-Shinozaki K. Transcriptional regulatory network in response to abiotic stress in Arabidopsis and grasses[J]. Plant Physiology, 2009, 149(1):88-95.
[6]李静, 吴芬宏, 陈延燕, 等. 麻风树种子提取物对几种害虫的杀虫活性[J]. 农药 , 2006, 45(1):57-58.
[7]范菊娣, 杨松, 宋宝安, 等. 麻风树农药和医药生物活性研究进展[J]. 农药 , 2006, 45(5):298-301.
[8]王兆玉, 杜延琪, 岑岳柱, 等. 小油桐叶甲醇提取物对福寿螺的药效试验[J]. 南方医科大学学报, 2009, 29(6):1235-1237.
[9]刘杰, 李黔柱, 尹航, 等. 麻风树植物资源的研究与开发利用进展[J]. 贵州大学学报:自然科学版, 2006, 23(2):105-110.
[10] 刘玉君, 沈世华. 小桐子种子油体蛋白的提取及其电泳分析[J]. 林业科学 , 2008, 44(8):37-40.
[11]刘辉, 李德军, 邓治. 植物应答低温胁迫的转录调控网络研究进展[J]. 中国农业科学, 2014, 47(18):3523-3533.
[12]Wang HB, Zou ZR, Wang SS, et al. Global analysis of transcriptome responses and gene expression profiles to cold stress of Jatropha curcas L[J]. PLoS One, 2013, 12(12):e82817.
[13]Wang HB, Zou ZR, et al. Deep sequencing- based transcriptome analysis of the oil-bearing plant Physic Nut(Jatropha curcas L.)under cold stress[J]. Plant Omics, 2014, 7(3):178-187.
[14]Zhang L, Ma H. Complex evolutionary history and diverse domain organization of SET proteins suggest divergent regulatory interactions[J]. New Phytologist, 2011, 195(1):248-263.
[15]Lipsick JS. One billion years of Myb[J]. Oncogene, 1996, 13(2):223-235.
[16]Jiang C, Gu J, Chopra S, et al. Ordered origin of the typical twoand three-repeat Myb genes[J]. Gene, 2004, 326(2):13-22.
[17]Wilkins O, Nahal H, Foong J, et al. Expansion and diversification of the populus R2R3-MYB family of transcription factors[J]. Plant Physiology, 2009, 149(2):981-993.
[18]Takahashi T, Nakagoshi H, Sarai A, et al. Human A-myb gene encodes a transcriptional activator containing the negative regulatory domains[J]. FEBS Letters, 1995, 358(1):89-96.
[19]Foos G, Grimm S, Klempnauer KH. Functional antagonism between members of the myb family:B-myb inhibits v-myb-induced gene activation[J]. EMBO J, 1992, 11(12):4619-4629.
[20]Kranz H, Scholz K, Weisshaar B. c-MYB oncogene-like genes encoding three MYB repeats occur in all major plant lineages[J].Plant Journal, 2000, 21(2):231-235.
[21]Agarwal M, Hao YJ, Kapoor A, et al. A R2R3 Type MYB transcription factor Is involved in the cold regulation of CBF genes and in acquired freezing tolerance[J]. J Biol Chem, 2006, 281(49):37636-37645.
[22]Li Q, Zhang C, Li J, et al. Genome-wide identification and characterization of R2R3-MYB family in Cucumis sativus[J].PLoS One, 2012, 7(10):e47576.
[23]Riechmann JL, Heard J, Martin G, et al. Genome-wide comparative analysis among eukaryotes[J]. Science, 2000, 290(5499):2105-2110.
[24]Katiyar A, Smita S, Lenka SK, et al. Genome-wide classification and expression analysis of MYB transcription factor families in rice and Arabidopsis[J]. BMC Genomics, 2012, 13 :544.
[25]Du H, Feng BR, Yang SS, et al. The R2R3-MYB transcription factor gene family in maize[J]. PLoS One, 2012, 7(6):e37463.
[26]Du H, Yang SS, Liang Z, et al. Genome-wide analysis of the MYB transcription factor superfamily in soybean[J]. BMC Plant Biology, 2012, 12(7):106.
[27] Du H, Feng BR, et al. The R2R3-MYB transcription factor gene family in maize[J]. PLoS One, 2012, 7(6):e37463.
[28]Willcins O, Nahal H, Foong J, et al. Expansion and diversification of the Populus R2R3-MYB family of transcription factors[J].Plant Physiology, 2009, 149(2):981-993.
[29]Matus JT, Aquea R, Arce-Johnson P. Analysis of the grape MYB R2R3 subfamily reveals expanded wine quality-related glades and conserved gene structure organization across Vitis and Arabidopsis genomes[J]. BMC Plant Biology, 2008, 8(7):83.
[30]Braun EL, Grotewold E. Newly discovered plant c-myb-like genes rewrite the rvolution of the plant MYB gene family[J]. Plant Physiology, 1999, 121(1):21-24.
[31]段俊枝, 李莹, 周雷, 等. 利用基因工程技术提高水稻耐冷性的研究进展[J]. 浙江农业学报, 2015, 27(4):705-712.
[32]Cominelli E, Galbiati M, Vavasseur A, et al. A guard-cell-specific MYB transcription factor regulates stomatal movements and plant drought tolerance[J]. Curr Biol, 2005, 15(13):1196-1200.
[33]Seo PJ, Park CM. MYB96-mediated abscisic acid signals induce pathogen resistance response by promoting salicylic acid biosynthesis in Arabidopsis[J]. New Phy, 2010, 186(2):471-483.
[34]Ding ZH, Li SM, An XL, et al. Transgenic expression of MYB15 confers enhanced sensitivity to abscisic acid and improved drought tolerance in Arabidopsis thaliana[J]. Genetics and Genomics,2009, 36(1):17-29.
[35]Van dES, Verhagen BW, Van DR, et al. MYB72 Is required in early signaling steps of rhizobacteria-induced systemic resistance in Arabidopsis[J]. Plant Physiology, 2008, 146(3):1293-1304.
