干旱胁迫下灰色链霉菌对桔梗幼苗根际土壤酶活性、养分及微生物的影响
2018-01-31李堆淑何念武冀玉良
李堆淑,何念武,冀玉良
(商洛学院 生物医药与食品工程学院, 陕西 商洛 726000)

1 材料与方法
1.1 材料
灰色链霉菌(Streptomycesgriseus):购于中国工业微生物菌种保藏管理中心;桔梗种子来自陕西省商洛市天士力有限公司。
1.2 培养基
牛肉膏蛋白胨培养基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂18.0 g,水1 000 mL,pH 7.2~7.4。
高氏一号培养基:KNO31.0 g、FeSO4·7H2O 0.01 g、K2HPO40.5 g、淀粉20.0 g、MgSO4·7H2O 0.5 g、琼脂18.0 g、NaCl 0.5 g、蒸馏水1 000 mL,pH 7.2~7.4。
马铃薯培养基(PDA):马铃薯300 g、葡萄糖20 g、琼脂20 g、蒸馏水1 000 mL、自然pH。
种子培养基:可溶性淀粉20 g、酵母膏5 g、蛋白胨5 g、NaCl 5 g、K2HPO41 g、蒸馏水1 000 mL、pH 7.2。
发酵培养基:玉米粉20 g、黄豆饼粉15 g、CaCl20.2 g、MgSO40.2 g、NaCl 2.5 g、K2HPO42 g、柠檬酸钠2 g、硫酸铵0.75 g(溶解后加入)、Na2HPO42 g、蒸馏水1 000 mL,pH 7.0。
1.3 方法
1.3.1 发酵液的制备与浓度的配制 在活化的斜面灰色链霉菌菌种中加无菌水5 mL,刮下培养好的孢子,倒入装有适量玻璃珠的锥形瓶内,震荡15 min,打散孢子,制成一定浓度的孢子悬液,吸取1 mL菌悬液接种于三角瓶液体种子培养基中,于28℃,130 r·min-1的恒温培养振荡器中培养3 d后,按10%的接种量接于三角瓶(装有玻璃球)发酵培养基中,于28℃,130 r·min-1的恒温培养振荡器中培养5~7 d。将灰色链霉菌发酵液的原液配制成不同浓度(稀释为0,10,50,100,150倍,其中稀释为100倍的发酵液的菌数为1×108cfu·mL-1),备用。
1.3.2 桔梗的培养与处理 选取大小均匀、无病虫害的桔梗种子,用3%浓度的KMnO4浸泡消毒30 min,再用蒸馏水冲洗干净后自然晒干,备用。将直径9 cm的培养皿洗净烘干并铺上双层滤纸,然后加入10 mL蒸馏水,将桔梗种子放入,每皿50粒,在25℃、湿度为85.5%的人工气候箱中培养,每天补加蒸馏水以保持滤纸湿润。待桔梗幼苗生长至大约0.2 cm长度移栽至装有沙质土壤的小花盆中,每盆(直径15 cm×高度15 cm)土量为2.5 kg,将不同浓度的灰色链霉菌发酵液200 mL分别与花盆中的土搅拌,无菌水作为对照(CK),土壤的持水量控制在45%左右(采用环刀法测定),每盆15株,共60盆,摆放在实验室楼顶的平台上培养,生长至四叶期时,分别于7、14、21、28、35 d取桔梗根际土壤(0~20 cm),检测不同时间桔梗幼苗根际土壤酶活性变化,筛选最佳浓度的灰色链霉菌发酵液处理的桔梗根际土壤,测定土壤理化性质和微生物数量。
1.3.3 土壤酶活性测定 参考关松荫[16]的方法测定土壤酶活性,蔗糖酶活性测定用3,5-二硝基水杨酸比色法,以24 h后1 g干土生成葡萄糖毫克数表示。脲酶活性测定用苯酚钠比色法,以24 h后1 g土壤中NH3-N的毫克数表示。过氧化氢酶活性用高锰酸钾滴定法测定,以每克干土1 h内消耗的0.1 mol·L-1KMnO4溶液体积数表示。纤维素酶活性测定用3,5-二硝基水杨酸比色法,以72 h后1 g干土生成葡萄糖毫克数表示。蛋白酶活性测定用茚三酮比色法,以24 h后1 g土壤中的氨基氮的毫克数表示。
1.3.4 土壤理化性质测定 有机质含量采用重铬酸钾容量法测定,全氮含量采用浓硫酸—硫酸铜—硫酸钾—硒消解的凯氏定氮法测定,有效磷含量采用浓硫酸—高氯酸消解硫酸钼锑抗比色法测定,速效钾含量采用1.0 mol·L-1CH3COONH4浸提-火焰光度计法测定。
1.3.5 土壤微生物数量测定 采用稀释平板计数法[17],以土壤悬浊液稀释10-6接种于牛肉蛋蛋白胨琼脂培养基,24~48 h统计细菌数量,土壤悬浊液稀释10-4接种于高氏一号琼脂培养基,5~7 d统计放线菌数量,土壤悬浊液稀释10-2接种于PDA琼脂培养基,3~5 d统计真菌数量。
1.3.6 数据处理 采用Excel 2010和SPSS 17.0多重比较的Duncan进行整理和分析数据。
2 结果与分析
2.1 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤活性的影响
2.1.1 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤蔗糖酶活性的影响 将不同浓度灰色链霉菌菌株发酵液加入干旱胁迫的桔梗幼苗根际土壤,不同时间内测定桔梗土壤根际蔗糖酶活性。如表1所示,在桔梗育苗过程中,各组处理根际土壤蔗糖酶活性的变化动态规律基本相似。随着灰色链霉菌发酵液浓度稀释倍数的增加,桔梗根际土壤蔗糖酶活性也在增加,发酵液浓度稀释到100倍时,在7~35 d桔梗根际土壤蔗糖酶活性均显著高于对应时间的其它处理,并且在第14天,原液浓度稀释100倍时,桔梗根际土壤蔗糖酶活性达到峰值,为0.798±0.040 mg·g-1,比CK、灰色链霉菌稀释0,10,20,50,150倍的峰值分别高68%、12.55%、8.87%、7.98%、45.89%。用同种溶液浓度处理的桔梗根际土壤,在不同时间桔梗根际土壤蔗糖酶活性变化趋势为先升高后降低。说明低浓度的灰色链霉菌菌株发酵液对桔梗根际土壤蔗糖酶活性有一定的促进作用,还能缓解桔梗幼苗受干旱胁迫。因此,不同灰色链霉菌发酵液通过诱导桔梗根际土壤,可以提高灰色链霉菌菌株发酵液中的土壤肥力。

表1 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤蔗糖酶活性的影响
注:同列不同小写字母表示显著差异(P<0.05),下同。
Note: Different small letters within the same column mean significant difference(P<0.05), the same as below.
2.1.2 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤脲酶活性的影响 将不同浓度灰色链霉菌菌株发酵液加入干旱胁迫的桔梗幼苗根际土壤,不同时间内测定桔梗土壤根际脲酶活性。如表2所示,在不同浓度灰色链霉菌发酵液处理条件下,各组处理在7~35 d内桔梗根际土壤脲酶活性均有显著影响。随着灰色链霉菌发酵液稀释倍数的增加,桔梗根际土壤脲酶活性不断增加,灰色链霉菌发酵液稀释到100倍时,桔梗根际土壤脲酶活性均达到了峰值,随之桔梗根际土壤脲酶活性有下降趋势。但是用6种溶液处理的桔梗根际土壤脲酶活性随着时间的延长均显著增高(P<0.05)。处理第35天时,用灰色链霉菌发酵液稀释100倍处理的桔梗根际土壤脲酶活性的峰值最高(11.616±0.012 mg·g-1),比CK、灰色链霉菌发酵液稀释0、10、20、50、150倍分别升高了12.63%、6.64%、5.48%、3.37%、7.70%。可见经过灰色链霉菌发酵液处理的桔梗根际土壤肥力在7~35 d不断地增强,还能缓解桔梗幼苗受干旱胁迫。
2.1.3 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤过氧化氢酶活性的影响 将不同浓度灰色链霉菌菌株发酵液加入干旱胁迫的桔梗幼苗根际土壤,不同时间内测定桔梗土壤根际过氧化氢酶活性。如表3所示,在不同浓度灰色链霉菌发酵液处理条件下,各组处理在7~35 d内桔梗根际土壤过氧化氢酶活性均有显著影响。各处理的桔梗根际土壤过氧化氢酶(CAT)的活性均显著地高于CK,随着各处理时间的延长桔梗根际土壤过氧化氢酶活性均先升高后下降。CK的过氧化氢酶活性在处理后的28 d达到峰值(4.537±0.002 mg·g-1),其它处理均是在处理后的第21天达到峰值,其中灰色链霉菌菌株发酵液稀释100倍处理的桔梗根际土壤过氧化氢酶活性达到最大值(5.060±0.056 mg·g-1),分别比CK、灰色链霉菌发酵液稀释0、10、50、150倍的峰值分别提高了11.53%、7.67%、4.63%、1.87%、6.53%。可见,用灰色链霉菌发酵液稀释100倍能更有效地诱导一系列防御机制保护桔梗根际土壤免受氧化胁迫,但过量的过氧化氢则导致过氧化氢酶损失。可见,灰色链霉菌发酵液能缓解桔梗幼苗受干旱胁迫。
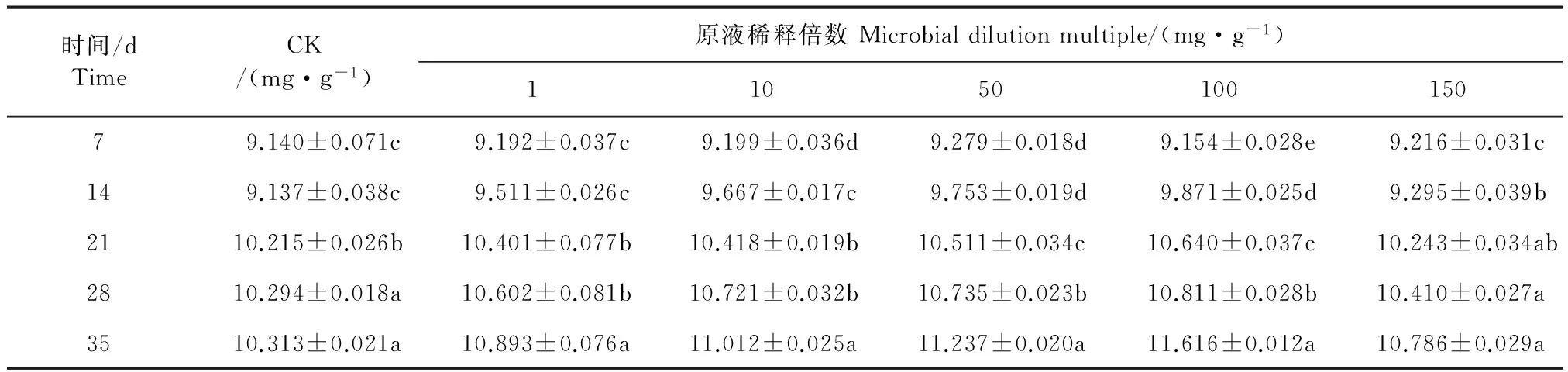
表2 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤脲酶活性的影响
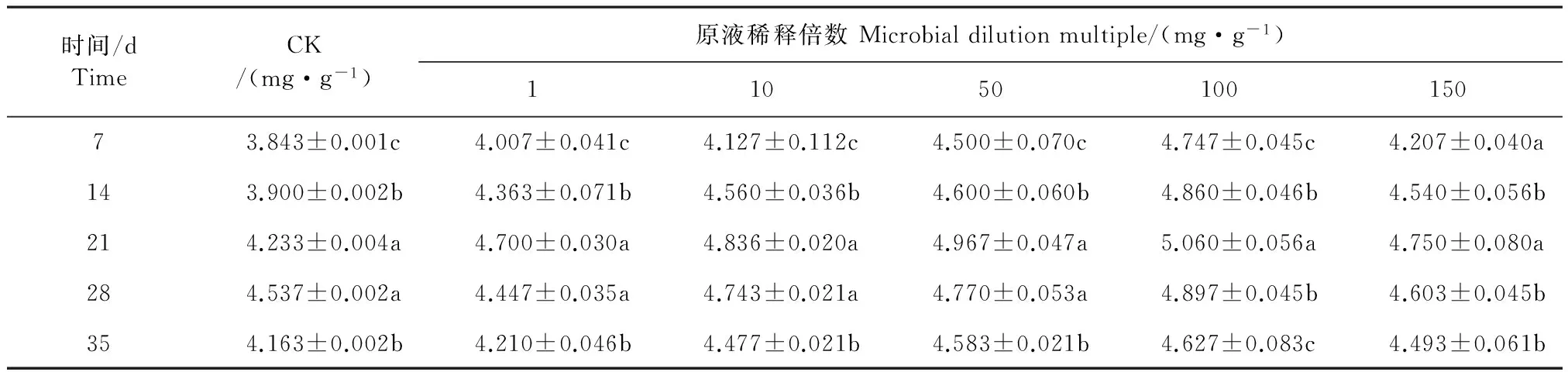
表3 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤过氧化氢酶活性的影响
2.1.4 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤纤维素酶活性的影响 将不同浓度灰色链霉菌菌株发酵液加入干旱胁迫的桔梗幼苗根际土壤,不同时间内测定桔梗土壤根际纤维素酶活性。如表4所示,干旱胁迫的桔梗根际土壤纤维素酶活性较小,在不同浓度灰色链霉菌发酵液处理条件下,各组处理在7~35 d内桔梗根际土壤纤维素酶活性变化较显著(P<0.05)。各处理的桔梗根际土壤纤维素酶活性均显著高于CK,施加灰色链霉菌发酵液能使桔梗根际土壤纤维素酶活性提前达到峰值。随着桔梗的生长,不同浓度的灰色链霉菌发酵液处理的桔梗根际土壤纤维素酶活性均在处理后的第28天达到峰值,而CK在第35天达到峰值。从整体看,用灰色链霉菌发酵液稀释100倍处理的桔梗根际土壤纤维素酶活性在7~35 d内均高于其它处理的对应时间的纤维素酶活性。用灰色链霉菌发酵液稀释100倍处理的桔梗根际土壤纤维素酶活性峰值(0.897±0.021 mg·g-1),分别比CK、灰色链霉菌发酵液稀释0、10、50、150倍的峰值分别提高了128.24%、85.71%、34.48%、22.37%、30.57%。土壤纤维素酶分解的纤维素越多,土壤肥力就越高,作物产量也越高,可见,灰色链霉菌发酵液能很好地促进桔梗根际土壤分解纤维素。
2.1.5 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤蛋白酶活性的影响 将不同浓度灰色链霉菌菌株发酵液加入桔梗幼苗的根际土壤,不同时间内测定桔梗土壤根际土壤蛋白酶活性。如表5所示,在不同浓度灰色链霉菌发酵液处理条件下,各组处理在7~35 d内桔梗根际土壤蛋白酶活性变化显著。用灰色链霉菌发酵液处理的桔梗根际土壤蛋白酶活性随着桔梗生育期的延长呈先升高后降低的变化趋势,但CK的桔梗根际土壤蛋白酶活性在7~35 d内一直升高,并且在同一生育期桔梗根际土壤蛋白酶活性总是低于其它处理,土壤中蛋白酶活性反映了土壤中氮素营养的转化状况,说明CK处理的土壤中的氮素水平较低。用灰色链霉菌菌株发酵液稀释100倍处理的桔梗根际土壤蛋白酶活性峰值(1.748±0.028 mg·g-1),分别比CK、灰色链霉菌菌株发酵液0、10、50、150倍的峰值分别提高了43.51%、33.33%、34.67%、27.50%、23.56%。从整体看,用灰色链霉菌菌株发酵液稀释100倍处理的桔梗根际土壤蛋白酶活性,在不同生长时间均比对应的其它处理的桔梗根际土壤蛋白酶活性显著提高(P<0.05),说明了土壤肥力越高,土壤供应养分的能力越强,桔梗幼苗生长越好。可见,灰色链霉菌发酵液可以缓解桔梗幼苗受干旱胁迫。
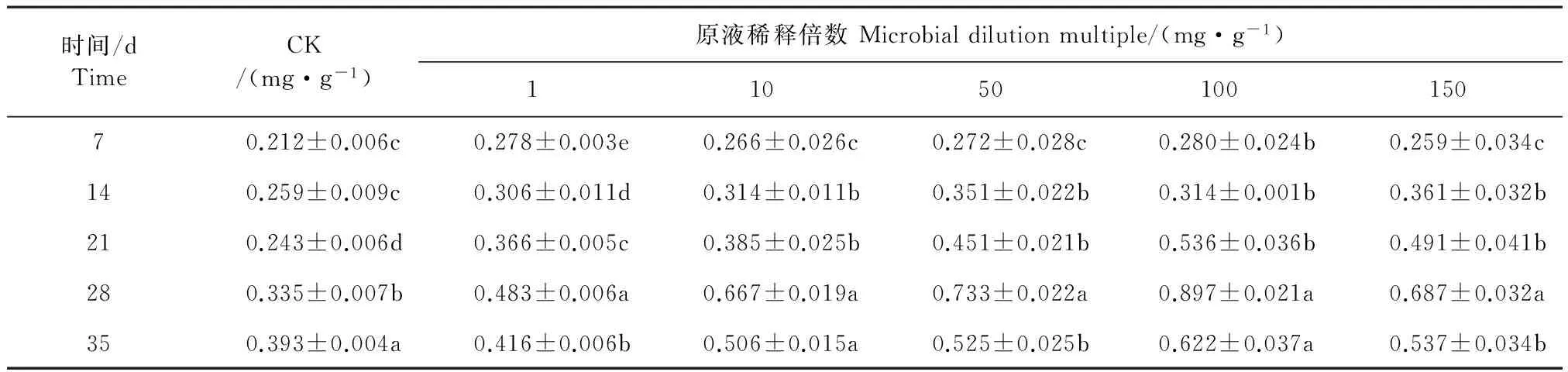
表4 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤纤维素酶活性的影响
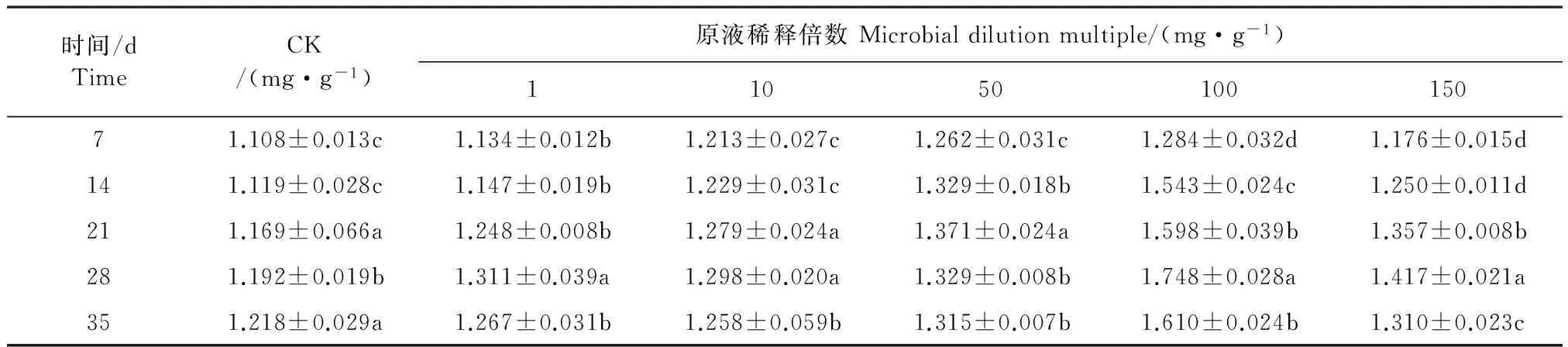
表5 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤蛋白酶活性的影响
2.2 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤理化性质的影响
如表6可见,用稀释100倍的灰色链霉菌发酵液处理干旱胁迫的桔梗幼苗根际土壤,在0~35 d内桔梗根际土壤肥力因素的变化趋势基本一致。随着灰色链霉菌发酵液处理时间的延长,土壤有机质、全氮、有效磷和速效钾含量均不断增加,在第35天时,土壤有机质、全氮、有效磷和速效钾含量均达到最高值,分别比CK升高了280.13%、99.15%、60%和60.12%。
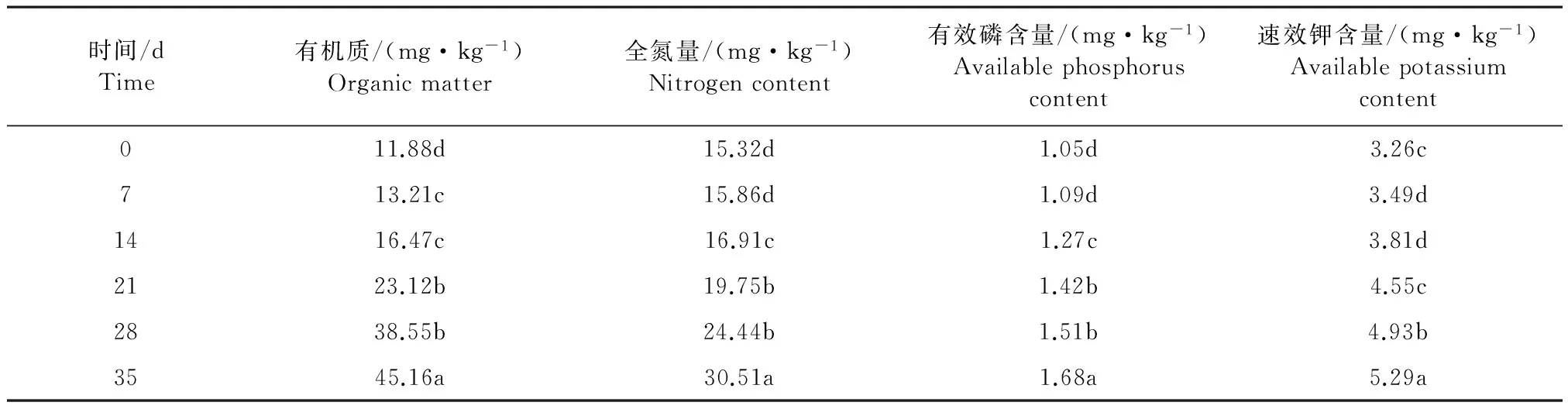
表6 灰色链霉菌发酵液(稀释100倍)对干旱胁迫的桔梗根际土壤理化性质的影响
2.3 灰色链霉菌发酵液对干旱胁迫的桔梗根际土壤微生物的影响
如表7可见,用稀释100倍的灰色链霉菌发酵液处理干旱胁迫的桔梗根际土壤,在0~35 d内桔梗根际土壤微生物群落的数量细菌占优势。随着处理时间的延长,细菌的数量一直增加,而放线菌和真菌的数量先升高后降低。在桔梗根际土壤处理的第35天时细菌数量最多比未处理土壤的细菌数量增加了355.43%,在桔梗根际土壤处理的第28天时放线菌和真菌数量均达到最高值,分别比未处理土壤的放线菌和真菌数量增加了253.70%和223.38%。可见,用稀释100倍的灰色链霉菌发酵液处理桔梗根际土壤,土壤中微生物群落在整个生长过程变化差异显著(P<0.05),并且细菌数量的增长分别比放线菌和真菌快101.73个和132.05个百分点。
2.4 桔梗根际土壤酶、土壤理化性质、土壤微生物的相关性
如表8可见,用稀释100倍的灰色链霉菌发酵液处理干旱胁迫的桔梗根际土壤,在0~35 d内桔梗根际土壤酶活性、土壤肥力、微生物之间存在一定的相关性。土壤酶活性与土壤酶活性之间的相关性表现为:蔗糖酶与过氧化氢酶正相关显著(r=0.849,P<0.05),脲酶与纤维素酶正相关显著(r=0.825,P<0.05),其它土壤酶之间相关但差异不显著(P>0.05)。土壤酶活性与土壤肥力含量、微生物数量的相关性表现为:脲酶与有机质、全氮、有效磷、速效钾含量和细菌数量分别为正相关且极显著(P<0.01);纤维素酶与有机质、全氮含量和细菌数量分别为正相关且极显著(P<0.01),而与有效磷、速效钾含量和放线菌数量分别为正相关且显著(P<0.05);蛋白质酶与放线菌数量正相关且极显著(P<0.01),而与有机质、有效磷、速效钾含量和细菌、真菌数量分别为正相关且显著(P<0.05)。土壤肥力含量之间相关性表现为:有机质含量与全氮、有效磷、速效钾含量分别为正相关且极显著(P<0.01),全氮含量与有效磷、速效钾含量分别为正相关且极显著(P<0.01),有效磷与速效钾含量为正相关且极显著(P<0.01)。土壤肥力含量与土壤微生物数量相关性表现为:细菌分别与有机质、全氮、有效磷、速效钾含量呈正相关且极显著(P<0.01),而放线菌含量分别与有机质、有效磷、速效钾、细菌数量正相关且显著(P<0.05),真菌数量与放线菌数量正相关且显著(P<0.05)。
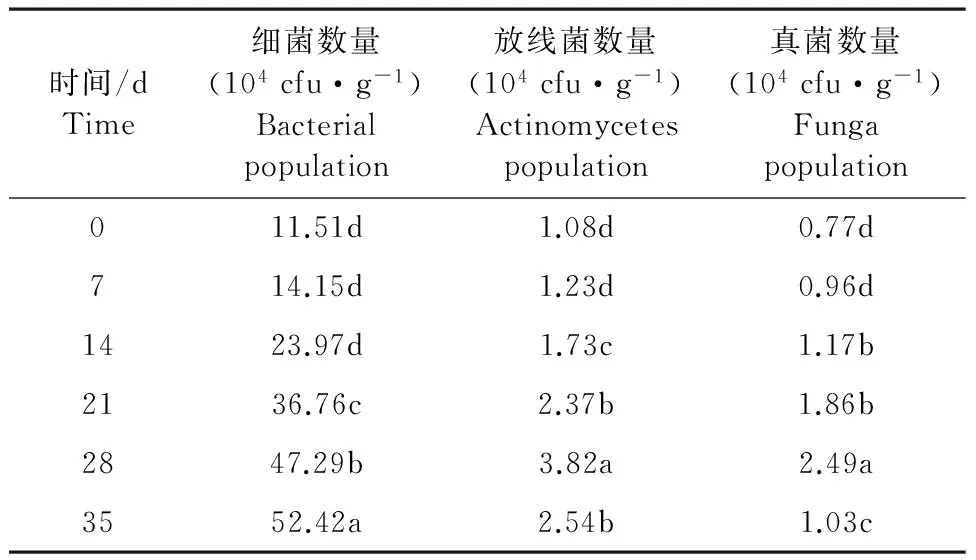
表7 灰色链霉菌发酵液(稀释100倍)对干旱胁迫的桔梗根际土壤微生物的影响
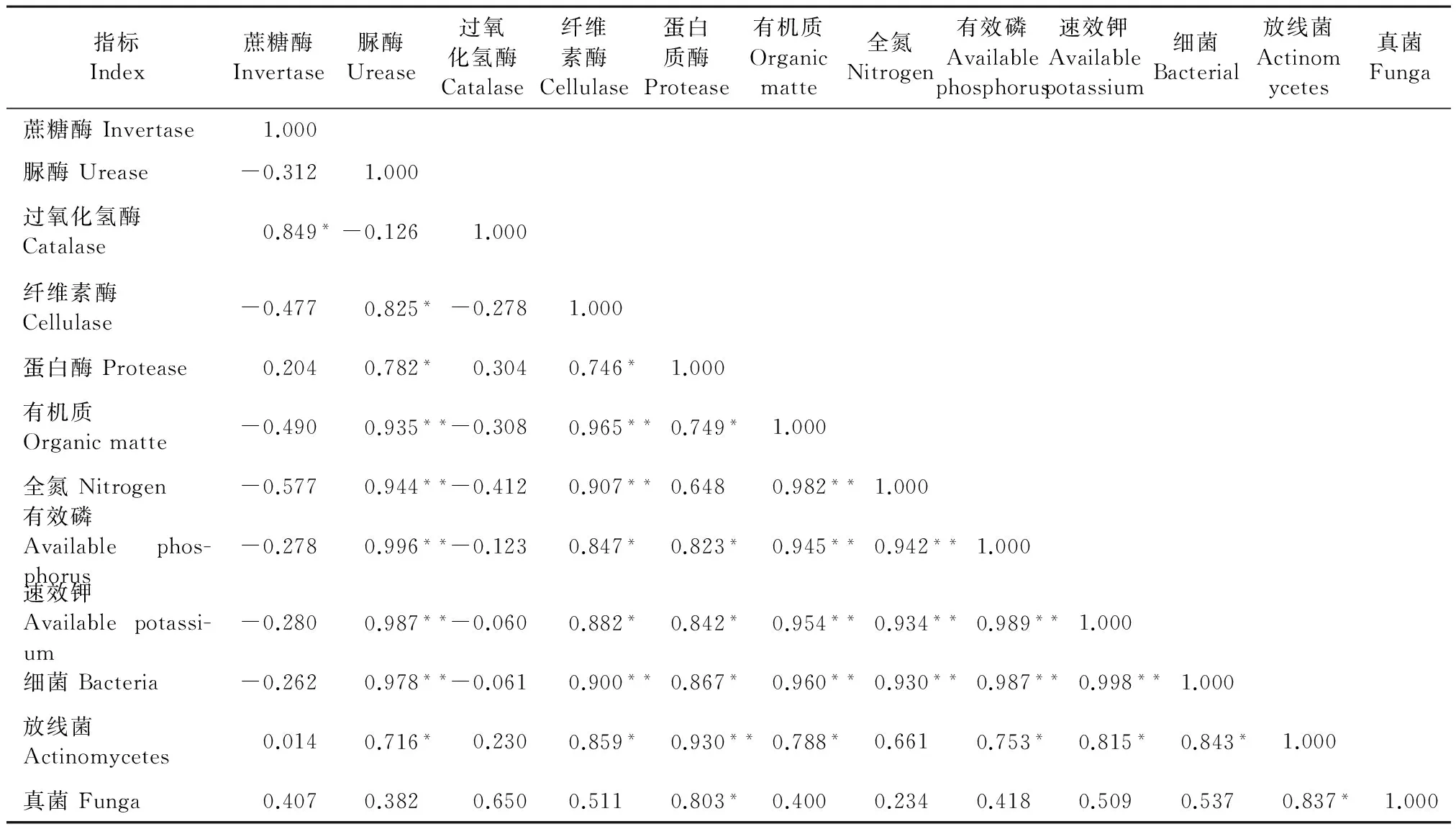
表8 桔梗根际土壤酶活性、土壤理化性质和土壤微生物的相关性
注:*表示P<0.05,**表示P<0.01。 Note: *P<0.05, **P<0.01.
3 讨 论
土壤酶活性可以作为评价土壤肥力状况的生物指标,蔗糖酶与土壤有机质、氮、磷含量和微生物数量有关。本研究用不同浓度灰色链霉菌发酵液处理干旱胁迫的桔梗根际土壤,发现桔梗根际土壤的蔗糖酶、脲酶、过氧化氢酶、蛋白酶、纤维素酶活性比CK均显著提高,尤其稀释100倍的灰色链霉菌发酵液比其它浓度更为显著(P<0.05)。由于土壤脲酶能促进土壤中氮素循环,提高土壤肥力。过氧化氢酶活性与土壤中H2O2含量密切相关,H2O2可以杀死病原菌,还能诱导一系列防御酶系统。土壤纤维素酶有助于腐殖质的形成,促进纤维素分解利用,是自然界碳循环的重要环节,最终提高土壤肥力,增加农作物的产量。土壤蛋白酶也能促进土壤中氮素循环。可见,灰色链霉菌发酵液随着浓度的稀释,土壤氮素、碳素的循环转化速率不断提高,腐殖质形成和有机质的转化能力不断增强,直到灰色链霉菌发酵液稀释到100倍,土壤氮素、碳素的循环转化速率、腐殖质形成和有机质的转化能力达到最高值,桔梗根际土壤的蔗糖酶、过氧化氢酶、蛋白酶和纤维素酶活性均是随着灰色链霉菌发酵液处理时间的延长,此4种土壤酶活性均先升高后降低;而脲酶活性在0~35 d内一直升高,并且此4种土壤酶活性均显著高于CK。灰色链霉菌发酵液使干旱胁迫的桔梗根际土壤微生物群落中细菌占优势,细菌的数量一直增加,而放线菌和真菌的数量先升高后降低。可见,施加灰色链霉菌有利于干旱胁迫的桔梗幼苗根际土壤酶活性的提高,间接的促进了土壤微生物的生长,增加了土壤中微生物群落的数量,能促进土壤肥力提高,说明灰色链霉菌能缓解桔梗幼苗受干旱胁迫。此结果与高吉坤[18]研究枯草芽抱杆菌B29有利于提高土壤中蔗糖酶、脲酶、过氧化氢酶、酸性磷酸酶活性的结果基本一致。刘慧芬[19]发现刺槐根瘤固氮菌放氮有利于增加土壤微生物,能提高脱氢酶、过氧化氨酶、脲酶、转化酶等土壤酶活性。
本研究发现桔梗根际土壤蔗糖酶与过氧化氢酶、脲酶与纤维素酶、蛋白酶呈显著正相关,可以促进氮素循环,说明桔梗根际土壤中这5种酶之间关系密切,它们共同影响着土壤肥力。土壤中微生物之间的关系为:细菌与放线菌、放线菌与真菌呈显著正相关,且细菌在微生物群落中占优势。这与何芳兰[20]研究沙化高寒草甸土壤中细菌是土壤微生物的主要成分的结果基本一致。土壤肥力之间的关系为土壤有机质与全氮、有效磷、速效钾互相呈极显著正相关。土壤酶活性与土壤肥力、微生物数量的关系为脲酶与有机质、全氮、有效磷、速效钾和细菌呈极显著正相关,纤维素酶与有机质、全氮、有效磷、速效钾、细菌和放线菌呈极显著或显著正相关,蛋白酶与有效磷、速效钾、细菌、放线菌和真菌呈极显著或显著正相关,蔗糖酶和过氧化物酶与有机质、全氮、有效磷、速效钾和细菌呈负相关且不显著,与放线菌和真菌正相关且不显著。从土壤酶活性、土壤肥力、微生物数量之间的相关性可以看出,土壤酶活性影响着土壤肥力和微生物数量变化,土壤肥力同时影响着土壤酶活性和微生物数量变化,它们之间是相互影响、相互制约的。这与王笛等[21-22]研究结果基本一致。
[1] 张 承,龙友华,和桂秋,等.生长调节剂浸种对桔梗种子萌发及生长的影响[J].中药材,2015,28(1):22-25.
[2] 黄世文,高成伟,王 玲,等.土壤中有益放线菌的高效分离,筛选和生物测定技术[J].植物保护,2008,34(1):138-141.
[3] 许世俊,薛泉宏,邢胜利,等.3株放线菌对草莓的促生作用及对PPO活性的影响[J].西北农业学报,2008,17(1):129-136.
[4] Janos Berdy. Bioactive microbial metabolites, a personal review[J]. J Antiblot, 2005,58(1):1-26.
[5] 姜 怡,徐 平,娄 恺,等.放线菌药物资源开发面临的问题与对策[J].微生物学通报,2008,35(2):272-274.
[6] 倪 彬.巨桉人工林根系土壤微生物根系土壤酶活性与根系土壤养分研究[D].成都:四川农业大学,2007:9-10.
[7] 徐 锴,赵德莫,袁继存,等.地膜和秸秆覆盖对梨园土壤酶活性的影响[J].中国南方果树,2014,43(6):94-96.
[8] 陈 珏.水土保持林地根系分泌物及土壤酶活性研究[D].北京:北京林业大学,2011:7-9.
[9] 李俊华,沈其荣,褚贵新,等.氨基酸有机肥对棉花根际和非根际土壤酶活性和养分有效性的影响[J].土壤,2011,43(2):277-284.
[10] 耿增超,刘莉丽,毕春侠.秦岭南坡锐齿栎林、松栎混交林几种土壤酶活性的初步研究[J].西北林学院学报,1999,14(1):64-67.
[11] Kandeler E, Luxhi J, Tscherko J, et al. Xylanase, invertase and protease at the soil-litterinter face of a loamy sand[J]. Soil Biology and Biochemistry, 1999,31:1171-1179.
[12] 李 敏,吴凤芝.不同填闲模式对黄瓜根际土壤酶活性及细菌群落的影响[J].应用生态学报,2014,25(12):3556-3562.
[14] 司 鹏,邵 微,于会丽,等.甜樱桃重茬土壤有效养分及酶活性的变化[J].干旱地区农业研究,2017,35(4):39-44.
[15] 王丽红,郭晓冬,谭雪莲,等.不同轮作方式对马铃薯土壤酶活性及微生物数量的影响[J].干旱地区农业研究,2016,34(5):109-113.
[16] 关松荫.土壤酶及其研究方法[M].北京:中国农业出版社,1987:1-304.
[17] 林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010.
[18] 高吉坤.施加生防菌B29对黄瓜根际土壤微生物多样性的影响[D].哈尔滨:黑龙江大学,2013:29-32.
[19] 刘慧芬.刺槐根瘤固氮放氮对根际土壤微生物的影响[D].西安:西北大学,2010:51-52.
[20] 何芳兰,金红喜,王锁民,等.沙化对玛曲高寒草甸土壤微生物数量及土壤酶活性的影响[J].生态学报,2016,36(18):1-8.
[21] 王 笛,马风云,姚秀粉,等.黄河三角洲退化湿地土壤养分、微生物与土壤酶特性及其关系分析[J].中国水土保持科学,2012,10(5):94-98.
[22] 许景伟,王卫东,李 成.不同类型黑松混交林土壤微生物、酶及其与土壤养分关系的研究[J].北京林业大学学报,2000,22(1):51-55.