植物生长调节剂对马铃薯叶片生理代谢及产量品质的影响
2018-01-31赵晶晶冯乃杰郑殿峰张盼盼崔洪秋梁晓艳
赵晶晶,冯乃杰,郑殿峰,李 东,张盼盼,崔洪秋,梁晓艳,于 奇
(1.黑龙江八一农垦大学农学系化控研究室/黑龙江省高校寒地作物种质改良与栽培重点实验室, 黑龙江 大庆 163319;2.黑龙江省农业科学院大庆分院, 黑龙江 大庆 163316)

目前,关于PGRs对马铃薯块茎膨大期叶片的生理代谢及产量、品质形成机理的研究较少且欠缺系统性,尤其是DPC对马铃薯叶片生理活性的影响尚未见报道。因此,本试验选用促进型调节剂DTA-6、延缓型调节剂S3307和DPC为供试药剂,系统研究了三种调节剂对马铃薯叶片生理代谢及产量品质形成的影响,旨在探讨PGRs提高马铃薯产量及改善其品质的机理,为PGRs在马铃薯生产上的应用提供科学依据。
1 材料与方法
1.1 试验设计
试验于2015年在黑龙江农垦九三管局进行。试验地土壤类型为黑钙土,地势平坦,肥力均匀,0~20 cm耕层土壤基本状况:碱解氮含量为266 mg·kg-1,有效磷含量为38.1 mg·kg-1,速效钾含量为183 mg·kg-1,有机质含量为55.1 g·kg-1,pH值为6.25。试验于5月14日播种,小区采用完全随机区组设计,6垄区,垄长8.0 m,垄距0.9 m,垄作方式种植。供试品种为克新13。于块茎膨大期(7月23日)进行叶面喷施调节剂,设4个处理:(1) 对照,喷施清水,(2) DTA-6,浓度30 mg·L-1,(3) DPC,浓度200 mg·L-1,(4) S3307,浓度40 mg·L-1,用量均为225 L·hm-2,处理和对照各设4次重复。田间管理与常规相同,9月5日进行收获。
1.2 取样方法
喷药后第2天开始第一次取样,以后每隔8 d取1次样,取样时每个小区选有代表性植株6 株,取马铃薯功能叶片速冻于液氮中,再转入-40℃冰箱中备用。收获后,在室内采用十字切割法割取留样块茎,测定其品质指标。
1.3 测定项目与方法
于块茎膨大期用便携式叶绿素仪分别测定各处理功能叶片的叶绿素值,采用Li-6400便携式光合仪(美国,Li-Cor公司)测定功能叶片的光合速率(Pn)、蒸腾速率(Tr)和细胞间隙CO2浓度(Ci),测定时光照强度设为1 000 μmol·m-2·s-1。
淀粉和可溶性糖含量采用蒽酮比色法[9]测定;还原糖含量采用3,5-二硝基水杨酸法[9]测定;蔗糖含量采用间苯二酚法测定[10],蛋白质含量采用考马斯亮蓝G-250法[11]测定;酚类物质含量采用Folin-酚试剂法[11]测定。
产量测定方法:在马铃薯成熟期考种测产,各小区随机选取2 m2进行测产,最后根据公式计算产量和淀粉产量,产量(kg·hm-2)=单株薯数×单薯重×密度/1000;淀粉产量(kg·hm-2)=鲜薯产量×淀粉含量。
1.4 统计与分析
数据处理及作图采用Mirosoft Excel 2003 进行,采用SPSS 19.0对数据进行显著性检验及相关分析。
2 结果与分析
2.1 植物生长调节剂对马铃薯产量和淀粉产量的影响
从表1可以看出,叶面喷施PGRs均显著增加了单薯重、单株薯数、淀粉产量和鲜薯产量,DTA-6调控效果最佳,其次为S3307,DPC处理效果较差,单薯重分别比对照增加10.40%、5.41%和7.98%,淀粉产量分别比对照增加40.26%、25.29%和36.63%,鲜薯产量分别比对照增加26.56%、15.64%和26.12%,经方差分析可知,处理与对照之间差异均达极显著水平。调节剂处理虽增加了马铃薯的单株薯数,但处理与对照间差异不显著,其增产作用主要依靠单薯重量的增加。
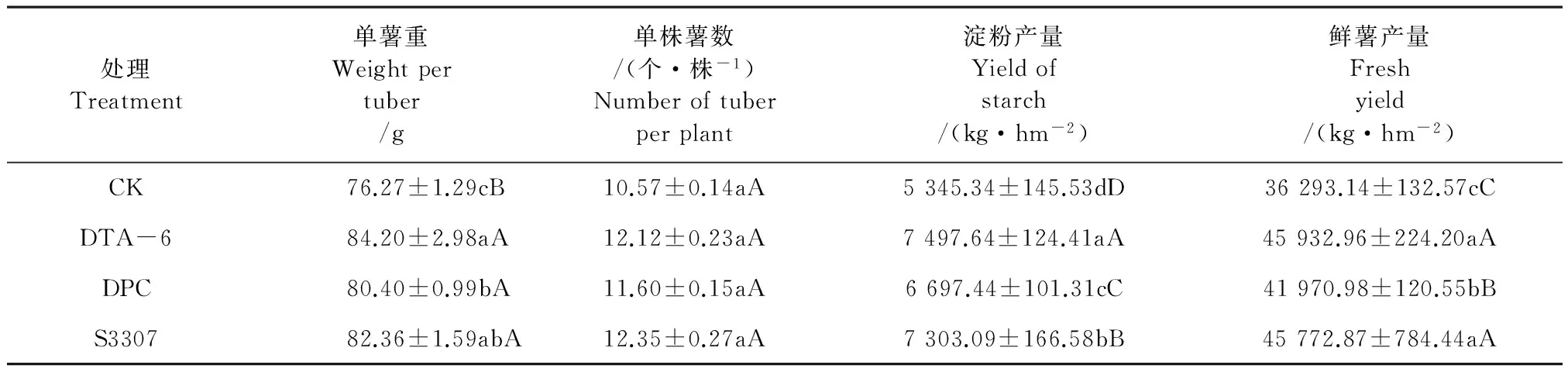
表1 植物生长调节剂对马铃薯产量和淀粉含量的影响
注:同列不同小写字母分别表示处理间差异显著(P<0.05),不同大写字母表示处理间差异极显著(P<0.01),下同。
Note: Lowercase and capital letters indicate difference at 0.05 and 0.01 levels of probability, respectively. The same as below.
2.2 植物生长调节剂对马铃薯光合特性的影响
作物叶片的叶绿素相对含量(SPAD)、净光合速率(Pn)、细胞间隙CO2浓度(Ci)和蒸腾速率(Tr)是衡量作物光合作用的重要生理指标。研究认为[12],马铃薯盛花期是薯块膨大的关键时期,此时叶片的光合能力是影响光合产物积累和最终产量高低的重要因素。
如表2所示,叶面喷施调节剂后,DTA-6、DPC、S3307对叶片SPAD的调控效果分别比对照增加11.96%、9.46%和9.22%,处理与对照之间差异极显著。调节剂对叶片Pn和Tr的调控效果依次为DTA-6、S3307、DPC,处理的Pn比对照分别增加39.14%、30.82%和10.04%,处理的Tr比对照分别增加43.15%、42.77%和43.15%,处理与对照之间差异极显著。S3307对叶片Ci的调控效果最佳,其次为DPC,DTA-6处理效果较差,处理比对照分别增加20.16%、12.56%和11.78%,处理与对照之间差异极显著。块茎膨大期,叶片的SPAD、Pn、Tr和Ci数值越大,叶片产生和积累的光合产物就越多,相关分析表明(表3),SPAD与产量呈极显著正相关,Pn、Tr和Ci与产量呈正相关,这说明叶片SPAD、Pn、Tr和Ci与产量的关系密切,这些光合特性指标可以用作判断PGRs对马铃薯增产调控的重要参考依据之一。
2.3 植物生长调节剂对马铃薯叶片碳代谢的影响
2.3.1 植物生长调节剂对马铃薯叶片淀粉含量的影响 淀粉是马铃薯叶片的光合终产物之一,其含量高低也反映了“源”器官的供应能力[13]。如图1所示,喷药后2~26 d,块茎正处于膨大期,需要消耗大量的光合同化产物,而当地正值降水季节,持续的阴雨天气导致叶片的光合作用减弱,致使叶片淀粉含量降低。喷药后26~34 d,降雨量减少,较大的日温差和充足的光照使叶片的光合作用增强,叶片内淀粉含量迅速升高。喷药后第34天,调节剂对叶片淀粉含量的调控效果依序为DPC、S3307、DTA-6,处理比对照分别降低1.01%、5.60%和25.04%,DPC和S3307与对照之间差异不显著,DTA-6与对照之间差异极显著,说明此阶段调节剂处理能够加快叶片内淀粉的分解,利于产生更多的蔗糖运输到块茎中,为块茎内碳水化合物的合成奠定了基础。

表2 植物生长调节剂对马铃薯叶片光合特性的影响

表3 马铃薯光合特性与产量之间的相关性
注:“**”表示相关性在0.01水平极显著差异,下同。
Note: **, means significant difference at the 0.01 levels; the same as below.

图1植物生长调节剂对马铃薯叶片淀粉含量的影响
Fig.1 Effects of PGRs on starch content of potato leaf
2.3.2 植物生长调节剂对马铃薯叶片蔗糖含量的影响 马铃薯叶片运输的光合产物主要以蔗糖的形式通过韧皮部运输到块茎,蔗糖含量的增加有利于提高“源”端同化物的供应能力[14]。由图2分析可知,PGRs对马铃薯叶片蔗糖含量的调控效果一致。随着喷施调节剂时间的推进,叶片蔗糖含量呈先降低后升高的变化趋势,在喷施调节剂后第18天下降到最低值,此时块茎正处于膨大中期,库器官的建成与发育需要源器官提供充足的能量与碳骨架,故此时叶片内的蔗糖含量降低有利于块茎的膨大,经方差分析可知,S3307和DTA-6与对照之间差异显著,DPC与对照之间差异极显著。喷药后第34天,S3307对叶片蔗糖含量的调控效果最佳,DPC次之,DTA-6较差,处理比对照分别增加56.51%、44.07%和38.95%,处理与对照之间差异极显著,说明此阶段调节剂处理能够增加叶片内蔗糖含量的积累,提高“源”端同化物的供应能力,为块茎膨大和淀粉积累提供了充足的“碳”源。

图2植物生长调节剂对马铃薯叶片蔗糖含量的影响
Fig.2 Effects of PGRs on sucrose content of potato leaf
2.4 植物生长调节剂对马铃薯叶片碳代谢相关酶活性的影响
2.4.1 植物生长调节剂对马铃薯叶片淀粉酶活性的影响 淀粉酶主要包括α-淀粉酶和β-淀粉酶,其对调节和平衡碳水化合物的形态起重要作用,在一定程度上可加快淀粉的分解[15]。从图3分析可知,处理与对照的淀粉酶活性均呈缓慢下降的变化趋势。喷药后第10天,DTA-6处理效果最佳,S3307次之,DPC较差,处理比对照分别增加58.45%、45.89%和39.79%,方差分析可知,DTA-6和S3307与对照之间差异均达极显著水平,DPC与对照之间差异达显著水平,说明此阶段调节剂能够加快叶片内淀粉的分解,产生更多的蔗糖运输到块茎中,进而促进块茎的膨大和淀粉的积累。
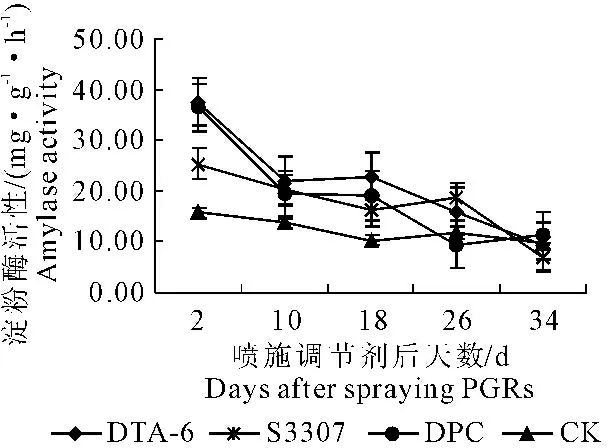
图3植物生长调节剂对马铃薯叶片淀粉酶活性的影响
Fig.3 Effect of PGRs on amylase activity of potato leaf
2.4.2 植物生长调节剂对马铃薯叶片蔗糖转化酶活性的影响 蔗糖转化酶是一种水解酶,能将蔗糖水解为等量的葡萄糖和果糖,而其产物己糖在植物发育和代谢中具有重要作用[16]。PGRs对叶片蔗糖转化酶活性的调控效果如图4所示。喷药后第2天,DTA-6处理提高了转化酶活性,S3307和DPC降低了转化酶活性,经方差分析可知,DTA-6和DPC与对照之间差异极显著,S3307与对照之间差异不显著。喷药后第34天,S3307对叶片转化酶活性的调控效果最佳,DPC次之,DTA-6处理效果较差,处理比对照分别增加28.68%、25.15%和6.18%,方差分析可知,处理与对照之间差异极显著,转化酶活性的高低影响叶片蔗糖输出量的多少,调节剂提高后期叶片转化酶活性有利于块茎发育。
2.5 植物生长调节剂对马铃薯块茎品质的影响
淀粉、蛋白质、还原糖、可溶性糖和酚类物质均储藏在蔬菜的可食用部分,是决定块茎营养品质的重要指标[17]。叶面喷施PGRs对马铃薯块茎品质的调控效果如表4所示。调节剂对块茎淀粉和可溶性糖含量的调控效果以DTA-6为最佳,DPC次之,S3307调控效果较差,淀粉含量分别比对照增加11.32%、8.87%和8.87%,处理与对照之间差异显著;就块茎内蛋白质含量而言,S3307处理的效果最佳,DPC次之,DTA-6较差,调节剂对块茎内淀粉和蛋白质含量的调控效果相反。此外,DTA-6处理的还原糖含量比对照降低20%,DTA-6与对照之间差异极显著,用于食品加工的马铃薯特别是煎炸食品,要求还原糖含量低于0.50%,说明DTA-6更有利于块茎品质的改善。

表4 植物生长调节剂对马铃薯块茎品质的影响

图4植物生长调节剂对马铃薯叶片转化酶活性的影响
Fig.4 Effect of PGRs on invertase activity of potato leaf
3 讨 论
3.1 植物生长调节剂对马铃薯叶片光合特性及产量的影响
光合作用是植物有机物质合成、能量贮存与转化的基础,王惠群等[18]认为调节剂可促进植株光合色素含量的增加,从而使Pn提高,但调节剂浓度过高则会抑制植株叶片的生长,降低其Pn。本试验中,叶面喷施PGRs后,就叶片SPAD、Pn、Tr以及单薯重、淀粉产量和鲜薯产量而言,DTA-6处理效果最佳,其次为S3307,DPC效果较差,块茎膨大的一个重要指标是同化物的累积,这种累积与光合作用关系密切,且反映了光合产物即碳水化合物的累积特征,通过相关分析可知,马铃薯产量与叶片SPAD呈极显著正相关,与Pn、Tr和Ci呈正相关,这说明叶片SPAD、Pn、Tr和Ci与产量的关系密切,推断这可能是调节剂能够使马铃薯增产的原因之一。
3.2 植物生长调节剂对马铃薯叶片碳代谢的影响
叶片中的蔗糖和淀粉是植物体内主要的碳水化合物,在植株代谢过程中起着重要的作用。有研究表明,叶面喷施调节剂在一定程度上可提高马铃薯叶片中淀粉酶活性,调控地下主茎的蔗糖和淀粉含量[8]。宋春艳等[19]认为PGRs可提高大豆叶片的蔗糖、总糖和淀粉含量,改善叶片中碳代谢相关生理指标。蔗糖是主要的光合产物,任何导致光合能力升高的措施都会引起“源”端蔗糖供给量的上升[20],调节剂加快蔗糖的积累和分配可以促进库器官内碳水化合物的合成。本研究可以看出,叶面喷施PGRs后第2天和18天,调节剂处理的淀粉含量均显著高于对照,说明块茎膨大期喷施PGRs,提高了“源”端碳同化物的供应能力,为块茎的膨大和淀粉的积累提供了物质保障。喷施PGRs后18~34 d,处理的蔗糖含量一直处于上升阶段,喷药后第34天,调节剂均显著提高叶片蔗糖含量,本研究结果与以往研究相一致[7,19]。随着生育进程的推进,叶片淀粉含量与淀粉酶活性呈极显著负相关(r=-0.31**),这说明淀粉酶促进了叶片中淀粉的降解,为块茎膨大和淀粉积累提供了充足的“碳”源和能量,推断这可能是调节剂增产和改善品质的另一重要因素。
4 结 论
综上所述,在马铃薯块茎膨大期喷施PGRs后,各调节剂均显著增加了单薯重、淀粉产量和鲜薯产量,其中,DTA-6的调控效果最佳,与CK单薯重、淀粉产量和鲜薯产量相比分别增加了10.40%、40.26%和26.56%;叶面喷施PGRs对马铃薯块茎品质的调控效果以DTA-6为最佳,淀粉含量比对照增加了11.32%,还原糖含量比对照降低了20%。调节剂处理的SPAD、Pn、Tr和Ci均显著高于对照,SPAD与产量呈极显著正相关,Pn、Tr和Ci与产量呈正相关。喷药后第34天,各调节剂均降低了叶片淀粉含量,增加了叶片蔗糖含量,提高了叶片转化酶活性。从而可以看出,三类调节剂均促进了马铃薯叶片生理代谢,延长了叶片的功能期,最终实现了产量的提高和品质的改善。
[1] Poling S M, Hsu W J, Koehrn F J. Chemical regulation of carotenoid biosynthesis,Part 10: Chemical induction of β-carotene biosynthesis[J]. Phytochemistry, 1977,16(5):551-555.
[2] Poling S M, Hsu W J, Yokoyama H. Synthetic bioregulators of poly-cis carotenoid biosythesis[J]. Phytochemistry, 1982,21(3):601-604.
[3] 赵黎明,郑殿峰,冯乃杰,等.植物生长调节剂对大豆叶片光合特性及糖分积累的影响[J].大豆科学,2008,27(3):442-446,450.
[4] Zhao D L, Oosterhuis D M. Pix plus and mepiquat chloride effects on physiology, growth and yield of field-grown cotton[J]. Plant Growth Regul, 2000,19:415-422.
[5] 陈晓光,李洪民,张爱君,等.不同氮水平下多效唑对食用型甘薯光合和淀粉积累的影响[J].作物学报,2012,38(9):1728-1733.
[7] 张春娟.植物生长调节剂对马铃薯生长发育及产品品质的影响[D].大庆:黑龙江八一农垦大学,2009.
[8] 项洪涛.三种植物生长调节剂对马铃薯碳代谢生理及产量品质的影响[D].大庆:黑龙江八一农垦大学,2013.
[9] 张宪政.作物生理研究法[M].北京:中国农业出版社,1992.
[10] 张志良.植物生理学实验指导[M].北京:高等教育出版社,2001:128-129.
[11] 赵世杰,史国安,董新纯.植物生理学实验指导[M].北京:中国农业科学技术出版社,2002.
[12] 于亚军,李 军,贾志宽,等.宁南半干旱区不同施肥量下马铃薯光合特性研究[J].干旱地区农业研究,2005,23(5):68-71.
[13] Geigen B P, Kolbe A, Tiessen A. Redox regulation of carbon storage and partitioning in response to light and sugars[J]. Journal of Experimental Botany, 2005,56:1469-1479.
[14] Hironaka K, Ishibashi K, Hakamada K. Effect of static on sugar contents and activities of invertase, UDP-glucose pyrophosphorylase and sucrose 6-phosphate synthase in potatoes during storage[J]. Potato Research,2001,44:33-39.
[15] Jeroen S W, Heleen F, Herman J E, et al. A limited set of starch related genes explain several interrelated traits in potato[J]. Euphytica, 2012,186:501-516.
[16] 齐红岩,李天来,刘海涛,等.番茄不同部位中糖含量和相关酶活性的研究[J].园艺学报,2005,2:239-243.
[17] Li L, Eckhard T, Hans-Reinhardt H, et al. Validation of candidate gene markers for marker-assisted selection of potato cultivars with improved tuber quality[J]. Theor Appl Genet, 2013,126:1039-1052.
[18] 王惠群,萧浪涛,李合松,等.矮壮素对马铃薯中薯3号光合特征和磷素营养的影响[J].植物营养与肥料学报,2007,13(6):1143-1147.
[19] 宋春艳,冯乃杰,郑殿峰,等.植物生长调节剂对大豆叶片碳代谢相关生理指标的影响[J].干旱地区农业研究,2011,29(3):91-95.
[20] Lemoine R. Sucrose transporters in plants: update on function and structure[J]. Bba-Biomembranes, 2000,1465:246-262.