chi-miR-4110对奶山羊 Smad2基因的靶向调控作用
2018-01-31侯金星雷颖楠梁玉发安小鹏宋宇轩曹斌云李云甫
侯金星,雷颖楠,梁玉发,安小鹏,宋宇轩,曹斌云,李云甫,张 周
(1.杨凌职业技术学院 动物工程分院,陕西杨凌 712100;2.西北农林科技大学 动物科技学院,陕西杨凌 712100;3.新野县动物疾病预防控制中心,河南新野 473500)
繁殖性状是奶山羊的重要经济性状。研究发现繁殖性状不仅受神经内分泌系统和卵巢的细胞因子所调控,而且也受到microRNAs(miRNAs)的调控作用。miRNA的生物合成由RNA聚合酶Ⅱ启动转录,由核内核糖核酸酶Ⅲ Drosha和其辅酶DGCR8将初始模板(pri-miRNA)转化为发夹样复合物(pre-miRNA)。pre-miRNA随后被出核蛋白5(Exportin 5)转运入细胞质内,由第二种核糖核酸酶Ⅲ Dicer转化为约22 nt的成熟miRNA[1-3],广泛存在于动植物基因组中,与基因表达调控相关[4-6]。它通常与靶基因mRNA完全或不完全匹配结合,诱导靶mRNA降解或阻遏其转录后翻译,影响细胞增殖、分化和凋亡,在动物繁殖过程中起至关重要的作用[7-9]。目前在牛和羊的卵巢中发现多个miRNA,例如miR-204、 miR-29a和miR-199等[10-12]。测序技术的发展极大地提高了miRNA的发现速度,多个物种的miRNA序列已被测定并公布[13-14]。迄今为止,miRNA数据库(Release 21.0,http:∥www.mirbase.org/index.shtml)中牛的成熟miRNA有793个,山羊有436个,猪有411个,绵羊有153个。miRNA的表达具有发育阶段性和组织特异性,通过序列特异性的碱基配对抑制mRNA的翻译,在转录后水平调控基因的表达。研究发现,miRNA在卵巢发育颗粒细胞、排卵期功能调节、性腺激素合成以及黄体化过程中发挥重要作用。研究表明,miR-93可以促进卵巢颗粒细胞的增殖[15];miR-378通过调节卵丘细胞中的芳香酶基因表达,调节卵母细胞的成熟[16]。研究人员通过基因芯片技术发现51个miRNA能抑制颗粒细胞产生雌二醇[17]。miR-21、miR-132 和miR-212 通过调控促黄体素的分泌影响小鼠卵母细胞的成熟和排卵[18]。对体外培养的颗粒细胞的研究表明,miR-378以性激素环化酶为靶点直接降低雌激素分泌[19]。这些研究表明miRNA在卵泡生长发育成熟等生理过程中起重要作用。
本研究在前期构建的多羔(1胎3~5羔)和单羔(1胎1羔)关中奶山羊发情期卵巢差异表达miRNA文库的基础上,筛选在单羔奶山羊中显著高表达的chi-miR-4110并推测其参与奶山羊的繁殖过程,利用生物信息学、qRT-PCR和Western blot等技术验证chi-miR-4110的靶基因及其对靶基因的调控作用,揭示chi-miR-4110对奶山羊繁殖机能的调控作用,为提高奶山羊繁殖性能提供科学依据。
1 材料与方法
1.1 试验材料
卵巢组织样采自杨陵上洛手村的奶山羊屠宰厂。采集时,将新鲜卵巢浸泡在灭菌后的PBS溶液中,放入冰盒,立即带回细胞间处理,卵巢颗粒细胞的分离参照Peng 等[20]的方法。
1.2 试剂及仪器
Opti-MEMⅠ、胰蛋白酶、胎牛血清、DMEM 培养基购自 Gibco 公司,DMSO(二甲基亚砜)、TRIzol试剂、Lipofectamine 2000 转染试剂盒购自美国Invitrogen公司,琼脂糖凝胶回收试剂盒购自北京天根生化科技有限公司,反转录试剂盒购自 Fermentas 公司,RT-qPCR试剂盒购自日本 TaKaRa 公司,双荧光素酶检测试剂盒购自美国 ABI 公司,BCA 蛋白定量试剂盒购自北京百泰克生物技术有限公司,PCR 扩增仪购自美国 ABI 公司,实时定量仪器购自美国 Bio-rad 公司。
1.3 细胞培养和RNAs提取
奶山羊卵巢颗粒细胞和人肾上皮细胞 293T 使用含φ=10% 胎牛血清的 DMEM-F12 培养基在37 ℃、φ=0.5% CO2的条件下培养[21]。用TRIzol法提取奶山羊卵巢颗粒细胞总 RNA。用核酸定量仪检测 RNA 的质量和质量浓度。
1.4 Smad2基因3′UTR片段的克隆
利用Targetscan、miRBase、RNAhybrid 2.1数据库预测chi-miR-4110的靶基因是 Smad2。根据GenBank中山羊 Smad2基因3′UTR序列,利用Primer 5.0软件设计上、下游引物(表1),在上、下游引物的5′端加上XhoⅠ和NotⅠ内切酶的酶切位点,并在酶切位点前加2~3个保护碱基。引物由上海生物技术工程公司合成。根据引物的退火温度设置范围(56 ℃~63 ℃),进行梯度PCR试验,筛选最适退火温度进行PCR扩增,并纯化回收PCR凝胶产物,将纯化回收的目的片段连接到pMD19-T连接载体上,将重组载体转入到感受态细胞(大肠杆菌DH5α)中涂板培养,将阳性单克隆扩大培养后,吸取1 mL送至上海生物技术工程有限公司测序,测序结果用Blast对比分析,筛选含有目的基因的阳性载体。

表1 Smad2-3′UTR的引物序列Table 1 Primer sequence of Smad2-3′UTR
注:下划线的碱基为酶切位点,斜体的碱基为保护碱基。
Note:Underlined bases are cleavage site,and protective bases are italic.
1.5 双荧光素酶活性检测
将PCR扩增的 Smad2基因 3′UTR片段和psiCHECK-2载体分别进行双酶切(XhoⅠ和NotⅠ),然后将纯化回收得到的 Smad2-3′UTR片段和载体psiCHECK-2用T4连接酶连接,将重组载体转入到感受态细胞(DH5α)中涂板培养,将阳性单克隆扩大培养后,吸取1 mL送至上海生物技术工程有限公司测序,测序结果用Blast对比分析,筛选含有目的基因的阳性载体。
取对数生长期 293T细胞接种于24孔板,将chi-miR-4110 mimics(序列UAGCAGCACAGAAAUGUUGGUA)或阴性对照(Negative control,NC)与构建的psiCHECK2- Smad2-3′UTR质粒共转染293T细胞,转染分为3组,试验组1: Smad2-3′UTR+chi-miR-4110 mimics (SRM);对照组1: Smad2-3′UTR (SR);对照组2: Smad2-3′UTR+ NC(SNC)。转染步骤参照Lipofectamine 2000试剂盒说明书进行。转染36 h 后,用裂解缓冲液PLB裂解细胞并检测其荧光强度。使用多功能酶标仪测定荧光素酶的活性,每次检测试验分别进行独立的3次重复,用萤火虫荧光素酶活性校正海参荧光素酶活性。
1.6 Smad2基因mRNA表达量的检测
根据 GenBank中山羊 Smad2 基因的mRNA序列,用Primer 5.0设计实时定量PCR引物(RT-qPCR),引物信息见表2。以GAPDH为内参基因,用SYBR Primer ExTaqII (TaKaRa) 试剂盒检测mRNA的相对表达量。每个样品3个重复,反应体系为20 μL:12.5 μL Platinum RTS SYBR Super Mix,1 μL Forward Primer,1 μL Reverse Primer,1 μL cDNA模板,4.5 μL DNAase-free dH2O。用2-ΔΔCt法分析 Smad2 基因的mRNA相对表达量。

表2 RT-qPCR引物信息Table 2 Primer sequence of RT-qPCR
1.7 Western blot检测
将Lipofectamine 2000分别与chi-miR-4110 mimics、NC和chi-miR-4110抑制剂(nhibitor)及抑制剂阳性对照物(inhibitor NC)混匀后,转染奶山羊卵巢颗粒细胞,转染步骤参照Lipofectamine 2000试剂盒说明书进行,培养48 h后,收集细胞提取蛋白。用SDS-PAGE凝胶电泳对提取的蛋白进行Western blot检测。用凝胶图像处理系统分析目标条带,用ImageJ2X对其成像结果进行灰度分析。
1.8 数据分析
使用SPSS 17.0软件进行统计分析,数据以“平均值±标准差”表示,组间差异显著性标准为P<0.05。
2 结果与分析
2.1 chi-miR-4110靶基因的预测
利用生物信息学分析chi-miR-4110的靶基因,结果发现chi-miR-4110与 Smad2 mRNA 1 706~1 727 bp位点结合,初步确定 Smad2为chi-miR-4110的靶基因(图1)。

图1 chi-miR-4110与 Smad2 mRNA 1 706~1 727 bp位点结合Fig.1 chi-miR-4110 binds at 1 706-1 727 bp positions of Smad2 mRNA
2.2 Smad2-3′UTR的克隆和酶切鉴定
用15 g/L的琼脂糖凝胶电泳检测PCR产物,结果如图2所示,目的条带单一、清晰,且长度与目的片段一致,初步判定该PCR产物为目的片段,将测序结果进行Blast对比,结果显示,该片段为 Smad2基因的3′UTR。将psiCHECK-2空载体和含有目的片段的重组载体同时进行酶切,分别可以得到大小不同的2个片段,其中重组载体的小片段为207 bp,与目的片段的大小相同(图3)。

1~4.PCR产物 PCR products;M.DNA marker Ⅰ
图2Smad2-3′UTR的PCR产物
Fig.2PCRproductsofSmad2-3′UTR

1.Check2 载体 Check2 vector; 2.重组载体 Recombination vector;M.DNA marker Ⅲ
图3酶切凝胶电泳图
Fig.3Electrophoresismapofenzymedigestionanalysis
2.3 双荧光素酶的活性
为验证chi-miR-4110是否能与 Smad2的3′UTR 区直接结合,试验组、对照组1和对照组2分别被转染到293T细胞,36 h后收集并裂解细胞,检测其荧光素酶活性。结果显示,与对照组1和2相比,试验组的荧光素酶活性显著降低(P<0.05,图4)。表明chi-miR-4110可与 Smad2-3′UTR作用位点相结合抑制其表达,从而导致荧光素酶的活性降低,由此可知, Smad2是chi-miR-4110的靶基因。

SNC. Smad2-3′UTR载体+阴性对照模拟物 Smad2-3′UTR vector + NC; SR. Smad2-3′UTR 载体 Smad2-3′UTR vector;SRM. Smad2-3′UTR+ chi-miR-4110模拟物 Smad2-3′UTR+chi-miR-4110 mimics; *.表示差异显著(P<0.05),下同 * representsP<0.05,the same below
图4荧光素酶的相对活性
Fig.4Relativeactivityofluciferase
2.4 Smad2基因 mRNA及蛋白的表达量
将chi-miR-4410模拟物、NC和inhibitor、inhibitor NC转染到卵巢颗粒细胞中后,提取RNA及蛋白。以GAPDH为内参,通过实时定量PCR检测 Smad2 mRNA在奶山羊卵巢颗粒细胞中的相对表达量。qRT-PCR结果表明,转染chi-miR-4110后 Smad2 mRNA的表达量显著低于NC组(P<0.05,图5);转染inhibitor 后mRNA表达水平上调,由此说明过表达chi-miR-4110使 Smad2 mRNA表达量降低。 Western blot检测Smad2蛋白的表达量,以GAPDH为内参做差异分析,结果发现转染chi-miR-4110后Smad2蛋白的表达量显著低于NC组(P<0.01,图6);转染inhibitor后蛋白水平显著高于Inhibitor NC组 (P<0.05),表明chi-miR-4110对Smad2蛋白的表达量起负调控作用。
3 讨 论
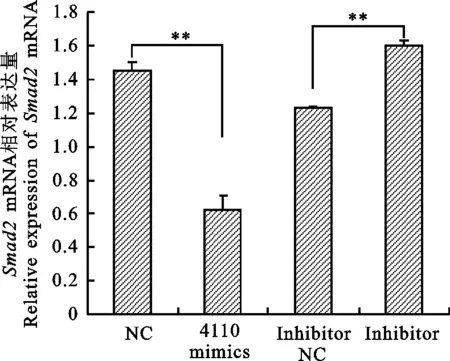
**表示差异极显著(P<0.01),下同 ** representsP<0.01,the same as below.
图5Smad2mRNA的相对表达量
Fig.5RelativeexpressionofSmad2mRNA
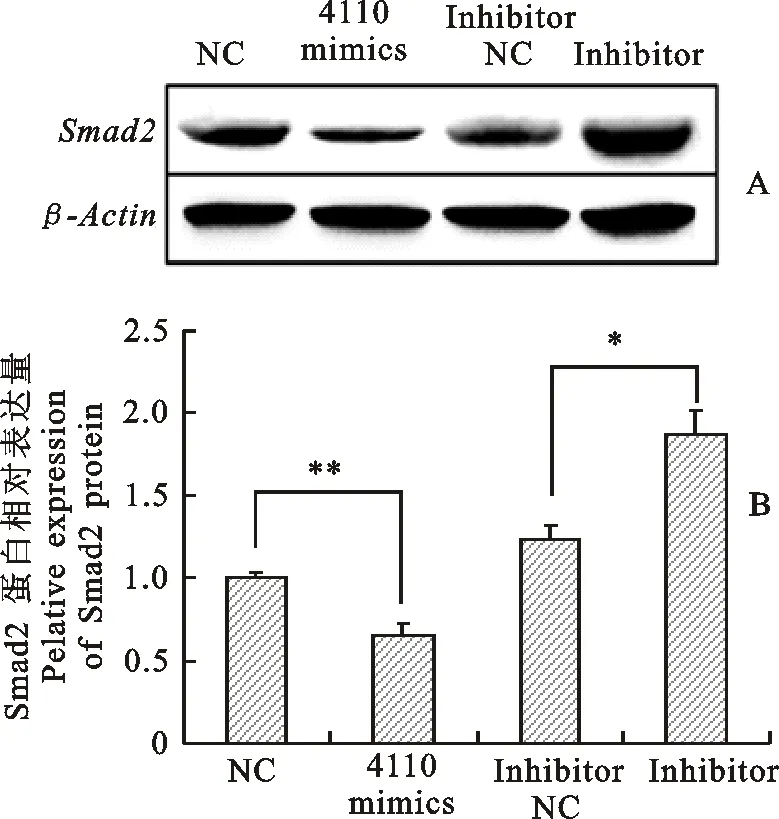
A.蛋白免疫印迹杂交检测Smad2蛋白表达 Smad2 protein were detected by western blot; B.Smad2蛋白相对表达量 Relative expression of Smad2 protein
图6chi-miR-4110抑制Smad2蛋白表达
Fig.6chi-miR-4110inhibitsexpressionofSmad2protein
卵泡在生长过程中受到多种细胞内分泌或旁分泌因子的调节,其中大部分属于转化生长因子-β(transforming growth factor-β,TGF-β)超家族。Smads家族成员是TGF-β超家族的细胞内信号介质,在颗粒细胞中阶段特异性表达,能够调控颗粒细胞的增殖、凋亡以及分化,同时对正常卵母细胞的生长发育、排卵和黄体化起关键调节作用[22]。Smad2在 Smads 家族中属于受体调节型蛋白,通常情况下, Smad2的表达与TGF-β密切相关,Smads直接被 TGF-β I型受体(TGF-βRI)磷酸化[23]。Smad2蛋白随着绵羊卵泡的发育,在卵泡的颗粒细胞持续表达,且腔前卵泡颗粒细胞中Smad2的表达量显著低于有腔卵泡的颗粒细胞[24]。研究发现,敲除雌鼠的 Smad2和 Smad3基因,小鼠会出现卵泡发育和排卵异常,生殖力显著下降[25]。徐梦思等[26]研究表明, Smad2基因在梅山猪M2卵泡(5.0~6.9 mm)中的表达量极显著高于杜洛克, Smad3和 Smad4在梅山猪 M1卵泡(1.0~3.0 mm)、 M2卵泡和L卵泡(7.0 mm)中的表达量分别显著和极显著高于杜洛克,揭示 TGF-β/Smad信号通路基因在卵泡发育及成熟的过程中发挥重要作用。 Smad4是不同 TGF-β信号通路配体信息传递的必需中心分子, 抑制 Smad4可促进猪卵泡颗粒细胞凋亡[27], 敲除 Smad4 基因后小鼠在胚胎期就会出现死亡[28]。Yao等[29]研究发现 Smad4 是miR-224的靶基因,miR-224的过表达能够显著降低小鼠卵巢颗粒细胞中Smad4的蛋白水平,但对 Smad4 基因mRNA水平无显著影响,表明miR-224是通过抑制 Smad4翻译过程调控该基因的表达,此外,还揭示miR-224/Smad4 可以介导TGF-β调控小鼠雌二醇分泌以及腔前颗粒细胞的增殖。本研究的荧光素酶检测结果表明,chi-miR-4110通过与 Smad2-3′UTR相互作用导致荧光素酶活性降低,初步鉴定 Smad2为chi-miR-4110的靶基因。将chi-miR-4110 mimics和阴性对照分别转染到奶山羊卵巢颗粒细胞中,qRT-PCR和Western blotting结果表明,在奶山羊卵巢颗粒细胞中,过表达chi-miR-4110导致 Smad2 基因的mRNA以及Smad2蛋白的表达量均显著降低,表明chi-miR-4110通过降解 Smad2基因的mRNA和抑制其蛋白的翻译调控该基因的表达。
4 结 论
Smad2是chi-miR-4110的靶基因,在奶山羊卵巢颗粒细胞中chi-miR-4110靶向调控 Smad2的表达。揭示chi-miR-4110通过TGF-β/Smad信号通路调控卵泡的生长发育和排卵。
Reference:
[1] MURCHISON E P,STEIN P,XUAN Z,etal.Critical roles for Dicer in the female germline [J].Genes&Development,2007,21(6):682-693.
[2] YANG W J,YANG D D,NA S,etal.Dicer is required for embryonic angiogenesis during mouse development [J].JournalofBiologicalChemistry,2005,280(10):9330-9335.
[3] LUENSE L J,CARLETTI M Z,CHRISTENSON L K.Role of Dicer in female fertility [J].TrendsinEndocrinologyandMetabolism,2009,20(6):265-272.
[4] CARRINGTON J C,AMBROS V.Role of microRNAs in plant and animal development [J].Science,2003,301(5631):336-338.
[5] WIENHOLDS E,PLASTERK R H.MicroRNA function in animal development [J].FEBSLetters,2005,579(26):5911-5922.
[6] IMBAR T,EISENBERG I.Regulatory role of microRNAs in ovarian function [J].FertilityandSterility,2014,101(6):1524-1530.
[7] AN X P,SONG Y X,HOU J X,etal.Identification and profiling of microRNAs in the ovaries of polytocous and monotocous goats during estrus [J].Theriogenology,2016,85(4):769-780.
[8] TESFAYE D,SALILEW-WONDIM D,GEBREMEDHN S,etal.Potential role of microRNAs in mammalian female fertility [J].Reproduction,FertilityandDevelopment,2017,29(1):8-23.
[9] YANG H,LIN SH,LEI X P,etal.Identification and profiling of microRNAs from ovary of estrous Kazakh sheep induced by nutritional status in the anestrous season [J].AnimalReproductionScience,2016,175:18-26.
[10] NIU B,WU J,MU H,etal.MiR-204 regulates the proliferation of dairy goat spermatogonial stem cells via targeting to sirt1 [J].RejuvenationResearch,2016,19(2):120-130.
[11] GEBREMEDHN S,SALILEW-WONDIM D,AHMAD I,etal.MicroRNA expression profile in bovine granulosa cells of preovulatory dominant and subordinate follicles during the late follicular phase of the estrous cycle [J].PlosOne,2015,10(5):e0125912.
[12] NAVAKANITWORAKUL R,HUNG W T,GUNEWARDENA S,etal.Characterization and small RNA content of extracellular vesicles in follicular fluid of developing bovine antral follicles [J].ScientificReports,2016,6:25486.
[13] 魏 欢,李仲文,沈清武.小鼠miR-151-3p靶基因筛选和鉴定[J].西北农业学报,2014,23(5):23-31.
WEI H,LI ZH W,SHEN Q W.Screen and identify the target genes of mir-151-3p in mice [J].ActaAgriculturaeBoreali-occidentalisSinica,2014,23(5):23-31.
[14] WICIK Z,GAJEWSKA M,MAJEWSKA A,etal.Characterization of microRNA profile in mammary tissue of dairy and beef breed heifers [J].JournalofAnimalBreedingandGenetics,2016,133(1):31-42.
[15] JIANG L L,YANG D,HUANG J.MicroRNA-93 promotes ovarian granulosa cells proliferation through targeting CDKN1A in polycystic ovarian syndrome [J].JournalofClinicalEndocrinology&Metabolism,2015,100(5):E729-E738.
[16] PAN B,TOMS D,SHEN W,etal.MicroRNA-378 regulates oocyte maturation via the suppression of aromatase in porcine cumulus cells [J].AmericanJournalofPhysiology-EndocrinologyandMetabolism,2015,308(6):E525-E534.
[17] SIROTKIN AV,OVCHARENKO D,GROSSMANN R,etal. Identification of microRNAs controlling human ovarian cell steroidogenesis via a genome-scale screen [J].JournalofCellularPhysiology,2009,219(2):415-420.
[18] CHRISTENSON L K.MicroRNA control of ovarian function [J].AnimalReproduction,2010,7(3):129-133.
[19] XU S Y,LINHER-MELVILLE K,YANG B B,etal.MiR-378 regulates ovarian estradiol production by targeting aromatase [J].Endocrinology,2011,152(10):3941-3951.
[20] PENG J Y,GAO K X,XIN H Y,etal.Molecular cloning,expression analysis,and function of decorin in goat ovarian granulosa cells [J].DomesticAnimalEndocrinology,2016,57:108-116.
[21] PENG J Y,XIN H Y,HAN P,etal.Expression and regulative function of tissue inhibitor of metalloproteinase 3 in the goat ovary and its role in cultured granulosa cells [J].MolecularandCellularEndocrinology,2015,412(9):104-115.
[22] XU J,OAKLEY J,MCGEE E A.Stage-specific expression of Smad2 and Smad3 during folliculogenesis1 [J].BiologyofReproduction,2001,66(6):1571-1578.
[23] WOTTON D,LO R S,LEE S,etal.A Smad transcriptional corepressor [J].Cell,1999,97(1):29-39.
[24] 常 迪,董晓晨,郭 勇,等.TGF-βRⅠ及 Smad2表达情况对绵羊腔前卵泡发育的影响[J].中国农学通报,2016,32(32):7-14.
CHANG D,DONG X CH,GUO Y,etal.Expression ofTGF-βRⅠ and Smad2 affecting the development of sheep preantral follicles [J].ChineseAgriculturalScienceBulletin,2016,32(32):7-14.
[25] LI Q,PANGAS S A,JORGEZ C J,etal.Redundant roles of SMAD2 and SMAD3 in ovarian granulosa cells in vivo [J].Molecular&CellularBiology,2008,28(23):7001.
[26] 徐梦思,黄 涛,刘丽娟,等.TGFβ-SMAD信号通路基因在梅山猪与杜洛克猪不同级别卵泡中的表达分析 [J].家畜生态学报,2016,37(2):14-17.
XU M S,HUANG T,LIU L J,etal.Expression patterns of genes TGFβ-SMAD signalling pathway in Meishan and Duros follicle of different sizes [J].JournalofDomesticAnimalEcology,2016,37(2):14-17.
[27] 刘吉英.MiR-26b靶向 Smad4调控猪卵泡颗粒细胞凋亡的分子机制 [D].南京:南京农业大学,2013.
LIU J Y.The molecule mechanism of miR-26b regulates apoptosis of porcine ovarian granulasa cells by targenting Smad4 [D].Nanjing:Nanjing University,2013.
[28] PANGAS S A.Bone morphogenetic protein signaling transcription factor (SMAD) function in granulosa cells [J].Molecular&CellularEndocrinology,2012,356(1/2):40-47.
[29] YAO G,YIN M,LIAN J,etal.MicroRNA-224 is involved in transforming growth factor-beta-mediated mouse granulosa cell proliferation and granulosa cell function by targeting Smad4 [J].MolecularEndocrinology,2010,24(3):540-551.
