粉葛多糖制备工艺研究
2018-01-30何美军陈沫王华穆森郭坤元黄东海张宇
何美军+陈沫+王华+穆森+郭坤元+黄东海+张宇

摘要:以粉葛为原料,采用单因子及正交试验的方法,研究制备粉葛多糖的主要工艺条件(复合酶的量,pH值,温度,时间)。结果表明,粉葛多糖制的工艺条件为:复合酶的量为016%,温度30℃,时间100min,pH值为60,这4个因素对于粉葛多糖作用的大小依次为:复合酶量>温度>时间>pH值。水解溶液中粉葛多糖含量为894mg/100ml。
关键词:粉葛;多糖;复合酶
中图分类号:TS244文献标识码:A文章编号:1004-3020(2017)06-0038-03StudyonthePreparationofKudzuPolysaccharideHeMeijunChenMoWangHuaMuSenGuoKunyuanHuangDonghaiZhangYu
(InstituteoftraditionalChinesemedicine,HubeiAcademyofAgriculturalSciencesEnshi445000)
Abstract:Takingkudzuasrawmaterial,usingthemethodofsinglefactorandorthogonaltest,themainprocessconditionsofpreparationofkudzupolysaccharide(enzymeamount,pHvalue,temperature,time).Theresultsshowthattheprocessconditionsofkudzupolysaccharideswereasfollows:compositeenzymeamountwas0.16%,temperature30,time100min,pHvalueis6,thesizeofthe4factorsfortheeffectofPuerariapolysaccharidewere:compositeenzymedosage>temperature>time>pH.Thecontentofpolysaccharideinhydrolyzedsolutionwas894mg/100ml.
Keywords:PuerariathomsoniiBenth;polysaccharide;compositeenzyme
粉葛是豆科植物葛的变种甘葛藤(PuerariathomsoniiBenth)的干燥根[1],是药食同源植物,因其含有较高含量的葛根淀粉及葛根黄酮类化合物[2-6],如今已经广泛的用作粮食、蔬菜、功能食品等原料[7-8]。粉葛的综合加工研究较多[9-10],如粉葛淀粉、葛根素、葛根总黄酮等的提取。而粉葛多糖的提取分离研究报道较少。本研究的粉葛多糖是由多个单糖分子缩合、失水而成,是一类分子结构复杂且庞大的糖类物质,局部分子结构上连结有少数黄酮母环结构,从分子结构来看,在粉葛的化学成分中,粉葛多糖为一大类功能化合物质,有较好的应有前景,本研究旨在提高粉葛的经济性状和加工利用率,为进一步开发粉葛功能产品奠定基础。
1材料与方法
1.1材料
1.1.1材料与试剂
试验用粉葛于2016年10月采自恩施市三岔粉葛基地。试剂:苯酚(分析纯),葡萄糖(食用级),纯净水,浓硫酸(分析纯),氢氧化钠(分析纯),三氯乙酸(分析纯),盐酸(分析纯)。
1.1.2仪器
紫外可见分光光度计(UV-1800型,上海仪田精密仪器有限公司);旋转蒸发仪(RE-201型,上海一科仪器有限公司);真空干燥箱(DZF型,北京永光明医疗仪器厂);粉碎机(自贡市机械厂)。
1.2方法
采用单因子及正交试验的方法,研究制备粉葛多糖的主要工艺条件(复合酶的量,水解pH值,温度,时间)。取新鲜粉葛根,除杂洗净,沥干,切碎,打浆,放入高压灭菌锅中,加入葛根重量8倍的去离子水,加压至6MPa进行高压处理100min,卸压,冷却至室温,再向浆液中加入原葛根重量4倍的去离子无菌水制备粉葛多糖,通过控制不同的因素(复合酶的量,水解PH值,温度,时间),研究适宜多糖制备的最佳工艺。每组处理匀采用了3次重复,求3次平均值。
1.2.1单因子实验
(1)复合酶的量。加入原葛根重量010%,012%,014%,016%,018%,020%,022%的复合酶(纤维素酶、半纤维素酶、β-葡聚糖酶、木聚糖酶、甘露聚糖酶和果胶酶的混合物),考察复合酶加入量对水解液中多糖含量的影响。
(2)温度。分别选取温度分别为20,25,30,35,40,45℃进行试验。考察不同水解时间对水解液中多糖的含量的影响。
(3)时间。水解在60,70,80,90,100,110,120min进行试验。考察不同PH值对水解液中多糖的含量的影响。
(4)pH的确定。调节pH为20,30,40,50,60,70。考察不同PH值对水解液中多糖的含量的影响。
湖北林业科技第46卷第6期何美军,等:粉葛多糖制备工艺研究1.2.2正交试验
分别以复合酶占原粉葛质量的百分数、水解温度、水解时间、水解的pH值为4因素,粉葛总多糖的含量为指标设计L9(34)四因素三水平正交试验(因素与水平见表1),进一步优化粉葛多糖提取的最优工艺参数。
1.2.3檢测方法
粉葛中多糖的检测,采用苯酚-硫酸法测定多糖的含量,以葡萄糖作为标准,于490nm测定标准物质量浓度与吸光度的对应关系,制备标准曲线。倒上清液于10mL离心管中,再加少许5%TCA溶液,倒上清液,重复3次。最后一次将残渣一起到入离心管。离心转速3000转/min,共三次。第一次15min,取上清液。后两次各5min取上清液到25mL锥形比色管中。最后滤液保持18mL左右。在向比色管中加入6mol/L盐酸2mL之后摇匀,在90℃水浴锅中水浴2h。水浴后,用流水冷却后加入2毫升6mol/L氢氧化钠摇匀。定容至25mL的容量瓶中。吸取02mL的样品液,以蒸馏补至20mL,然后加入6%苯酚10mL及浓硫酸5.0mL,摇匀冷却室温放置20min以后于490nm测光密度。每次测定取双样对照。以标准曲线计算多糖含量。endprint
1.2.4数据处理
采用SPSS19.0数据处理软件对正交试验结果进行分析,并对正交试验结果进行直观分析。
2结果与分析
2.1单因素试验结果
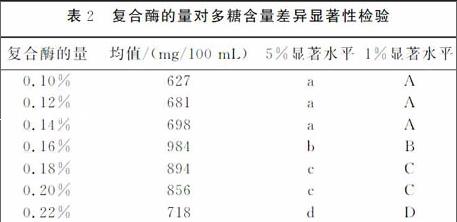
(1)复合酶的量。加入原葛根重量010%,012%,014%,016%,018%,020%,022%的复合酶(同上),水解温度30℃,水解时间120min,调节pH为60时,考察复合酶加入量对水解液中多糖含量的影响(表2)。由表2可知,不同复合酶的量水解溶液中多糖的含量差异显著,加入原葛根重量016%时,水解液中多糖的含量最高。
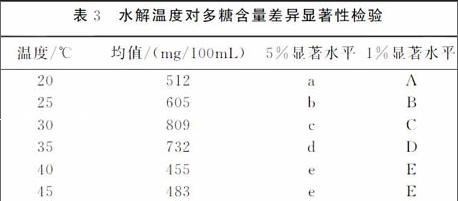
(2)温度。不同水解温度对多糖含量的影响(见表3)。加入原葛根重量016%的复合酶,水解时间120min,水解PH值为60时,由表3可知,水解温度30℃时,水解溶液中的多糖含量最高。
(3)时间。不同水解时间对多糖含量的影响见表4。由表4可知,加入原葛根重量016%复合酶,水解温度30℃,水解pH值为60,水解时间为100min时,水解溶液中的多糖含量最高。
(4)pH值。不同pH值对水解溶液中多糖含量的影响见表5。由表5可知,加入原葛根重量016%复合酶,水解温度30℃,水解时间为100min,水解pH值为60时,水解溶液中的多糖含量最高。
2.2正交试验结果
分别以加入复合酶的量,水解温度、水解时间、水解pH值为4因素,溶液中多糖的含量为指标设计L9(34)四因素三水平正交试验,进一步优化复合酶提取粉葛多糖的最优工艺参数。由表6可以看到,4个因素对粉葛多糖的含量影响均极为显著,但其影响程度高的大小有较大差异,采用正交试验对水解条件进行优化,结果表明,粉葛多糖含量高的工艺条件为A3B2C3D3,即为复合酶的量为016%,水解温度30℃,水解时间100min,pH值为60。方差分析结果见表7,由表7可以看出,正交模型的方差分析显著,模型R2=0991表明该正交模型能够很好的模拟试验。复合酶的量,水解温度、水解时间、水解pH值对粉葛多糖的含量的影响均达到极显著(P<001)。
3结论
本研究的粉葛多糖制备工艺参数是复合酶的量为016%,水解温度30℃,水解时间100min,pH值为60。这4个因素对于粉葛多糖含量作用的大小依次为:A>B>C>D,即复合酶量>水解温度>水解时间>pH值。该工艺简单易操作,绿色无污染。在工业化生产中,会因为设备大小及性能变化而变化。粉葛多糖为一大类功能化合物质,有较好的应有前景,本研究旨在提高粉葛的经济性状和加工利用率,为进一步开发葛根功能产品奠定基础。
参考文献
[1]许国钧.中草药彩色图谱[M].福州:福建科学技术出版社,1990.
[2]蔡宝昌,刘训江.常用中药材HPLC指纹图谱测定技术[M].北京:化学工业出版社,2005.
[3]周国海,于华忠,李国章,等.葛根中总黄酮及葛根素的含量测定[J].湖南林业科技,2004,31(5):7172.
[4]JiangRW,LauKM,LamHM,etal.AcomparativestudyonaqueousrootextractsofPuerariathomsoniiandPuerarialobatabyantioxidantassayandHPLCfingerprintanalysis[J].JournalofEthnopharmacology,2005,96(1/2):133138.
[5]AraKirakosyan,PeterBK,SaraWarber,etal.QuantificationofmajorisoflavonoidsandLcanavanineinseveralorgansofkudzuvine(Puerariamontana)andinstarchSamplesderivedfromkudzuroots[J].PlantScience,2003,164:883888.
[6]AdamMatkowski.InvitroisoflavonoidproductionincallusfromdifferentorgansofPuerarialobata(Wild.)Ohwi[J].PlantPhysiol,2004,161(3):343346.
[7]秦丹,譚兴和,林亲录.葛根采后生理研究[J].保鲜与加工,2005,5(1):2628.
[8]王美东,李常行,孙钦美.葛根提取工艺的正交设计试验[J].齐鲁事,2005,24(1):4546.
[9]李玉山.葛根的综合开发与利用[J].林产化学与工业,2009,29(6):109115.
[10]施英英,薛培俭,夏黎明.酶法提取葛根渣中异黄酮的研究[J].林产化学与工业,2006,26(1):6264.
(责任编辑:夏剑萍)endprint
