血清胃泌素17在胃癌及癌前疾病中表达及临床意义研究
2018-01-30郭建超王颖苏连明胡勤敏梁思琦
郭建超,王颖,苏连明,胡勤敏,梁思琦
(1.黑龙江省牡丹江医学院研究生院2015级,黑龙江 牡丹江 157001;2.黑龙江省牡丹江医学院附属红旗医院消化内科,黑龙江 牡丹江 157003;3.黑龙江省牡丹江医学院研究生院2016级,黑龙江 牡丹江 157001)
胃癌(Gastric Cancer,GC)在我国是常见上消化道恶性肿瘤,死亡率逐年攀升。早期胃癌治疗后5年生存率高达90%左右,进展期胃癌5年生存率却不足10%,早期胃癌诊断率低于20%[1]。早期诊断和治疗是提高胃癌生存率、降低死亡率的关键[2]。目前确诊胃癌主要依靠胃镜和组织病理学检查,受患者年龄、心肺情况等自身疾病限制,胃镜检查患者较痛苦,
费用较高和侵袭性特点,限制了普遍常规使用[3]。近年来血清胃泌素17(G-17)等无创“血清学活检”凭借操作方法简单易行、无创检查、诊断前后动态监测等优点成为胃癌及癌前疾病诊断新方法[4]。本文利用酶联免疫吸附测定法(ELISA法)检测胃癌及癌前疾病中血清G17水平,分析血清G17水平在五组疾病中的动态变化,探讨G17在胃癌及癌前疾病中诊断及早期胃癌筛查中的临床价值。
1 资料与方法
1.1 临床资料 收集2017年1月~2017年6月于牡丹江医学院红旗医院消化科门诊和住院患者共150例,根据胃镜检查及病理组织学结果进行分组,以非萎缩胃炎组作为对照组。非萎缩性胃炎30例,其中男17例,女13例,平均年龄(44±15)岁。萎缩性胃炎30例,其中男9例,女21例,平均年龄(56±19)岁。胃息肉30例,其中男18例,女12例,平均年龄(49±18)岁。胃溃疡30例,其中男20例,女10例,平均年龄(49±16)岁。胃癌30例,其中男19例,女11例,平均年龄(65±12)岁。
1.2 入选及排除标准 纳入标准:所有入选患者均有胃镜检查及病理活检证实,其中胃息肉均为管状腺瘤,取材符合新悉尼胃炎分类[5]以及WHO胃癌[6]分型进行病理诊断。一周内无特殊用药史(非甾体抗炎药、质子泵抑制剂、H2受体拮抗剂等)。排除标准:有严重心、肝、肾等病史。有神经、精神疾病或严重内分泌疾病史。既往有胃部手术史、消化道其他恶性肿瘤及全身其他系统肿瘤史。孕妇及哺乳期妇女。
1.3 方法
1.3.1 G-17检测 采集空腹静脉血标5 ml,血液样本离心3 000 r/min,离心10 min,贮存于-20℃低温冰箱中待测。用Tecam公司的Sunrise酶标仪进行定量ELISA法,检测血清G-17含量(pg/ml),严格按照芬兰Biohit公司试剂盒操作说明书进行。
1.3.2 H.pylori检测 患者空腹或禁食6 h,口服尿素酶胶囊,静坐15 min后向检测呼气卡中吹气,1~3 min,将呼气卡插入检测仪内(深圳市中核海德得威公司14C呼吸检测仪,型号HUBT-20A插卡),测得具体数值结果,判断阴性和阳性。
1.4 统计学方法 采用SPSS 19.0统计软件进行统计数据分析。计量资料采用“”表示,组间比较采用t检验;计数资料用例数(n)表示,计数资料组间率(%)的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 血清G17水平与胃癌及癌前疾病相关性 在所有患者中,与非萎缩性胃炎组比较,胃溃疡组、胃息肉组、胃癌组中血清G17表达水平均显著升高,差异有统计学意义(P<0.05);与萎缩性胃炎组比较,胃溃疡组、胃息肉组、胃癌组中血清G17表达水平均显著升高,差异有统计学意义(P<0.05);非萎缩性胃炎组与萎缩性胃炎组,胃溃疡组与胃癌组,胃溃疡组与胃息肉组组间比较差异无统计学意义,见表1。
表1 血清G17水平与胃癌及癌前疾病相关性()
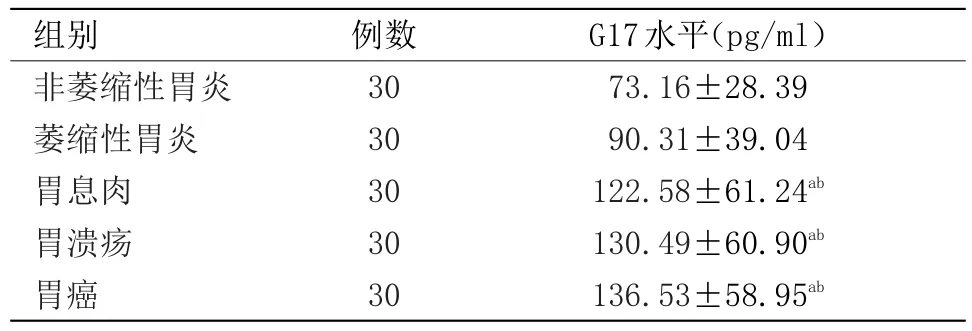
表1 血清G17水平与胃癌及癌前疾病相关性()
注:与非萎缩性胃炎组比较,aP<0.05;与萎缩性胃炎组比较,bP<0.05
G17水平(pg/ml)73.16±28.39 90.31±39.04 122.58±61.24ab 130.49±60.90ab 136.53±58.95ab组别非萎缩性胃炎萎缩性胃炎胃息肉胃溃疡胃癌例数30 30 30 30 30
2.2 血清G17水平与H.pylori感染相关性 在胃癌及癌前疾病H.pylori阴性患者中,与非萎缩性胃炎组相比,胃溃疡组、胃息肉组、胃癌组血清G17水平显著升高(P<0.05);而在H.pylori阳性组中,不同疾病中比较,血清G17水平比较差异无统计学意义,见表2。
在同种疾病中,比较H.Pylori阳性患者与H.Pylori阴性患者血清G17水平,对比结果发现,在非萎缩性胃炎组、胃溃疡组、胃息肉组、胃癌组中H.Pylori阳性患者血清G17水平高于H.Pylori阴性患者(P<0.05),血清G17水平升高呈递增趋势,见表2。
表2 血清G17水平与H.pylori感染相关性()

表2 血清G17水平与H.pylori感染相关性()
HP-51.40±22.00 71.98±42.83 91.90±51.20 102.64±54.63 92.83±50.94组别非萎缩性胃炎组萎缩性胃炎组胃溃疡组胃息肉组胃癌组例数18/12 20/10 18/12 17/13 21/9 G17水平(pg/ml)HP+87.67±22.49 99.47±34.53 143.03±59.95 151.78±58.00 155.25±52.67
3 讨论
胃泌素是一种消化道常见胃肠激素,主要由胃窦部G细胞分泌,人体中有多种胃泌素,进入血液循环的胃泌素至少有四种生物活性成分,包括成分I、G-14、G-17和G-34等[7],其中G-17和G-34在血循环中占90%以上,G-17主要由胃窦部G细胞分泌,80%~90%可发挥生物学作用。G-34主要由十二指肠腺体等分泌,仅5%~10%发挥生物学作用。胃泌素主要是通过与其受体结合启动系列生理信号发挥生物学作用。由于胃泌素和胆囊收缩素具有相同羧基末端五肽序列,与胆囊收缩素受体(cholecystokinin receptor,CCKR)完全相同,因此胃泌素受体也称CCKR。该受体包括CCKR-A和CCKR-B,胃泌素主要通过与CCKR-B结合发挥生物学效应[8]。胃泌素生物学功能包括:①刺激壁细胞分泌胃酸;②促进胃黏膜上皮细胞生长、分化;③参与胃黏膜炎症反应和修复;④调节胃肠功能作用[9]。随着胃黏膜受到各种因素刺激后发生不同状态改变,必然影响胃泌素在体内水平变化。近年来血清学标志物胃泌素17在胃癌及癌前疾病诊断中发挥越来越重要作用,本实验结果显示在所选患者中,与非萎缩性胃炎组比较,胃溃疡组、胃息肉组、胃癌组中血清G17表达水平均显著。这与既往相关文献报道基本相一致[10]。在五组疾病中,血清G17水平呈递增趋势,这可能与胃黏膜病变严重程度和癌前疾病等级有关,胃黏膜组织越接近胃癌黏膜组织,其血清G17水平表达越高,这为血清G17在胃癌及癌前疾病筛查中发挥重要作用提供理论依据。近年来随着对G17研究不断深入,发现其与胃癌浸润剂转移也密切相关[11-12]。Mishra等[13]发现G17通过激活丝裂原活化蛋白激酶(MAPK)及JNKI信号途径可能促进胃癌细胞浸润与转移。故对胃癌患者早期检测血清G17水平,可判断是否有转移情况,这对手术方式选择及患者预后有重大现实意义。至于筛查胃癌及癌前疾病中血清G17界值标准,还有待大样本数据进一步说明。
H.pylori感染参与了萎缩性胃炎、胃溃疡和胃癌的形成,通过研究发现血清G17水平在H.pylori阴性患者五组疾病中逐渐升高,尤其在胃癌组中升高最明显。而在H.pylori阳性五组疾病中,血清G17水平比较差异无统计学意义。在同一组疾病中,H.pylori阳性患者血清G17水平也高于H.pylori阴性患者,且血清G17水平升高呈递增趋势。这与以往文献报道基本相符合[14]。通过本研究显示,血清G17水平除了受到胃黏膜自身状态影响,也受到H.pylori影响,这可能与H.pylori寄居胃黏膜表面,改变胃黏膜胃酸水平,影响胃黏膜正常生理功能有关。Gibbons等[15]研究发现,H.pylori感染可导致胃泌素mRNA水平升高。国外有学者也研究报道[16],H.pylori感染破坏胃黏膜上皮细胞pH屏障,导致胃泌素受体表达上调,从而使胃泌素水平升高。
总之,本研究结果表明,在非萎缩性胃炎、萎缩性胃炎、胃溃疡、胃息肉、胃癌中,随着胃黏膜癌前疾病状态不断进展,血清G17水平逐步增高,其水平受到H.pylori感染影响,因此可利用血清学标志物胃泌素17水平高低作为胃癌和癌前疾病无创筛查指标,对于血清G17水平升高合并H.pylori感染患者,再次胃镜检查行活检确诊,为胃癌早期筛查和精准胃镜检查提供参考。由于血清G17诊断胃癌及癌前疾病界值尚未确定,其临床运用还有待进一步临床观察和确定。
[1] Adamu MA,Week MN,Rothenbacher D,et al.Incidence and risk factors for the development of chronic atrophic gastritis:five year follow-up of a population-based cohort study[J].Int J Cancer,2011,128(7):1652.
[2] 乔正梅,王登峰,赵秋剑,等.血清胃蛋白酶原.胃泌素17在胃癌及胃癌前病变的诊断价值[J].中国卫生检验杂志,2017,27(2):198-200.
[3] 黄喜顺,邓立新,苏军凯,等.血清PG.G-17联合CA72-4和13C UBT在早期胃癌的诊断价值[J].重庆医学,2017,46(10):1346-1348.
[4] Mansour-Ghanaei F, Joukar F, Rajpout Y, et al.Screening of precancerous Gastric lesions by serum pepsinogen,gastrin-17,anti-helicobacter pylori and anti-cag A anti-bodies in dyspeptic patients over 50 yearsoldinGuilanProviance, north of Iran[J].Asian Pac J Cancer Prew,2014,15(18):7635-7638.
[5] Dixon MF,Genta RM,Yardlley JH,et al.Classification and grading of gastritis.The updated Sydney System.International Workshop on the Histopathology of Gastritis,Houston 1994[J]. Am J Surg Pathol,1996,20(10):1161-1181.
[6] Monig S,Baldus SE,Collet PH,et al.Histological grading in gastric cancer by Goseki classification:correlation with histopathological subtypes and prognosis[J].Anticancer Res,2001,21(1):617-620.
[7] 曾志荣,胡品津.血清胃蛋白酶原、血清胃泌素17与抗幽门螺杆菌IgG抗体在萎缩性胃炎及胃癌筛查中的应用价值[J].现代消化及介入诊疗,2007,12(1):46-48.
[8] Han YM,Park JM,Park SH,et al.Gastrin promotes intestinal polyposis through Cholecystokinin-B receptor-mediated proliferative signaling and fostering tumor Microenvironment[J].J Physiol Pharmacol,2013,64(4):429-437.
[9] 穆亚娟,冯义朝.血清胃泌素17在胃肠疾病诊断中意义[J].世界华人消化杂志,2016,24(19):2996-3001.
[10]胡丽波,谢津璧,万坚,等.血清胃蛋白酶原及胃泌素在胃部疾病中额表达及意义[J].胃肠病学和肝病学杂志,2015,24(3):281-283.
[11]Kim YM,Kim IM,Nam TJ.Capsosiphon fulvescens glyconprotein reduces AGS gastric cell migration by downregulating transforming growth factor-β1 and integrin expression[J].Int J Oncol,2013,43(4):1059-1065.
[12]Mishra P,Senthivinayagam S,Rangasamy V,et al.Mixed lineage kinase-3/JNKI axis promotes migration of human gastric cancer cells following gastrin stimulation[J].Mol Endocrinol,2010,24(3):598-607.
[13]Mishra P,Senthivinayagam S,Rana A,et al.Glycogen synthase kinase-3beta regulates snail and betacatenin during gastrin induced migration of gastric cancer cells[J].J Mol Signal,2010,16(7):5-9.
[14]陈莫耶,徐倩,孙丽萍,等.血清胃泌素17水平与胃癌及癌前疾病的相关性研究[J].胃肠病学和肝病学杂志,2015,24(2):161-165.
[15]Gibbons AH,Legon S,Walker MM,et al.The effect of gastrin-releasing peptide on gastrin and soma-tostatin messenger RNAs in humans infected with Helicobacter pylori[J].Gastroenterology,1997,112(6):1940-1947.
[16]Takamura A,Ito M,Boda T,et al.High expression of gastrin receptor protein in injured mucosa of Helicobacter pylori-positive gastritis[J]. Dig Dis Sci,2013,58(3):634-640.
