灰色链霉菌YD3309菌丝体抗菌活性成分研究
2018-01-30杨晓军张少华
杨晓军, 马 娜, 李 丽, 张少华
(1.延安大学 化学与化工学院,陕西 延安 716000;2.陕西省化学反应工程重点实验室, 陕西 延安 716000)
随着人们生活水平的不断提高,大棚蔬菜栽培面积不断增加。由于棚内温度高、湿度大、光照较弱、空气流动缓慢等特殊的生态环境,致使蔬菜易遭受病虫危害。目前防治蔬菜病害主要依赖化学农药,但长期施用化学农药易产生抗药性,导致防治效果逐步降低,同时还造成环境污染,危害人畜安全[1]。生物农药具有与环境相容性高、对人畜安全等特点,越来越引起人们的关注。放线菌次生代谢产物中往往具有一类或几类抗生素,且大部分选择性强,已成为生物农药的研发方向[2-3]。链霉菌作为放线菌门中种类最多的一个属,是产生各类抗生素的主要来源[4-5],链霉菌产生的抗生素可以特异性地作用于某些病原菌,降低其生长和繁殖速度,进而降低病害发生的频率[6]。近年来,病原菌耐药性的增强导致发现新抗菌化合物的机率减少,已引起科学界的高度重视。研究发现,极端环境中可能存在产生独特次级代谢产物的放线菌类群,这些特殊的种群为微生物天然产物的研究开发提供了新的资源[7-8]。极端环境的特殊性导致长期生存的微生物与普通自然环境下生存的有所不同,长期的生存压力使其形成了独特的环境适应模式、特殊的生理代谢机制和独特的基因类型,可以产生多种独特的生物活性物质,不仅在自然界物质循环中发挥重要作用,而且成为一类重要的生物资源[9]。近年来课题组在筛选农用抗生素生物资源过程中,从陕西省绥德县盐碱土壤中分离得到1株灰色链霉菌(编号YD3309),该菌菌丝体提取物对多种蔬菜病原菌具有抑制作用。为明确其活性成分,本研究采用活性跟踪法对其化学成分进行分离纯化。结果从中分离到2个活性化合物,利用波谱学数据并与文献对照确定这2个活性化合物的结构分别为新刺孢霉素A(1)和N-乙酰基色氨醇(2),2个化合物的化学结构见图1。本研究采用菌丝生长速率法测定2个代谢产物的抑菌活性,结果报告如下。
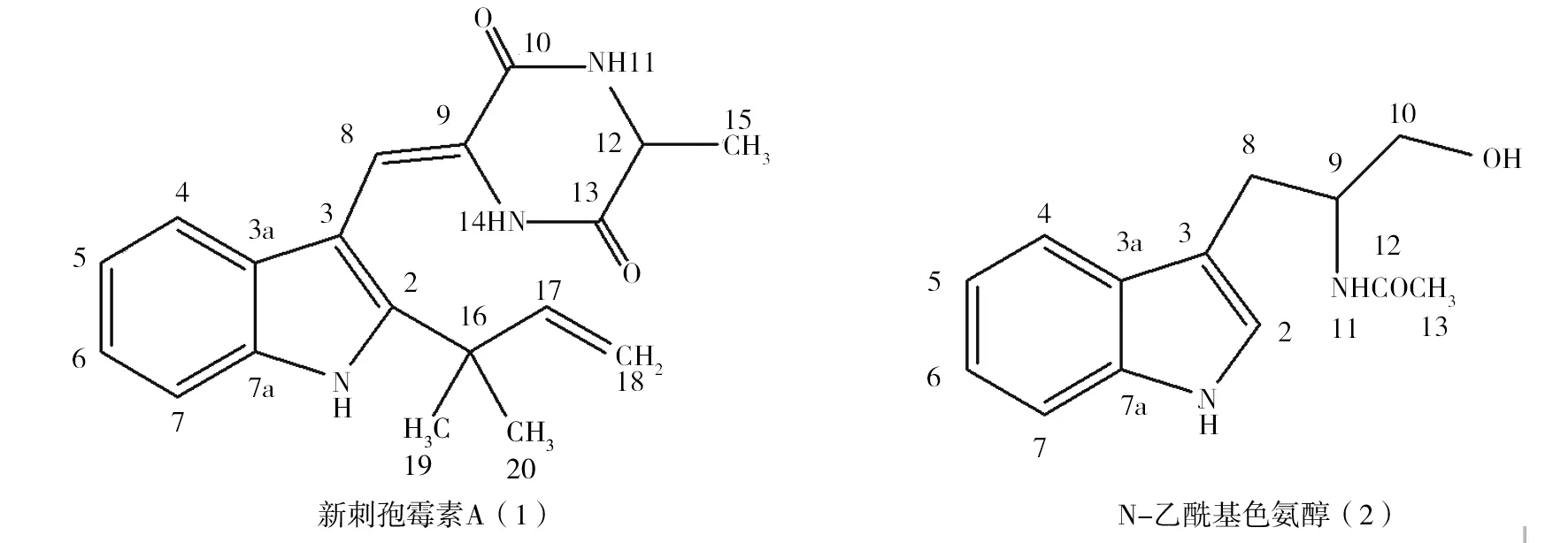
图1 2个化合物的化学结构Fig.1 The chemical structures of two compounds
1 材料与方法
1.1 材料
1.1.1 菌株 实验菌株分离自陕西省绥德县盐碱土壤,由延安大学生命科学院邓振山副教授利用16S rRNA 基因序列分析法鉴定为灰色链霉菌Streptomycesgriseus;供试菌为番茄灰霉病菌(Botrytiscinerea)、茄子黄萎病菌(Verticilliumdahliae)、辣椒枯萎病菌(Fusariumoxysporum)、白菜黑斑病菌(Altemabrassicae)、黄瓜枯萎病菌(Fusariumoxysporumf.sp.cucumerinum)、油菜菌核病菌(Sclerotiniasclerotiorum)和番茄早疫病菌(Alternariasolani)7种指示菌,均由延安市农科所提供。
1.1.2 培养基(g/L) 种子培养基:淀粉24, 葡萄糖1,蛋白胨3,牛肉膏3, 酵母膏5,CaCO34, 水1 000 mL,pH 8.0,28 ℃培养48 h;发酵培养基:大豆粉20,蛋白胨2,葡萄糖20,淀粉5,酵母膏2,NaCl 4,K3PO40.5,CaCO32,水1 000 mL, pH 8.0,28 ℃培养144 h。
1.1.3 仪器及试剂 XRC-1型显微熔点仪;IR Prestige-21红外光谱仪(日本岛津公司);AV-500 型核磁共振仪 (瑞士Bruker公司);MAT-711型质谱仪(美国Thermo公司);Vario EL有机元素分析仪(德国Elementar公司);1525型HPLC (Waters公司);Sephadex LH-20 (Pharmacia产品);柱层析硅胶100~200目(青岛海洋化工厂产品)。
1.2 方法
1.2.1 发酵方法 将已活化好的菌株转接到种子培养基内,28 ℃、300 r/min 摇床培养48 h,得到种子液。菌体从种子瓶接种于发酵培养基内,接种量为1∶10,置于28 ℃、300 r/min摇床培养144 h。发酵总量为40 L。
1.2.2 活性成分的分离与结构鉴定 将发酵144 h的发酵液40 L, 以3 000 r/min离心,得上清液和菌丝体两部分。菌丝体用丙酮浸泡,超声波辅助提取,将丙酮提取液减压浓缩,获得棕色粗浸膏509.1 g, 粗样品用水溶解,溶解部分用乙酸乙酯萃取,乙酸乙酯萃取液经浓缩后得到浸膏163.2 g, 此浸膏用硅胶(200~300目)柱层析分离,以V(石油醚)∶V(氯仿 )=20∶1→18∶1→16∶1→14∶1→12∶1→10∶1→8∶1→6∶1→4∶1 梯度洗脱,结合活性跟踪,收集得到两个有效组分A和B。将A和B两个组分继续用Sephadex LH-20凝胶柱进一步纯化,并用HPLC检测其纯度,最后得到2个化合物1(102 mg)和2(89 mg)。采用IR、1HNMR、13CNMR和ESI-MS等技术,结合相关文献对化合物1和2进行结构解析。
1.2.3 抗菌活性测定 ①单体化合物对病原真菌的抑制作用:将两个单体化合物用二甲亚砜(DMSO)溶解后,灭菌水稀释至100 mg/L的溶液,将5 μL测试液加入到灭菌后冷却至40 ℃的PDA培养基中,充分摇匀。以等体积的二甲亚砜加入到PDA培养基中作为空白对照,分别倒入直径为60 mm的培养皿内制成平板,备用。培养基凝固后,在每个培养皿中央用接菌针接入供试病原菌菌饼(直径为5 mm),将平板置于28 ℃恒温箱中培养3 d,测量菌落直径,每个样品重复平行3次,菌落直径测量3次求平均值,用下式计算抑菌率:菌落净生长直径=测量直径-5 mm,抑菌率(%)=((对照菌落直径-处理菌落直径)/对照菌落直径)×100%。②半抑菌浓度(IC50)的测定:选用两单体化合物抑菌效果明显的病原菌为供试菌株,进行毒力测定。将两种单体化合物样品采用倍半稀释法,分别配成含样品质量浓度为100、50、25、12.5和6.25 mg/L的溶液进行抑菌活性实验。以浓度对数—抑菌率几率值求出毒力回归线。根据曲线求出IC50值。
2 结果与分析
2.1 结构鉴定
2.1.1 化合物1 白淡黄色粉末状固体,m. p. 263.2~264.5 ℃;由ESI-MS: (m/z) 322 [M-H]-,推出该化合物的分子量为323,分子量为奇数,故分子式中含有奇数个氮原子;从元素分析得知碳、氢和氮的百分含量分别为70.59%、6.51%和12.96%;质谱结合元素分析提示该化合物的分子式为C19H21N3O2;IR(KBr) νmaxcm-1: 3 356、 3 258 (N-H伸缩振动), 3 068 (Ar-H伸缩振动), 1 679(酰胺羰基伸缩振动), 1 624 (碳-碳双键伸缩振动),905(RCH=CH2碳-碳双键面外弯曲振动)。1HNMR (CDCl3,500 MHz)δ:8.31(1H, s, H-1),7.46(1H,br.s,H-11),7.35(1H, d,J=7.0, H-4), 7.26 (1H, d,J=7.5, H-7), 7.20 (1H, s, H-8),7.16 (1H, dd,J= 7.5,7.2Hz, H-6), 7.14(1H,dd,J=7.2,7.0 Hz,H-5),6.38 (1H, br.s, H-14), 6.05 (1H,dd,J=16.8, 9.7 Hz, H-17), 5.22 (1H, d,J=9.7Hz, H-18α),5.16(1H, d,J=16.8 Hz, H-18β), 4.28 (1H, qd,J=6.8,1.5Hz, H-12), 1.59 (3H, d,J=6.8 Hz, H-15), 1.51 (6H, s, H-19, 20);13CNMR(CDCl3,125 MHz)δ: 165.8(C-13),160.0(C-10),144.5(C-17),143.8(C-2),134.1(C-3a), 125.9 (C-7a),124.3(C-3), 122.1(C-6), 120.9 (C-5),118.8(C-7), 113.1(C-18), 111.7 (C-8), 111.3(C-4), 102.6 (C-9), 51.4(C-12), 39.0 (C-16), 27.3 (C-19),27.0(C-20), 20.6 (C-15)。其理化数据与文献对照基本一致[10-11],故鉴定为新刺孢曲霉素A。
2.1.2 化合物2 白色固体,m.p.132.5~134.6 ℃。ESI(+)-MS: (m/z) 233 [M+H]+, 255[M +Na]+; 487 [2M+Na]+, 得出该化合物的分子量为232,从元素分析得知碳、氢和氮的含量分别为67.21%、6.88%和12.07%;质谱结合元素分析提示该化合物的分子式为C13H16N2O2;IR (KBr) νmaxcm-1: 3 402 (N-H, 伸缩振动), 3 285 (-OH伸缩振动), 1 639(酰胺C=O伸缩振动);1HNMR (DMSO-d6, 500 MHz) δ: 7.69 (1H, d,J= 8.2 Hz,H-4), 7.35(1H, d,J=8.0 Hz,H-7), 7.11 (1H,dd,J=8.2,7.8 Hz, H-6),7.08(1H,s,H-2),7.02(1H,dd,J=8.2,7.8 Hz, H-5), 4.22(1H,m, H-9),3.59(1H,d,J=6.0 Hz,H-10α),3.54(1H,d,J=12.6 Hz, H-10β),3.03(1H,dd,J=13.2,6.5 Hz,H-8α),2.90(1H,dd,J=13.2,6.5 Hz,H-8β),1.85(3H,s,H-13);13CNMR(DMSO-d6,125 MHz)δ:173.8(C-12),138.1(C-7a),130.0(C-3a),124.6(C-2),122.1(C-6),120.1(C-4,C-5),112.5(C-3),112.1(C-7),64.1(C-10),53.8(C-9),28.1(C-8),23.1(C-13)。以上数据与文献[12]报道的N-乙酰基色氨醇数据一致,故化合物2为N-乙酰基色氨醇。
2.2 两种化合物的抗菌活性
由表1可以看出,两个化合物浓度为100 mg/L时,对7种供试蔬菜病原菌均有一定的抑制效果,但对不同病原菌抑制效果存在较大差别。其中化合物1对番茄灰霉病菌和番茄早疫病菌菌丝具有强烈的抑制作用,抑制率分别为91.2%和90.6%;化合物2对茄子黄萎病菌的菌丝具有强烈的抑制作用,抑制率为90.2%。进一步对其毒力测定结果表明,化合物1对番茄灰霉病菌和番茄早疫病菌的IC50值分别为30.6和28.8 mg/L,化合物2对茄子黄萎病菌的IC50值为34.3 mg/L(表2)。

表1 二种化合物对7种蔬菜病原菌的抑制作用
注:表中数据均为3次重复平均值,表2同

表2 两种化合物对供试菌的毒力
3 讨 论
本研究从1株灰色链霉菌的菌丝体中分离得到两个属于echinulin家族的吲哚类生物碱,利用波谱学数据鉴定其结构为新刺孢霉素A(1)和N-乙酰基色氨醇(2),化合物1首次从放线菌中分离得到。有文献报道这类化合物具有清除自由基、改善记忆、抑制细胞增殖和抗细菌等多种生理活性[13-17],但尚未报道此类化合物具有抗蔬菜病原菌的作用。本研究采用菌丝生长速率法测定了两单体化合物对7种蔬菜病原菌的抑菌活性,结果表明,在100 mg/L的浓度下,两单体化合物对7种供试蔬菜病原菌均有一定的抑制作用,但对不同病原菌抑制效果有较大差异。化合物1对番茄灰霉病菌和番茄早疫病菌具有强烈的抑制作用,化合物2对茄子黄萎病菌具有强烈的抑制作用,抑制率均达90%以上。
尽管在实验室条件下,两个单体化合物分别对番茄灰霉病菌、番茄早疫病菌和茄子黄萎病菌具有强烈的抑制作用,但棚内或田间生态环境较为特殊,所以,两单体化合物在棚内和田间的防病效果有待于进一步试验研究。
[1] 彭卫福,李昆太,曾勇军.水稻病害的微生物防治研究进展[J].江西农业大学学报,2015, 37(4):625-631.
[2] Hyakumachi M, Takahashi H, Matsubara Y, et al. Recent studies on biological control of plant diseases in Japan[J]. Journal of General Plant Pathology, 2014, 80(4): 287-302.
[3] Compant S, Brader G, Muzammil S, et al. Use of beneficial bacteria and their secondary metabolites to control grapevine pathogen diseases[J].BioControl, 2013, 58(4):435-455.
[4] Kumari K S, Siddaiah V. Taxonomy, identification and biological activities of a novel isolate ofStreptomycesalbus[J].Journal of Pharmacy Research, 2011,4(21): 4678-4680.
[5] Atta HM. Biochemical studies on antibiotic production fromStreptomycessp.: Taxonomy, fermentation,isolation and biological properties[J].Journal of Saudi Chemical Society, 2015,19(1):12-22.
[6] 宋迤明,董夏梦,蔡琪敏,等.抗水稻白叶枯的菌株—白蚁链霉菌的筛选鉴定及发酵条件优化[J].微生物学杂志,2011,31(4): 52-57.
[7] Ayari A, Morakchi H, Djamila K G. Identification and antifungal activity ofStreptomycessp. S72 isolated from Lake Oubeira sediments in North-East of Algeria[J].African Journal of Bio-technology, 2012, 11(2): 305-311.
[8] Hozzein W N, Rabie W, Ali M A. Screening the Egyptian desert actinomycetes as candidates for new antimicrobial compounds and identification of a new desertStreptomycesstrain[J].African Journal of Biotechnology, 2011, 10(12): 2295-2301.
[9] 韩素贞,王静,吕超. 分离自甘肃天祝五台岭土壤的放线菌拮抗性的初步研究[J].生物技术通报,2011, (5): 146-150.
[10] 王巍, 陈超, 杨君, 等. 植物内生真菌代谢物吲哚生物碱Neoechinulin A [J].天然产物研究与开发, 2007,19(1): 48-50.
[11] 达娃卓玛, 周燕, 白央, 等.绵头雪莲花的化学成分研究 [J].中国中药杂志, 2008,33(9):1032-1035.
[12] Li YQ, Huang XS, Li MG,et al. A new compound isolated from a bioactiveStreptoycete[J]. Chin Chem Lett, 2005,16(5): 613-615.
[13] Gao H, Zhu T, Li D, et al.Prenylated indole diketopiperazine alkaloids from a mangrove rhizosphere soil derived fungusAspergilluseffusesH1-1[J]. Arch. Pharmacal Res, 2013,36: 952-956.
[14] Dewapriya P, Li YX, Hmaya SW, et al.Neoechinulin A supresses amyloid-β Oligomer induced microglia activation and thereby protects PC-12 cells from inflammation mediated toxicity[J].Neurotoxicology,2013,35:30-40.
[15] 陈立, 顾谦群.海绵来源真菌代谢产物中抗肿瘤活性成分研究[J].中国海洋大学学报, 2010, 40(5):69-71.
[16] Du FY, Li XM, Li CS, et al.Cristatumins A-D, new indole alkaloids from the marine-derived endophytic fungus Eurotium cristatum EN-220[J]. Bioorg Med Chem Lett, 2012, 22:4650-4653.
[17] Devi P, Rodrigues C, Naik CG, et al.Isolation and Characterization of Antibacterial Compound from a Mangrove Endophytic Fungus,PenicilliumchrysogenumMTCC 5108[J]. Indian J. Microbiol, 2012, 52: 617-623.
