大麻素受体1对小鼠脂质代谢的作用研究
2018-01-30魏立雯袁章琴赵明德韩建红古从伟付陆
魏立雯, 袁章琴, 赵明德, 韩建红, 古从伟, 付陆*
(1.西南医科大学实验动物中心,四川泸州646000; 2. 苏州大学附属第一医院骨科研究所,江苏苏州215006)
随着人类生活水平的提高,肥胖已成为全球性的现代文明病,它是目前发病率急剧上升的一种慢性疾病(王瑾等,2016)。肥胖常伴随多种严重并发症,涉及心血管、神经、呼吸、内分泌和消化等多个系统(汤劐菱等,2007)。因此,世界卫生组织已确认肥胖为一种疾病,并向全世界宣布“肥胖症将是全球首要的健康问题”。深入了解脂质代谢的分子机制,对于改善人体健康、靶向调控脂质代谢紊乱及其诱发的其他代谢性疾病,具有非常重要的意义。
大麻素受体(cannabinoid receptor 1,CB1)是内源性大麻素(endogenous cannabinoid,EC)信号系统的主要受体(胡予等,2007),在脂质代谢、胰岛素抵抗及葡萄糖摄取等机制中发挥重要作用,与糖尿病、肥胖以及脂肪沉积密切相关(Howlettetal.,2002;Matiasetal.,2006)。利莫那班(SR141716)是CB1受体抑制剂,通过选择性阻断EC信号系统中CB1发挥作用(马微等,2010)。肉碱棕榈酰转移酶1(carnitine palmitoyltransferase-1,CPT1)是脂肪酸β-氧化的关键酶,与脂肪酸分解和体脂含量密切相关(Louetetal.,2001)。CPT1高表达可以促进脂肪酸分解、降低体脂百分比、改善肝脏变性(Mussoetal.,2009)。其中,肉碱棕榈酰转移酶1A(CPT1A)主要在肝脏、肾脏和胰腺表达,主要作用是调节脂肪酸β-氧化、促进脂肪生成,其表达量降低会导致线粒体功能障碍、脂肪肝和肥胖(Drynanetal.,1996;Amengualetal.,2012)。肉碱棕榈酰转移酶1B(CPT1B)主要在心脏和脂肪组织表达,低表达时引起心脏功能障碍、白色脂肪组织的脂肪沉积(Heetal.,2012;Ratneretal.,2015)。
本课题组前期的研究表明,在体外细胞中,CB1通过调控CPT1A和CPT1B的表达影响脂质代谢和脂肪沉积(Zhangetal.,2014)。但是,目前还没有实验研究体内CB1通过对CPT1A、CPT1B作用来调节肥胖和脂质代谢的作用。本研究使用高脂饮食喂养小鼠构建肥胖模型,给予SR141716观察CB1对CPT1A、CPT1B表达的影响,为临床上预防代谢紊乱提供新思路。
1 材料与方法
1.1 构建肥胖模型
选取70只5周龄健康雄性C57BL/6J小鼠,由成都达硕实验动物有限公司提供,实验动物生产许可证号:SCXK(川)2015-030。饲喂于西南医科大学实验动物中心SPF屏障系统,实验动物使用许可证号:SYXK(川)2013-065,温度20~24 ℃,湿度40%~70%,光照时间为08∶00—20∶00。其中,20只给予正常标准饲料,另外50只给予高脂饲料,共16周。收集血液测定血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)。根据血清生化指标筛选出30只肥胖模型小鼠。
1.2 药物处理及采样
将SR141716溶解在含0.1%Tween-80的蒸馏水中。从标准饲料饲养组中随机选取15只小鼠做空白对照(S-Veh组),随机将30只肥胖模型小鼠分为2组(D-Veh组、D-SR组)。S-Veh组和D-Veh组灌胃0.1%Tween-80,D-SR组灌胃SR141716(10 mg·kg-1·day-1),每日测量小鼠体质量,共3周。灌胃实验结束后,颈椎脱臼处死小鼠,采集血液,用于测定生化指标。分离采集各组织样本,生理盐水冲洗后,称量,待RNA和蛋白质提取用。
1.3 血清生化指标检测
运用全自动生化分析仪(ES-480)检测血清中TG、TC、HDL和LDL的含量。使用Multiskan FC酶标仪(Thermo Scientific,USA),按照ELISA试剂盒(Boster,武汉)检测血清脂联素和瘦素含量。
1.4 总RNA提取和cDNA的制备
使用RNAsimple Total RNA Kit(TianGen,北京)提取试剂盒,按照说明提取各组织总RNA,并通过A260/A280值和1%琼脂糖凝胶电泳判断所提取的RNA质量。使用PrimeScript RT Reagent Kit with gDNA Eraser(TaKaRa,大连)反转录试剂盒将RNA反转录为cDNA。
1.5 实时荧光定量PCR
采用2-△△CT法(Vandesompeleetal.,2002)以β-actin和GAPDH作为双内参,在CFX96TMReal-time System上检测CB1、CPT1A和CPT1B基因在各组织中mRNA的表达水平。根据NCBI提供的各基因参考序列,设计荧光定量引物(表1),由北京六合华大基因有限公司合成。按照SYBR©Premix Ex TaqTMⅡ(TaKaRa,大连)试剂盒的使用说明书加样,标准品作为板间对照,并设No-Template Control,每个待测样3个重复。
1.6 Western Blot检测CB1的表达量
使用含有蛋白酶和磷酸酶抑制剂的RIPA蛋白裂解液(Pierce Biotechnology,USA)提取各组织蛋白质。利用BCA Protein Assay Kit(Life Technologies,USA)测定蛋白质含量。CB1单克隆抗体(Beverly,USA)、β-actin(Santa,USA)以及辣根过氧化物酶标记二抗(Boster,武汉)。Western Blot实验的具体操作方法主要参考Fu等(2016)。

表1 实时荧光定量PCR引物Table 1 The primers used for qPCR
1.7 数据处理
所有数据以Mean±SE表示,运用SPSS 19.0分析处理,组间的差异比较采用单因素方差分析。显著性水平α=0.05。
2 结果
2.1 小鼠体质量、肝脏质量、血清生化指标的变化
在药物处理之前,S-Veh、D-Veh和D-SR各组小鼠的平均体质量分别为30.5 g±0.4 g、40.6 g±0.3 g和41.2 g±0.4 g,统计分析发现S-Veh组与D-Veh组、D-SR组之间差异均有统计学意义(P<0.05),而D-Veh组和D-SR组之间差异无统计学意义(P>0.05)。经过3周SR141716灌胃处理后,各组小鼠的平均体质量分别为28.4 g±0.5 g、36.5 g±0.8 g和30.3 g±1.2 g。与D-Veh组相比,D-SR组小鼠的体质量极显著降低(P<0.01);与D-Veh组相比,D-SR组小鼠的肝脏质量显著降低(P<0.05)(图1)。同时,血清生化指标分析发现,与D-Veh组相比,D-SR组的TC和瘦素含量显著降低(P<0.05),HDL和脂联素含量显著升高(P<0.05),而TG和LDL含量的差异无统计学意义(P>0.05)(表2)。
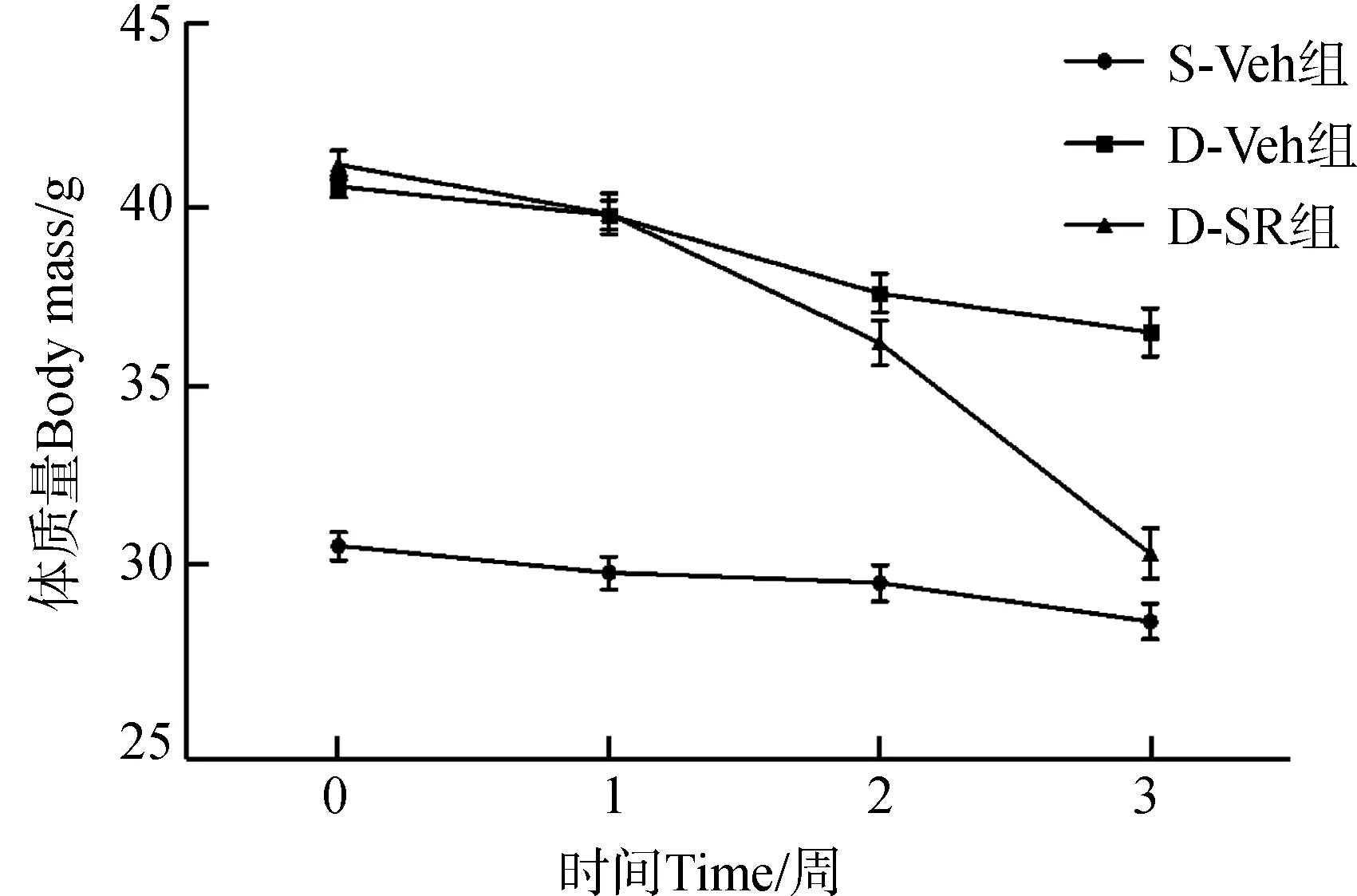
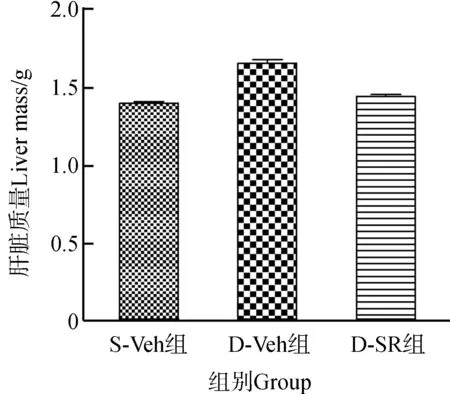
图1 小鼠体质量和肝脏质量的变化Fig. 1 The change of body mass and liver mass of mice
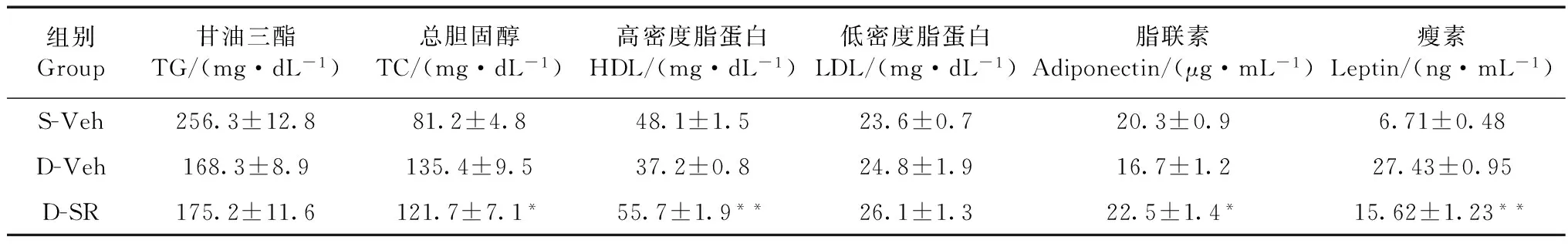
组别Group甘油三酯TG/(mg·dL-1)总胆固醇TC/(mg·dL-1)高密度脂蛋白HDL/(mg·dL-1)低密度脂蛋白LDL/(mg·dL-1)脂联素Adiponectin/(μg·mL-1)瘦素Leptin/(ng·mL-1)S-Veh256.3±12.881.2±4.848.1±1.523.6±0.720.3±0.96.71±0.48D-Veh168.3±8.9135.4±9.537.2±0.824.8±1.916.7±1.227.43±0.95D-SR175.2±11.6121.7±7.1*55.7±1.9**26.1±1.322.5±1.4*15.62±1.23**
注: D-Veh组和D-SR组相比,*P<0.05,**P<0.01; 下同
Notes: Comparison between D-Veh and D-SR,*P<0.05,**P<0.01; the same below
2.2 SR141716高效抑制CB1的表达水平
qPCR结果表明(图2:a),与D-Veh组相比,在D-SR组小鼠的皮下脂肪、内脏脂肪、骨骼肌和肝脏组织中,SR141716分别抑制了CB1基因mRNA表达水平的85.1%、87.8%、72.6%和91.3%(P<0.01)。同时,CB1基因mRNA表达水平在S-Veh组和D-Veh组小鼠各组织间的差异有统计学意义(P<0.05)。Western Blot结果表明(图2:b),CB1蛋白质表达量在D-SR组小鼠的皮下脂肪、内脏脂肪、骨骼肌、肝脏、心脏等组织中明显降低(P<0.05)。
2.3 CB1显著上调CPT1A、CPT1B基因的mRNA表达水平
与D-Veh组相比,CPT1A的表达量在D-SR组小鼠的肝脏中显著上调(P<0.05),CPT1B的表达量在D-SR组小鼠的皮下脂肪、内脏脂肪、骨骼肌组织中显著上调(P<0.05)(图3)。
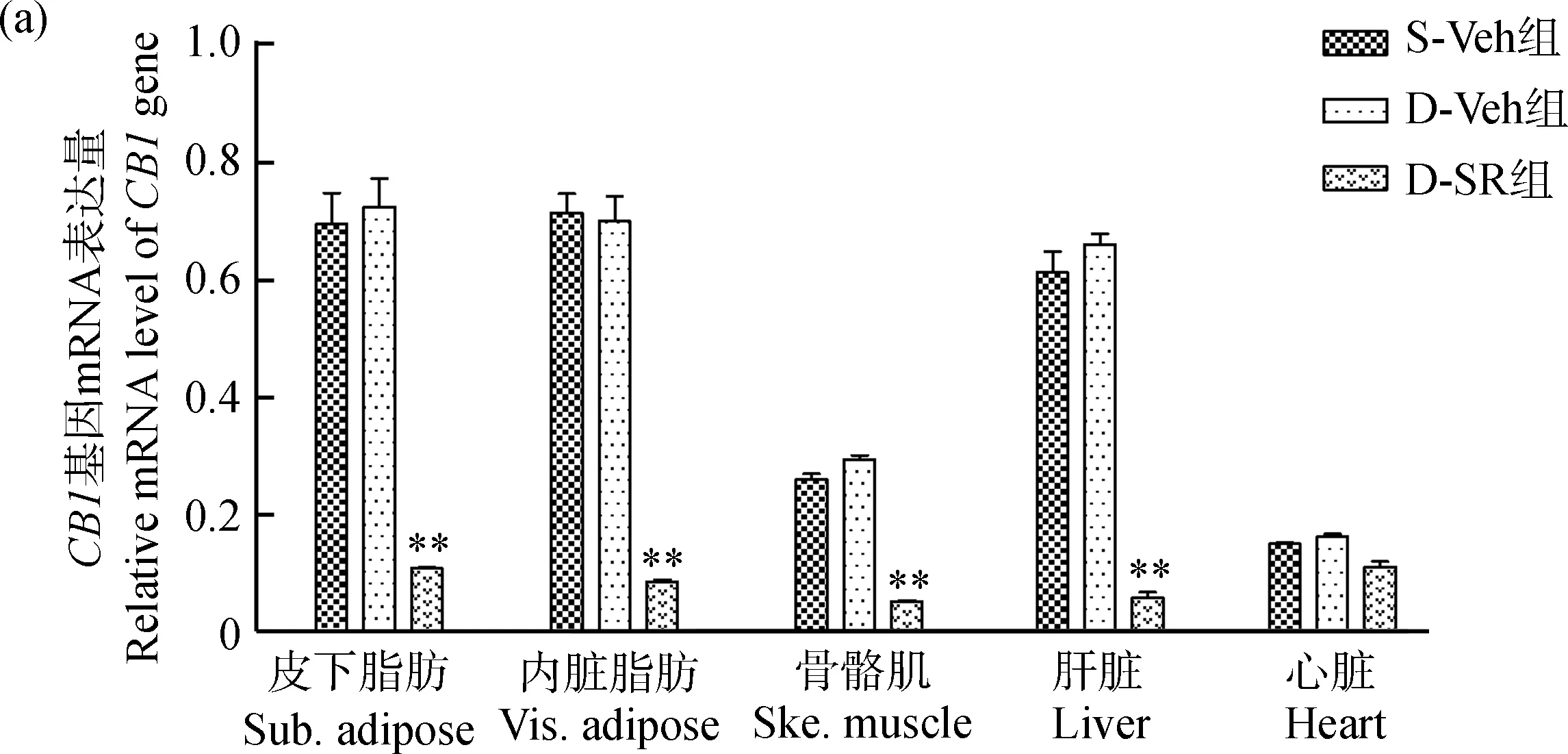
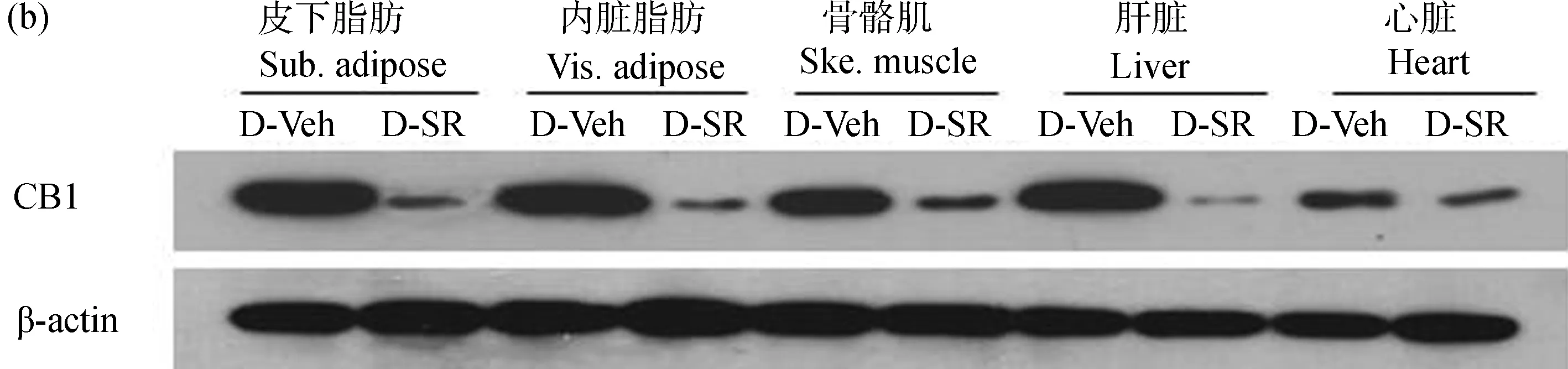
图2 小鼠组织中CB1的mRNA(a)和蛋白质(b)表达水平Fig. 2 The mRNA (a) and protein (b) levels of CB1 in mice
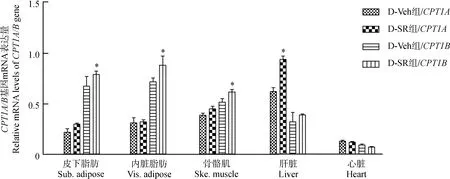
图3 小鼠组织中CPT1A和CPT1B的mRNA表达水平Fig. 3 The mRNA levels of CPT1A and CPT1B in mice
3 讨论
CB1是脂质类EC信号系统的主要受体,在脂肪代谢平衡、脑发育、炎症反应、神经系统功能障碍及食欲控制等机制中发挥着重要作用(Matiasetal.,2006;Katona & Freund,2012;Lutzetal.,2015;Lu & Mackie,2016)。SR141716作为CB1受体抑制剂已被商品化为食欲抑制剂、减肥药物(Rinaldi-Carmonaetal.,1994)。Leite等(2009)研究证实SR141716能够促进脂类分解,降低体质量,也可以通过降低TG、游离脂肪酸和TC,增高HDL/LDL比值改善血脂异常状况。
本研究旨在观察CB1对脂质代谢、体质量、肝脏质量、血清中TG、TC、HDL、LDL、脂联素和瘦素含量的影响。结果表明,SR141716灌胃组小鼠的体质量、肝脏质量、血清中TC和瘦素含量显著降低,血清中HDL和脂联素含量增加,然而,血清中TG和LDL含量没有明显改变。本实验研究结果与CB1可以降低体质量、减小腹围、改善肝脂肪变性及血脂异常状况的结论(Tangetal.,2012)基本一致。
大量研究数据证实,外周组织中CB1有望成为治疗肥胖和代谢综合征的新靶点(Crespilloetal.,2010;Silvestrietal.,2011)。前期体外实验证明,SR141716降低了CB1 mRNA水平的表达,但是增加了CPT1A和CPT1B的表达,从而减少了脂肪沉积(Zhangetal.,2014)。研究结果显示,肥胖模型小鼠皮下脂肪、内脏脂肪、骨骼肌和肝脏组织中CB1在mRNA和蛋白质水平均呈现高表达。SR141716灌胃处理后,CB1的表达显著下降,而CPT1A、CPT1B的表达随之升高。CPT1A的高表达主要在肝脏,而在骨骼肌、皮下脂肪、内脏脂肪组织中低表达。与CPT1A相反,CPT1B高表达在骨骼肌、皮下脂肪、内脏脂肪组织,低表达在肝脏。Nogueiras等(2008)的结果也证实,CB1受抑制后上调CPT1,从而促进脂肪分解、抑制脂肪生成。值得一提的是,低水平的CB1可在心脏中检测到,然而本实验中CPT1A和CPT1B在心脏的表达水平非常低,与前期在猪和心肌细胞上的研究结果相反(Zhangetal.,2014)。因此,关于CPT1A和CPT1B在心脏中的作用机制,尚需进一步研究证实。
本研究结论证实CB1通过作用于CPT1A、CPT1B发挥对脂质代谢的调节作用,提高血清中TC、HDL、脂联素和瘦素含量,为靶向调控脂质代谢提供了可靠的依据。
胡予, 马慧, 诸骏仁. 2007. 利莫那班-从阻断大麻素受体到控制心血管代谢危险因素[J]. 中国实用内科杂志, 27(17): 1405-1407.
马微, 付丽, 王海波, 等. 2010. 新型减肥药利莫那班的研究进展[J]. 黑龙江医药, 23(1): 19-21.
汤劐菱, 王莉莉, 王莉, 等. 2007. 利莫那班减肥作用及机制研究进展[J]. 中国药理学通报, 23(7): 844-847.
王瑾, 周炳杰, 耿骥, 等. 2016. 利莫那班衍生物对高脂肥胖模型小鼠的减肥作用[J]. 江苏大学学报(医学版), 26(2): 119-123.
Amengual J, Petrov P, Bonet ML,etal. 2012. Induction of carnitine palmitoyl transferase 1 and fatty acid oxidation by retinoic acid in HepG2 cells[J]. The International Journal of Biochemistry & Cell Biology, 44(11): 2019-2027.
Crespillo A, Suárez J, Bermúdez-silva FJ,etal. 2010. Expression of the cannabinoid system in muscle: effects of a high-fat diet and CB1 receptor blockade[J]. Biochemical Journal, 433(1): 175-185.
Drynan L, Quant PA, Zammit VA. 1996. Flux control exerted by mitochondrial outer membrane carnitine palmitoyltransferase over beta-oxidation, ketogenesis and tricarboxylic acid cycle activity in hepatocytes isolated from rats in different metabolic states[J]. Biochemical Journal, 317(Pt3): 791-795.
Fu L, Wei LW, Zhao MD,etal. 2016. Investigation of JAKs/STAT-3 in lipopolysaccharide-induced intestinal epithelial cells[J]. Clinical & Experimental Immunology, 186(1): 75-85.
He L, Kim T, Long Q,etal. 2012. Carnitine palmitoyltransferase-1b deficiency aggravates pressure overload-induced cardiac hypertrophy caused by lipotoxicity[J]. Circulation, 126(14): 1705-1716.
Howlett AC, Barth F, Bonner TI,etal. 2002. International union of pharmacology. XXVII. Classification of cannabinoid receptors[J]. Pharmacological Reviews, 54(2): 161-202.
Katona I, Freund TF. 2012. Multiple functions of endocannabinoid signaling in the brain[J]. Annual Review of Neuroscience, 35: 529-558.
Leite CE, Mocelin CA, Petersen GO,etal. 2009. Rimonabant: an antagonist drug of the endocannabinoid system for the treatment of obesity[J]. Pharmacological Reports, 61(2): 217-224.
Louet JF, Le MC, Pégorier JP,etal. 2001. Regulation of liver carnitine palmitoyltransferase I gene expression by hormones and fatty acids[J]. Biochemical Society Transactions, 29(Pt2): 310-316.
Lu HC, Mackie K. 2016. An introduction to the endogenous cannabinoid system[J]. Biological Psychiatry, 79(7): 516-525.
Lutz B, Marsicano G, Maldonado R,etal. 2015. The endocannabinoid system in guarding against fear, anxiety and stress[J]. Nature Reviews Neuroscience, 16(12): 705-718.
Matias I, Gonthier MP, Orlando P,etal. 2006. Regulation, function, and dysregulation of endocannabinoids in models of adipose and beta-pancreatic cells and in obesity and hyperglycemia[J]. Journal of Clinical Endocrinology & Metabolism, 91(8): 3171-3180.
Musso G, Gambino R, Cassader M. 2009. Recent insights into hepatic lipid metabolism in non-alcoholic fatty liver disease (NAFLD)[J]. Progress in Lipid Research, 48(1): 1-26.
Nogueiras R, Veyratdurebex C, Suchanek PM,etal. 2008. Peripheral, but not central, CB1 antagonism provides food intake-independent metabolic benefits in diet-induced obese rats[J]. Diabetes, 57(11): 2977-2991.
Ratner C, Madsen AN, Kristensen LV,etal. 2015. Impaired oxidative capacity due to decreased CPT1b levels as a contributing factor to fat accumulation in obesity[J]. American Journal of Physiology. Regulatory Integrative & Comparative Physiology, 308(11): R973-R982.
Rinaldi-Carmona M, Barth F, Héaulme M,etal. 1994. SR141716A, a potent and selective antagonist of the brain cannabinoid receptor[J]. FEBS Letters, 350(2-3): 240-244.
Silvestri C, Ligresti A, Marzo VD. 2011. Peripheral effects of the endocannabinoid system in energy homeostasis: adipose tissue, liver and skeletal muscle[J]. Reviews in Endocrine & Metabolic Disorders, 12(3): 153-162.
Tang Y, Ho G, Li Y,etal. 2012. Beneficial metabolic effects of CB1R anti-sense oligonucleotide treatment in diet-induced obese AKR/J mice[J]. PLoS ONE, 7(8): e42134. DOI: 10.1371/journal.pone.0042134.
Vandesompele J, De Preter K, Pattyn F,etal. 2002. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biology, 3(7): research0034.
Zhang YF, Yuan ZQ, Song DG,etal. 2014. Effects of cannabinoid receptor 1 (brain) on lipid accumulation by transcriptional control ofCPT1AandCPT1B[J]. Animal Genetics, 45(1): 38-47.
