家鸡似G蛋白偶联受体119基因的克隆与组织表达分析
2018-01-30邓秋洋张剑南王亚军李娟
邓秋洋, 张剑南, 王亚军, 李娟
(四川大学生命科学学院,生物资源与生态环境教育部重点实验室,成都610065)
G蛋白偶联受体(G protein-coupled receptor,GPCR)在真核生物中是最大、种类最多的细胞表面受体家族。人类基因组中参与编码GPCR的基因超过1 000个,广泛参与机体稳态、胚胎发育以及学习、记忆、视觉、嗅觉和味觉调控等过程,其胞外配体包括离子和小分子等,如脂肪酸、氨基酸、多肽和类固醇等(Takedaetal.,2002;Perez,2003;Vassilatisetal.,2003;Fredriksson & Schiöth,2005)。鉴于GPCRs在机体内介导的广泛生理效应,在制药工业中,50%的药物靶标设计针对GPCRs研发(Klabunde & Hessler,2002;Civelli,2005;Winzell & Ahrén,2007)。
G蛋白偶联受体119(GPR119)是一类A型视紫红质G蛋白偶联受体(rhodopsin-like GPCR),具典型7次跨膜结构,与胞内G蛋白偶联,介导下游效应(Hansenetal.,2012)。目前,在大鼠Rattusnorvegicus、小鼠Musmusculus、仓鼠Mesocricetusauratus、黑猩猩Pantroglodytes、恒河猴Macacamulatta、牛Bostaurus和狗Canislupusfamiliaris等哺乳动物中,GPR119基因已获得鉴定(Overtonetal.,2008)。在人Homosapiens、小鼠中,GPR119基因cDNA全长1 008 bp,编码335个氨基酸的前体蛋白,具典型7次跨膜结构,并由单一外显子编码(Boninietal.,2001;Ohishietal.,2001)。GPR119一直以来被视为孤儿受体,但有文献报道其可以被内源性配体溶血卵磷脂和油酰乙醇胺激活(Sogaetal.,2005;Overtonetal.,2006)。GPR119可与Gαs蛋白偶联,结合配体后,可刺激下游cAMP水平上升(Holstetal.,2011),进而刺激β细胞胰岛素以及肠道K细胞的葡萄糖依赖性,促胰岛素肽(GIP)和L细胞的胰高血糖素样肽1(GLP-1)的释放(Chuetal.,2008)。GIP与GLP-1是最重要的促胰岛素释放因子,由此,GPR119激动剂成为治疗糖尿病药物研发的重要候选对象,解析GPR119基因序列及其编码蛋白结构备受关注(Kang,2013)。
尽管在哺乳动物中,GPR119的功能已逐步明确,但在包括鸟类在内的低等脊椎动物类群中,关于GPR119的研究几属空白。本研究以家鸡Gallusgallus为研究对象,从其小肠组织中克隆得到1个似GPR119(GPR119-like)新基因,并确定其氨基酸序列。因该基因与鸡和人的GPR119基因具较高序列同源性,因此将其命为cGPR119b。在此基础上,本研究采用实时荧光定量PCR技术首次探究了cGPR119b在家鸡组织中的表达情况。这些结果为探究家鸡GPR119b的内源性配体、胞内信号通路,以及其在家鸡组织中的生理效应奠定基础。
1 材料与方法
1.1 实验材料
本实验中成体家鸡全部购自成都活禽市场。家鸡各组织放入液氮速冻后保存于-80 ℃备用。
1.2 实验试剂
本实验中用于序列克隆的高保真DNA聚合酶(KOD-FX)体系、各种限制性内切酶、T4 DNA连接酶、Easy-Taq DNA聚合酶、dNTP、反转录酶购自TaKaRa;引物合成及测序由北京华大六和股份有限公司完成;RACE试剂盒购自Clontech;RNAzol购自Molecular Research Center;大肠杆菌EscherichacoliDH5α由本实验室制备保存;DNA纯化胶回收试剂盒购自上海生工生物有限公司。
1.3 方法
1.3.1总RNA提取取家鸡心脏、肝脏、脾脏、肺、肾脏、肌肉、胰腺、精巢、卵巢、垂体,以及脑部各区域(大脑、下丘脑)和肠道分区(十二指肠、空肠、回肠、盲肠、直肠),放入液氮中速冻,并于液氮中充分研磨,将组织粉末与RNAzol混合均匀,加入240 μL DEPC-H2O混匀,4 ℃、12 000 r·min-1离心15 min;取上清,加入3 μL阿司咪唑,漩涡后于4 ℃、12 000 r·min-1离心10 min;取上清,加入等体积异丙醇,4 ℃、12 000 r·min-1离心15 min;弃上清,加入70%的乙醇漂洗2次,4 ℃、12 000 r·min-1离心3 min;弃上清,用DEPC-H2O溶解沉淀,-80 ℃保存。
1.3.2RNA反转录以各组织RNA为模板,反转录获得cDNA。反转录反应体系为:RNA 2 μg,Oligo-dT 1 μL,加DEPC-H2O补足至5 μL,70 ℃加热10 min,取出后冰浴2 min;再加入2 μL 5×Buffer,dNTPs 0.5 μL(终浓度2 mmol·L-1),MMLV逆转录酶0.5 μL,2 μL DEPC-H2O,42 ℃孵育1.5 h,70 ℃加热10 min。反应产物用DEPC-H2O稀释至50 μL,MiliQ-H2O作cDNA模板,-20 ℃贮存。
1.3.3引物设计根据NCBI数据库中的预测序列(LOC101750121)设计引物(表1),扩增cDNA获得GPR119b基因全长,根据测序序列,设计检测cGPR119b组织表达的特异性引物。

表1 引物序列Table 1 Primer sequence
1.3.4cGPR119b基因cDNA扩增以小肠cDNA为模板,采用PCR对cGPR119b基因进行扩增。PCR反应体系:5 μL 2×KOD Buffer,2 μL cDNA模板,2 μL 2 mmol·L-1dNTPs,0.1 μL rU1引物,0.1 μL rL1引物,0.2 μL KOD-Fx,加水补足至10 μL。反应条件为:94 ℃预变性2 min;94 ℃变性10 s,62 ℃退火30 s,68 ℃延伸60 s,34个循环;最后72 ℃延伸20 min。取3 μL产物用1.5%琼脂糖凝胶电泳检测。
1.3.5利用5’-RACE获取cGPR119b基因5’-UTR序列根据SMART RACE cDNA Amplification Kit试剂盒制备cDNA模板。在此基础上,利用基因特异性引物PCR扩增cGPR119b基因的5’-UTR。PCR反应体系为:5 μL 2×KOD Buffer,2 μL cDNA模板,2 μL 2 mmol·L-1dNTPs,0.1 μL UPM引物,0.1 μL GSP引物,0.2 μL KOD-Fx,加水补足至10 μL。反应条件:94 ℃预变性2 min;94 ℃变性10 s,72 ℃退火3 min,共5个循环;94 ℃变性10 s,70 ℃退火3 min,共5个循环;94 ℃变性10 s,68 ℃延伸3 min,25个循环;最后68 ℃延伸10 min。反应结束后,取3 μL产物用1.5%琼脂糖凝胶电泳检测。取上述产物稀释1 000倍作为模板,进行第二轮巢氏PCR反应。PCR反应体系及条件同上。
对获得的PCR产物进行加A反应。反应体系为:PCR产物4.5 μL,10×A-attachment Mix 0.5 μL,反应条件为60 ℃加热1 h。将加A后的PCR产物进行TA连接,反应体系为:加A后反应液1.5 μL,2×Ligation Buffer 2.5 μL,pTA2载体0.5 μL,T4 DNA连接酶0.5 μL,总体积5 μL。将TA连接产物转化DH5α进行菌落PCR筛选,将筛选到的阳性克隆进行质粒提取、双向序列测定。
1.3.6cGPR119b基因的组织表达分析采用实时荧光定量PCR检测cGPR119b基因在成体家鸡各组织中的表达情况。PCR反应体系为:2 μL组织cDNA模板,1 μL 10×Easy-Taq Buffer,0.2 μL EvaGreen,0.2 μL dNTPs,0.15 μL qU1,0.15 μL qL1,0.15 μL Easy-Taq。PCR反应条件为:94 ℃预变性 2 min;94 ℃变性20 s,62 ℃退火15 s,72 ℃延伸15 s,34个循环;最后72 ℃延伸5 min。实时荧光定量PCR的结果按照2-ΔΔCT法进行数据分析(Schmittgen & Livak,2008),步骤如下:首先将各组织样品cGPR119b基因的CT值减去对应组织内参基因β-actin的CT值,得到各组织的ΔCT值;然后将cGPR119b基因在回肠中的表达量选作参考,并将上一步分别所得的各组织的ΔCT值减去回肠组织的平均ΔCT值,得到ΔΔCT值;最后计算2-ΔΔCT值,得到各组织相对回肠中cGPR119b基因的表达量倍数,即cGPR119b基因在各组织间的相对表达量。
2 结果
2.1 cGPR119b基因编码区序列克隆
以小肠cDNA为模板,根据表1引物rU1+rL1,进行PCR扩增,得到cGPR119b基因编码区的全长cDNA序列。扩增片段约为1 kb,与预测基因片段大小一致(图1)。将该片段进行胶回收,并克隆到pTA2载体上,经阳性克隆筛选与酶切验证后,选3个克隆进行测序分析。序列比对显示,成功克隆到cGPR119b基因的编码区序列。
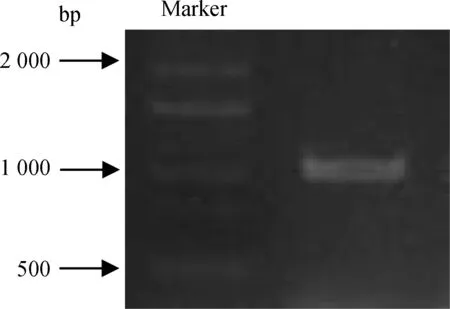
图1 cGPR119b基因开放阅读框区域扩增Fig. 1 Amplification of the open reading frame of chicken GPR119b-like gene
2.2 cGPR119b基因编码区序列分析
cGPR119b基因开放阅读框长954 bp,由单一外显子编码,编码317个氨基酸的前体蛋白。与其他GPCRs一致,cGPR119b同样含典型7次跨膜结构域,在第二胞内区前端有1个D-R-Y基序(图2)。通过与家鸡基因组序列进行比对分析,发现cGPR119b基因位于家鸡9号染色体上。cGPR119b的氨基酸序列与家鸡及人GPR119序列相似度相对较低(35%~36%),但与绿头鸭Anasplatyrhynchos(XM_013100626)、绿海龟Cheloniamydas(XM_007072744)、西部锦龟Chrysemyspictabellii(XM_005310936)和火鸡Meleagrisgallopavo(XM_010715066)的GPR119b具有很高的一致性,分别为79.9%、61.0%、62.3%和95.5%(图2)。

图2 家鸡(Gg)GPR119b的氨基酸序列与绿头鸭 (Ap)、绿海龟 (Cm)、西部锦龟 (Cb)、火鸡 (Mg)的比对分析Fig. 2 Amino acid sequence alignment of chicken (Gg) GPR119b with that of Anas platyrhynchos (Ap),Chelonia mydas (Cm), Chrysemys picta bellii (Cb), Meleagris gallopavo (Mg)
阴影部分显示7次跨膜区, 方框显示视紫红质亚家族的典型“D-R-Y”基序, 圆点表示与家鸡GPR119b相同的氨基酸残基, 破折号表示氨基酸残基的缺失
The putative seventransmembrane domains (TM1-7) were shaded, the“D-R-Y”motif was boxed, dots indicate the amino acids identical to chicken GPR119b and dashes indicate the gaps in the sequence
2.3 cGPR119b基因5’-UTR的确定
为探究cGPR119b基因的结构,以小肠cDNA为模板,采用5’-RACE方法扩增cGPR119b基因的5’-UTR区域,成功获得5’-UTR序列。结果显示,cGPR119b基因的5’-UTR大小为678 bp。通过与家鸡基因组序列比对,发现该区域不含新的外显子。由此可知,与GPR119基因一致,cGPR119b基因也由单一外显子组成(图3)。
2.4 cGPR119b基因组织表达分析
实时荧光定量PCR结果显示,cGPR119b基因在大脑、肝脏、肾脏、卵巢、精巢、垂体、胰腺、皮肤、脂肪、肺、十二指肠、空肠、回肠、盲肠、直肠等组织有表达。其中,cGPR119b基因在肝脏、肾脏、盲肠和精巢的表达量较高;在胰腺、皮肤、脂肪和肺等组织中仅有微量表达,而在下丘脑和脾脏不表达(图4)。
3 讨论
GPR119是A型视紫红质G蛋白偶联受体家族成员。在哺乳类动物中,该基因高表达于胰腺β细胞和PP细胞以及小肠组织的内分泌L细胞,参与胰岛素的释放调节,成为制药公司研发糖尿病治疗用药的靶标,备受关注(Moranetal.,2016)。本文首次报道了cGPR119b基因序列及其组织表达图谱,研究结果为探究cGPR119b基因在家鸡中的生理效应奠定基础。
利用RT-PCR技术成功从家鸡小肠中克隆得到cGPR119b基因的完整编码区序列。序列分析显示,cGPR119b基因的cDNA全长954 bp,编码具317个氨基酸的前体蛋白,该蛋白由单一外显子编码,具典型7次跨膜结构域,第二胞内区域前端含D-R-Y基序。氨基酸序列对比发现,家鸡GPR119b分别与绿头鸭、绿海龟、西部锦龟和火鸡中预测的GPR119b有79.9%、61.0%、62.3%、95.5%的序列相似度,但与人、小鼠和家鸡GPR119(JQ768805,本实验室已克隆)的序列相似度则较低,因此,本研究将该似GPR119基因命名为cGPR119b。有趣的是,GPR119b基因在哺乳动物中已消失。
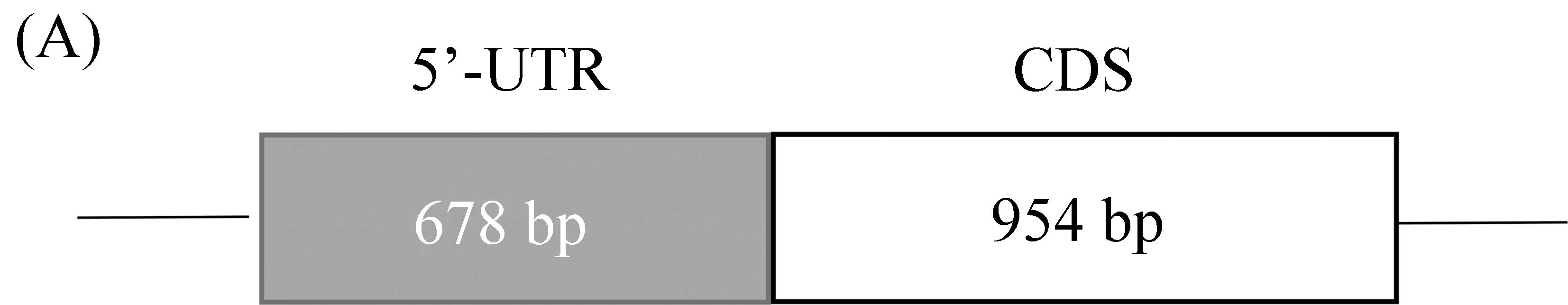

图3 cGPR119b的基因组成(5’-UTR+编码区)(A)及其5’-UTR区域核苷酸序列(B)Fig. 3 Composition of chicken GPR119-like gene (cGPR119b) (A) and its 5’-UTR region nucleotide sequence (B)
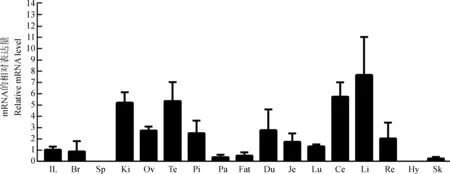
图4 cGPR119b基因在家鸡组织中的表达Fig. 4 Chicken GPR119b-like gene expression in chicken tissues
IL. 回肠, Br. 大脑, Sp. 脾脏, Ki. 肾脏, Ov. 卵巢, Te. 精巢, Pi. 垂体, Pa. 胰腺, Fat. 脂肪, Du. 十二指肠, Je. 空肠, Lu. 肺, Ce. 盲肠, Li. 肝脏, Re. 直肠, Hy.下丘脑, Sk. 皮肤
IL. ileum, Br. brain, Sp. spleen, Ki. kidney, Ov. ovary, Te. testis, Pi. pituitary, Pa. pancreas, Fat. fat, Du. duodenum, Je. jejunum, Lu. lung, Ce. cecum, Li. liver , Re. rectum, Hy. hypothalamus, Sk. skin
采用5’-RACE技术成功获得cGPR119b基因的5’-UTR。测序结果显示,该5’-UTR长度为678 bp,暗示该5’-UTR区或含未知调控序列,或参与控制cGPR119b基因翻译效率。利用实时荧光定量PCR方法解析cGPR119b基因在家鸡组织中的表达图谱,发现cGPR119b基因在肝脏、精巢、肾脏和盲肠等组织表达量较高,而在胰腺和肠分区组织中的表达量较低。该结果与哺乳动物GPR119基因的组织表达存在较大差异(Chuetal.,2007;Odorietal.,2013)。在大鼠中,GPR119基因主要在胰腺组织表达(Sakamotoetal.,2006);在人中,GPR119基因在胰腺和肠内分泌细胞高表达(Chuetal.,2008)。GPR119基因在家鸡中存在2个拷贝(cGPR119与cGPR119b)。家鸡GPR119b基因组织表达图谱区别于其在人、大鼠中的表达图谱,这一结果暗示:cGPR119b基因或与哺乳动物及家鸡GPR119基因的功能显著不同,值得深入探究。
Bonini JA, Borowsky BE, Adham N,etal. 2001. DNA encoding SNORF25 receptor: U.S. Patent 6, 221, 660[P]. (2001-4-24)[2017-5-1]. https://www.google.com/patents/US6221660660.
Chu ZL, Carroll C, Alfonso J,etal. 2008. A role for intestinal endocrine cell-expressed G protein-coupled receptor 119 in glycemic control by enhancing glucagon-like peptide-1 and glucose-dependent insulinotropic peptide release[J]. Endocrinology, 149(5): 2038-2047.
Chu ZL, Jones RM, He H,etal. 2007. A role for β-cell-expressed G protein-coupled receptor 119 in glycemic control by enhancing glucose-dependent insulin release[J]. Endocrinology, 148(6): 2601-2609.
Civelli O. 2005. GPCR deorphanizations: the novel, the known and the unexpected transmitters[J]. Trends in Pharmacological Sciences, 26(1): 15-19.
Fredriksson R, Schiöth HB. 2005. The repertoire of G-protein-coupled receptors in fully sequenced genomes[J]. Molecular Pharmacology, 67(5): 1414-1425.
Hansen HS, Rosenkilde MM, Holst JJ,etal. 2012. GPR119 as a fat sensor[J]. Trends in Pharmacological Sciences, 33(7): 374-381.
Holst JJ, Knop FK, Vilsbøll T,etal. 2011. Loss of incretin effect is a specific, important, and early characteristic of type 2 diabetes[J]. Diabetes Care, 34(Supplement 2): S251-S257.
Kang SU. 2013. GPR119 agonists: a promising approach for T2DM treatment? A SWOT analysis of GPR119[J]. Drug Discovery Today, 18(23): 1309-1315.
Klabunde T, Hessler G. 2002. Drug design strategies for targeting G-protein-coupled receptors[J]. Chembiochem, 3(10): 928-944.
Moran BM, McKillop AM, O’Harte FP. 2016. Development of novel ligands for peptide GPCRs[J]. Current Opinion in Pharmacology, 31: 57-62.
Odori S, Hosoda K, Tomita T,etal. 2013. GPR119 expression in normal human tissues and islet cell tumors: evidence for its islet-gastrointestinal distribution, expression in pancreatic beta and alpha cells, and involvement in islet function[J]. Metabolism, 62(1): 70-78.
Ohishi T, Takasaki J, Matsumoto M,etal. 2001. Method of screening remedy for diabetes: U.S. Patent 10/240, 540[P]. (2001-11-30)[2017-5-1]. https://www.google.com/patents/US20030180813.
Overton H, Fyfe M, Reynet C. 2008. GPR119, a novel G protein-coupled receptor target for the treatment of type 2 diabetes and obesity[J]. British Journal of Pharmacology, 153(S1): S76-S81.
Overton HA, Babbs AJ, Doel SM,etal. 2006. Deorphanization of a G protein-coupled receptor for oleoylethanolamide and its use in the discovery of small-molecule hypophagic agents[J]. Cell Metabolism, 3(3): 167-175.
Perez DM. 2003. The evolutionarily triumphant G-protein-coupled receptor[J]. Molecular Pharmacology, 63(6): 1202-1205.
Sakamoto Y, Inoue H, Kawakami S,etal. 2006. Expression and distribution of Gpr119 in the pancreatic islets of mice and rats: predominant localization in pancreatic polypeptide-secreting PP-cells[J]. Biochemical and Biophysical Research Communications, 351(2): 474-480.
Schmittgen TD, Livak KJ. 2008. Analyzing real-time PCR data by the comparative CT method[J]. Nature Protocols, 3(6): 1101-1108.
Soga T, Ohishi T, Matsui T,etal. 2005. Lysophosphatidylcholine enhances glucose-dependent insulin secretion via an orphan G-protein-coupled receptor[J]. Biochemical and Biophysical Research Communications, 326(4): 744-751.
Takeda S, Kadowaki S, Haga T,etal. 2002. Identification of G protein-coupled receptor genes from the human genome sequence[J]. FEBS Letters, 520(1-3): 97-101.
Vassilatis DK, Hohmann JG, Zeng H,etal. 2003. The G protein-coupled receptor repertoires of human and mouse[J]. Proceedings of the National Academy of Sciences, 100(8): 4903-4908.
Winzell MS, Ahrén B. 2007. G-protein-coupled receptors and islet function-Implications for treatment of type 2 diabetes[J]. Pharmacology & Therapeutics, 116(3): 437-448.
