纤维素酶-超声波辅助法提取葡萄籽原花青素的工艺研究
2018-01-30俞腾飞裴允彤
俞腾飞,裴允彤,张
(北京化工大学化工资源有效利用国家重点实验室,北京 100029)
0 引言
原花青素(Proanthocyanidins,PC) 是植物中广泛存在的一大类多酚类化合物的总称,多存在于葡萄、山楂、花生、银杏、松树等植物的果实、籽和皮中,具有良好的抗氧化性和清除自由基能力[1-3],是目前国际上公认的清除人体内自由基最有效的天然抗氧化剂。原花青素在人体内能被快速吸收,口服20 min内就能在人体血液中达到最高浓度,其在人体内抗自由基氧化能力可以达到等量VC的20倍和等量VE的50倍,能及时有效地清除血液中的自由基。正因为原花青素的这种强抗氧化能力,使其广泛用于治疗临床上的水肿、糖尿病性视网膜病、静脉曲张和过敏发炎等疾病。除此之外,原花青素还具有恢复人体胶原蛋白活力的能力,因此可用于生产口服营养品和化妆品,使皮肤平滑而富有弹性,达到保健的功效。原花青素还能保护人体免受阳光伤害,促进牛皮癣和寿斑的愈合,因此原花青素也是某些皮肤霜的极好添加剂。
目前,国内外提取原花青素的主要方法有溶剂萃取法、超声波辅助萃取法、微波辅助萃取法、酶解法和超临界流体萃取法等。其中,酶解法[4]能够使植物组织分解,加速有效物质的溶出,从而提高提取率,但酶解时间一般略长,不利于工业化生产;超声波辅助萃取[5]是一种物理破碎过程,超声波的空化作用及其所产生的热效应、乳化、扩散、击碎等次级效应,有利于细胞内有效物质的释放、扩散及溶解,并且具有无污染、操作简单、提取快速、提取效率高等优点,在植物萃取中具有良好的应用前景。目前,已有不少关于酶解法与超声波法提取植物中有效成分的研究[6-7],但是二者同时应用于葡萄籽中原花青素的提取研究还鲜有报道。试验将纤维素酶及超声波共同作用于葡萄籽原花青素的提取中,通过单因素试验和正交试验确定最佳提取条件,以期最大限度地提高原花青素的提取率。
1 材料与方法
1.1 材料与仪器
赤露珠葡萄籽、原花青素标准品(阿拉丁试剂,纯度≥95%),上海伊卡生物技术有限公司提供;纤维素酶(酶活性:15 000 U/g),北京格林博远生物科技有限公司提供;甲醇、乙醇、石油醚(60~90℃)、香草醛、浓盐酸、醋酸、醋酸钠等,均为国药分析纯。
LE204E/02型电子天平,梅特勒-托利多仪器(上海)有限公司产品;JA5003型电子天平,上海舜宇恒平科学仪器有限公司产品;T6型新世纪紫外-可见分光光度计,北京普析通用仪器有限责任公司产品;SHZ-D(Ⅲ)型循环水式多用真空泵,河南省予华仪器有限公司产品;RE-52A型旋转蒸发器,北京神泰伟业仪器设备有限公司产品;KQ3200DE型数控超声波清洗器,昆山市超声仪器有限公司产品;HY-2A型数显调速多用振荡器,江苏省金坛市荣华仪器制造有限责任公司产品;HH-2型数显恒温水浴锅,江苏省金坛市荣华仪器制造有限责任公司产品;TG16-WS型台式高速离心机,长沙市维尔康湘鹰离心机有限公司产品。
1.2 试验方法
1.2.1 原花青素标准曲线的绘制
精确称取原花青素标准品0.100 8 g置于烧杯中,加入少量蒸馏水溶解后缓缓倒入100 mL容量瓶中(烧杯多次洗涤后的液体均倒入容量瓶内),加蒸馏水至容量瓶100 mL刻度,摇匀。用移液枪分别精确吸取2.0,4.0,6.0,8.0,10.0 mL置于25 mL容量瓶中,加蒸馏水至容量瓶25 mL刻度,摇匀。吸取上述各种浓度的样品液0.5 mL于20 mL试管中,以蒸馏水作为空白对照,加入香草醛-甲醇溶液(0.04 g/mL)3 mL,再加入1.5 mL浓盐酸,摇匀后放入30℃水浴中反应30 min[8]。将上述液体加入到比色皿中,以空白对照为基准,在550 nm处测其吸光度,以原花青素质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
原花青素标准曲线见图1。
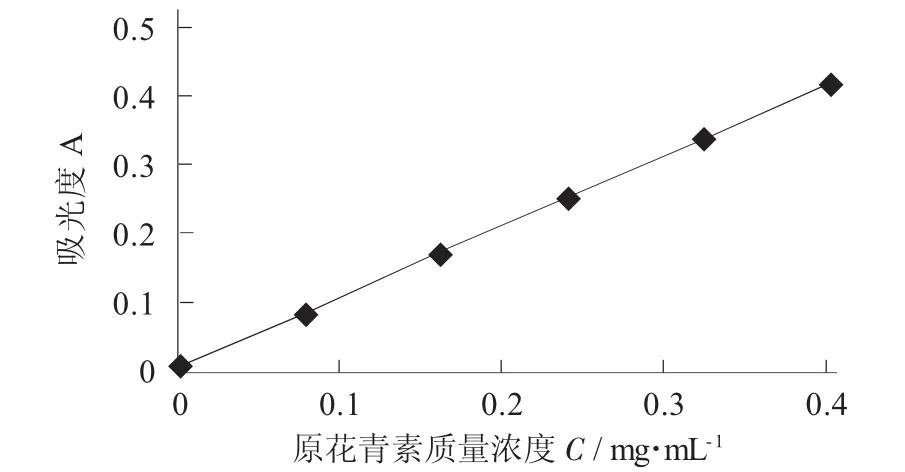
图1 原花青素标准曲线
吸光度A=1.043 1C-0.002 3.
式中:C——原花青素质量浓度,mg/mL;
A——吸光度。
1.2.2 原花青素提取率的测定
将得到的葡萄籽原花青素提取液稀释一定倍数后,按照1.2.1测定标准曲线的方法在550 nm处测定其吸光度,根据标准曲线回归方程计算得到稀释液中原花青素质量浓度,然后乘以稀释倍数即可得到提取液中原花青素质量浓度,从而得出提取率。

式中:C——提取液中原花青素质量浓度,mg/mL;
V——提取液体积,mL;
m——脱脂葡萄籽质量,mg。
1.2.3 原料预处理
将葡萄籽洗净后,放入一定温度的烘箱内充分干燥,用粉碎机粉碎干燥后的葡萄籽,过40目筛,按葡萄籽质量与石油醚浸泡液体积1∶5的比例浸泡葡萄籽24 h(葡萄籽脱脂),过滤、干燥后得到备用的脱脂葡萄籽。
1.2.4 单因素试验
(1)纤维素酶添加量对原花青素提取率的影响。准确称取5份干燥的脱脂葡萄籽1.000 g置于100 mL具塞三角瓶内,各加入30 mL 60%的乙醇溶液,加入缓冲溶液调节pH值至5.0,纤维素酶的添加量分别为6,8,10,12,14 mg/g,放入超声波仪内超声20 min。待超声完成后,提取液经离心、过滤后移至100 mL容量瓶内,并向容量瓶加去离子水至100 mL刻度线,测定原花青素的含量,从而确定纤维素酶的最适添加量。
(2)提取剂体积分数对原花青素提取率的影响。乙醇体积分数分别为40%,50%,60%,70%,80%,纤维素酶添加量10 mg/g,其余条件同(1),测定原花青素的含量,考查不同体积分数的乙醇溶液对原花青素提取率的影响。
(3)料液比对原花青素提取率的影响。分别加入60%的乙醇溶液20,25,30,35,40 mL,纤维素酶添加量10 mg/g,其余条件同(1),测定原花青素的含量,考查不同料液比对原花青素提取率的影响。
(4)超声时间对原花青素提取率的影响。超声时间分别为10,15,20,25,30 min,纤维素酶添加量10 mg/g,其余条件同(1),测定原花青素的含量,考查超声时间对原花青素提取率的影响。
1.2.5 正交试验
在单因素试验的基础上,对纤维素酶添加量、乙醇体积分数、料液比、超声时间4个因素分别取3个水平,按照L9(34)正交表进行优化组合试验。
正交试验因素与水平设计见表1。

表1 正交试验因素与水平设计
2 结果与分析
2.1 纤维素酶添加量对原花青素提取率的影响
纤维素酶添加量对原花青素提取率的影响见图2。

图2 纤维素酶添加量对原花青素提取率的影响
纤维素酶能够促使葡萄籽中的纤维素水解,使植物细胞壁部分破损,细胞膜就会因此发生一定程度的变形或破裂,从而增加膜的渗透性,降低传质阻力,促使原花青素更快地溶出[9-10]。由图2可知,纤维素酶添加量在10 mg/g以下时,原花青素提取率随纤维素酶添加量的增加而上升,在10 mg/g时达到最大值,超过此值后原花青素提取率反而下降。这是因为在纤维素酶添加量较低时,酶解反应尚未进行完全,随着酶添加量的增加,反应趋于完全,继续增加酶添加量,底物浓度不能对酶达到饱和,导致酶的作用受到抑制[11]。因此,选择纤维素酶添加量10 mg/g左右较为合适。
2.2 乙醇体积分数对原花青素提取率的影响
乙醇体积分数对原花青素提取率的影响见图3。

图3 乙醇体积分数对原花青素提取率的影响
由图3可知,随着乙醇体积分数的增加,原花青素提取率增大;当乙醇体积分数达到50%时,提取率达到最高。此后,再增加乙醇体积分数,原花青素提取率反而降低。这是由于乙醇体积分数较高时,一些醇溶性杂质、亲脂性强的成分浸出量增加,这些成分会与乙醇、水分子结合,与原花青素的溶解形成竞争,从而导致原花青素的提取率下降[12]。因此,选择乙醇体积分数为50%左右。
2.3 料液比对原花青素提取率的影响
料液比对提取率的影响见图4。
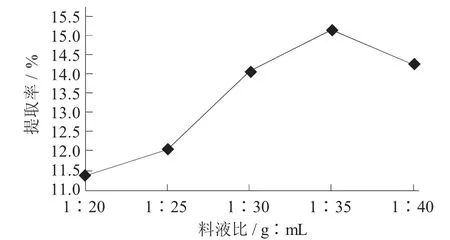
图4 料液比对原花青素提取率的影响
由图4可知,在初始阶段,原花青素的提取率随料液比的增加而增大,在1∶35(g∶mL) 时达到最大值。继续增加料液比,原花青素提取率稍有下降。这是由于过量的溶剂一方面会稀释酶的浓度,从而减小酶与底物的接触几率;同时也会导致其他杂质的溶出,从而降低了原花青素的提取率。
2.4 超声时间对原花青素提取率的影响
超声时间对原花青素提取率的影响见图5。
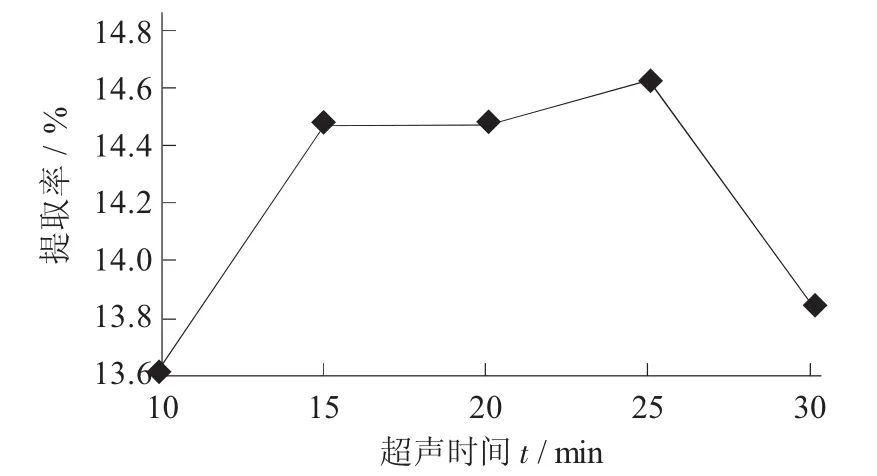
图5 超声时间对原花青素提取率的影响
由图5可知,在10~30 min的超声时间内原花青素提取率呈现先增加后下降的趋势,在15~25 min时间内提取率几乎不变。出现这种结果的原因,可能和纤维素酶与超声波的协同作用有关。在较短的时间内,随着超声时间的增加,原花青素的溶出量增加,提取率增大;在15~25 min过程中,原花青素提取率维持在一个相对稳定的状态;超过25 min后,由于体系中的温度过高,使得纤维素酶逐渐失活,同时原花青素的结构也发生变化,提取率开始下降。考虑到能耗成本,因此超声时间选择15 min左右为宜。
2.5 酶解温度对原花青素提取率的影响
有关研究数据表明[9],在一定范围内,酶解温度对原花青素提取率无明显影响,因此试验中没有专门研究酶解温度对原花青素提取率的影响。
2.6 正交试验结果与分析
L9(34)正交试验结果见表2,正交试验方差分析见表3。

表2 L9(34)正交试验结果

表3 正交试验方差分析
由表2可知,4个因素对葡萄籽原花青素提取效果影响的主次顺序为A>C>B>D。最佳工艺条件为A1B3C3D2,即纤维素酶添加量8 mg/g,乙醇体积分数55%,料液比1∶40(g∶mL),超声时间20 min。
由表3可知,4个因素中纤维素酶添加量对提取率有比较显著的影响,乙醇体积分数、料液比和超声时间对提取率无显著影响。
2.7 验证试验及讨论
按照正交试验得到的最佳提取条件:纤维素酶添加量8 mg/g,乙醇体积分数55%,料液比1∶40(g∶mL),超声时间20 min进行试验,脱脂葡萄籽原花青素的提取率为17.2%。同等条件下,不添加纤维素酶,单独超声时原花青素的提取率仅为14.6%。以上数据表明,纤维素酶协同超声波辅助法对葡萄籽原花青素的提取率有一定的提高作用。
据文献报道[10-15],超声波对纤维素的活性有促进作用,分析产生这种结果的原因可能包括以下几个方面:①超声波能产生强烈的空化及振荡作用,增大了酶与底物的接触频率,同时纤维素酶可破坏植物细胞壁而降低超声过程中的传质阻力[16],二者协同作用加快有效物质的溶出,提高原花青素提取率;②当超声时间在一定范围内,超声波作用于纤维素酶时,不但不会降低酶的活性,还能产生能量促进酶介导反应的发生,增强了纤维素酶的活性[17-18];③超声过程中产生的热效应提高了反应体系的温度,加快分子运动速率,从而促进酶解反应的进行[19]。
3 结论
对脱脂葡萄籽进行了纤维素酶协同超声波辅助法提取的研究,在单因素试验的基础上,设计正交试验确定了最佳提取条件为纤维素酶添加量8 mg/g,乙醇体积分数55%,料液比1∶40(g∶mL),超声时间20 min,测得原花青素的提取率为17.2%,单独使用超声波法用于脱脂葡萄籽原花青素提取时,原花青素提取率为14.6%,该法比单纯的超声波法提高了17.8%。纤维素酶协同超声波辅助法结合了酶提取法与超声波提取法的优点,利用二者的相互促进作用显著提高了葡萄籽原花青素提取率,具有提取时间短、条件温和、提取率高等优点,为植物中有效成分的提取提供了新途径。
[1]李春阳,许时婴,王璋.DPPH法测定葡萄籽原花青素清除自由基的能力 [J].食品科学,2006,25(2):103-106.
[2]Da Silva JMR,Darmon N,Fernandez Y.Oxygen free radical scavenger capacity in aqueous models of different procyanidins from grape seeds[J].Journal of Agricultural and Food Chemistry,1991,39 (9):1 549-1 552.
[3]余莹,粟武,魏东芝.原花青素体外清除自由基活性的研究 [J].华东理工大学学报,2002,28(3):318-320.
[4]张圣燕.纤维素酶在天然产物提取中的应用研究 [J].广东化工,2011,38(9):59-60.
[5]苏芳,顾明广,冯献起.超声波辅助法提取葡萄籽中原花青素工艺的研究 [J].中国酿造,2015,34(12):113-116.
[6]李小龙,雍其欢,崔秋兵.纤维素酶-超声波辅助提取泡姜姜辣素的研究 [J].中国酿造,2015,34(6):103-106.
[7]张利芳,张名位,黄文,等.纤维素酶协同超声波辅助提取苦瓜多糖工艺优化 [J].农业机械学报,2010,41(11):143-147.
[8]李绮丽,吴卫国,彭芳刚,等.莲子皮原花青素测定方法的研究 [J].现代食品科技,2012,28(2):241-245.
[9]胡位荣,王竞婄,苏韩,等.响应面法优化火龙果皮中原花青素提取工艺 [J].广东农业科学,2013,40(20):97-100.
[10]吴春,张艳.纤维素酶法提取葡萄籽中原花青素的研究 [J].食品科学,2006,27(10):258-261.
[11]陶涛,李立祥,张芳,等.超声波协同纤维素酶对黄精多糖和皂苷的提取研究 [J].食品工业科技,2012,33(9):271-275.
[12]崔倩,蒋益虹,戴蕾,等.莲房原花青素的提取纯化技术研究 [J].食品工业科技,2011,32(8):238-241.
[13]高大维,于淑娟,闵亚光.超声波对纤维素酶活力的影响 [J].华南理工大学学报 (自然科学版),1997(11):22-26.
[14]于淑娟,高大维.超声波作用下纤维素酶水解反应动力学的研究 [J].厦门大学学报(自然版),1997(3):424-429.
[15]于淑娟,高大维.超声波强化纤维素酶水解反应机理研究 [J].华南理工大学学报(自然科学版),1998(11):90-95.
[16]刘富梁,金卫根,梁华正,等.酶法在中药提取中的研究进展 [J].时珍国医国药,2006,17(7):1 152-1 153.
[17]Szabóoe,Csiszár E.The effect of low-frequency ultrasound on the activity and efficiency of a commercial cellulase enzyme[J].Carbohydrate Polymers,2013 (2): 1 483-1 489.
[18]何泽超.纤维素的酶水解及超声波对其加速作用的研究 [D].成都:四川大学,2001.
[19]杨进妹,王婷,何荣海.超声对酶解反应的影响 [J].农产品加工,2010(7):70-73.◇
