生物酶协同催化体系及其对羊毛纤维的作用机制
2018-01-29刘建勇吴胜争赵笑康
刘建勇, 吴胜争, 赵笑康
(天津工业大学 纺织学院, 天津 300387)
现阶段羊毛纤维防缩处理的方法仍是以氯化法为主,此类方法虽然可大幅改善羊毛的防缩性能,但是因其排放废水中的可吸附有机卤化物(AOX)对生态环境极其有害,欧美国家纷纷通过立法的方式对其排放加以限制[1]。在此背景下,羊毛纤维的无氯防缩处理技术备受关注。
生物酶处理为目前研究较多的羊毛无氯处理方法,生物酶可将纤维鳞片层中的部分肽键水解,提高鳞片的溶解性,从而部分剥除鳞片层[2-3];但受鳞片惰性结构的影响,生物酶处理法仍需要结合化学药剂的预处理。周雯等[2]利用Bacillussubtitles制作角蛋白酶,并与蛋白酶一浴处理羊毛,浸泡处理1 h后羊毛鳞片有明显的的剥离效果,但处理时间长,纤维损伤大;KAUR等[4]通过二步法在pH值为6左右的氯化钠溶液中,用菠萝蛋白酶对羊毛进行防缩处理,可实现“机可洗”的目的,但作用时间较长,很难实现连续化处理[5-6]。
本文研究的生物酶协同催化体系以蛋白酶(ECOSHINE enzyme 680)与活化剂(ECOSHINE activator 670)为主体构成,通过多次浸轧协同催化体系处理液,可实现羊毛纤维的连续化无氯防缩处理。
1 实验部分
1.1 材料与仪器
毛条,江苏常熟市新光毛条处理有限公司提供;活化剂,ECOSHINE activator 670,天津绿源天美科技有限公司,工业级;生物酶,ECOSHINE enzyme 680,天津绿源天美科技有限公司,工业级;福林试剂,北京朗科百联生物技术有限公司,分析纯;无水碳酸钠、三氯乙酸、四硼酸钠,天津市盛鑫伟业化工有限公司,分析纯。溴水,天津赛孚瑞科技有限公司,分析纯;JFC、柔软剂,江苏常熟新光毛条处理有限公司,工业级。
水浴锅,天津市中环实验电炉有限公司;分析天平,北京朗科兴业称重设备有限公司;烘箱,上海和晟仪器有限公司;HITACHI L-880型氨基酸分析仪,日立高新技术有限公司;X射线光电子能谱仪,英国VG公司;紫外可见分光光度计,美国PERKIN ELMER公司;分光光度计,上海美谱达仪器有限公司;Hitachi S4800型扫描电子显微镜,日立公司。
1.2 试样处理
预浸:将羊毛毛条在50 ℃的JFC(1 g/L)溶液中处理30 s。
连续浸轧处理工艺:浸泡30 s(活化剂,生物酶,在一定温度、pH值和浴比条件下)→轧液→连续浸轧n次→水洗→酶灭活(80 ℃)→柔软处理(1 g/L)→烘干。
1.3 蛋白酶活力测试
按照SB/T 10317—1999《蛋白酶活力测定法》制备参比样及平行样,测试其吸光度,求取平行样的平均值,按下式计算蛋白酶活力:
式中:A为平均吸光度值;N为样品的稀释倍数。
1.4 活化剂反应速率测试
一定浓度范围内,氧化还原电位与活化剂含量可通过线性回归作出标准曲线。根据电位变化间接反映活化剂变化,由下式计算反应速率:
式中:v为活化剂的反应速率,g/min;t为反应时间,min;ΔC为活化剂的质量浓度变化量,g/L。
1.5 减量率测试
取一定质量的羊毛纤维,在温度为105 ℃条件下烘干至恒态质量,记录质量值为m0;按照1.2处理工艺对其处理,同样条件下烘至恒态质量,记录质量值为m。按下式计算减量率:
1.6 紫外分析
取5 mL羊毛处理液,在转速为14 000 r/min的条件下离心处理15 min,以未处理羊毛的空白处理液为参比,利用UV-2802S型紫外可见分光光度计在190~320 nm波段内对其扫描,绘制吸光度波谱图。
1.7 单纤维断裂强力和伸长率测试
根据GB/T 4711—1984《羊毛单纤维断裂强力和伸长试验方法》,将试样在标准条件下平衡24 h,每个试样抽取50根纤维,通过电子纤维强力仪测试其断裂强力及断裂伸长率,求取平均值。
1.8 羊毛表面鳞片形态观察
将纤维制样后镀金,放在Hitachi S4800型扫描电子显微镜下进行观察,放大倍数为3 000。
1.9 上染率测定
每隔2 min取1次染液,利用分光光度计测试其吸光度值,并记录。上染百分率Rd按下式计算:
式中:A0为原始染液的吸光度值;A1为取样染液的吸光度值。
1.10 氨基酸测试
采用氨基酸分析仪分别检测未处理、单纯活化剂处理及协同催化体系处理羊毛样品的氨基酸种类与含量,并作对比。
1.11 阿尔瓦登(Allworden)反应
每个试样抽取几根纤维放置在载玻片上,将饱和溴水滴在羊毛上,从盖玻片的一端开始缓慢放置盖玻片,避免气泡出现,放置20 min后,在光学显微镜下观察并拍照,放大倍数为1 000。
1.12 元素分析
分别制取不同处理方式后的羊毛纤维样品,利用X射线光电子能谱仪进行测试,激发源为Al靶Kα射线(1486.6 eV),电压为15 kV,功率为300 W。
2 结果与讨论
2.1 生物酶协同催化体系的建立
将由活化剂(ECOSHINE activator 670)和生物酶(ECOSHINE enzyme 680)作为主要有效成分的处理液定义为生物酶协同催化体系。该体系中ECOSHINE activator 670是一种弱碱性试剂,具有一定的还原性,在特定条件下可将羊毛鳞片层中的二硫键还原,随着胱氨酸转化成半胱氨酸,坚硬的鳞片层变得相对疏松,有利于增加生物酶的反应可及区域,提高其作用效率[6]。而伴随着ECOSHINE enzyme 680作用的不断深入,也促进了活化剂的作用范围和程度。二者协同作用大大增强了蛋白酶的水解催化效果。
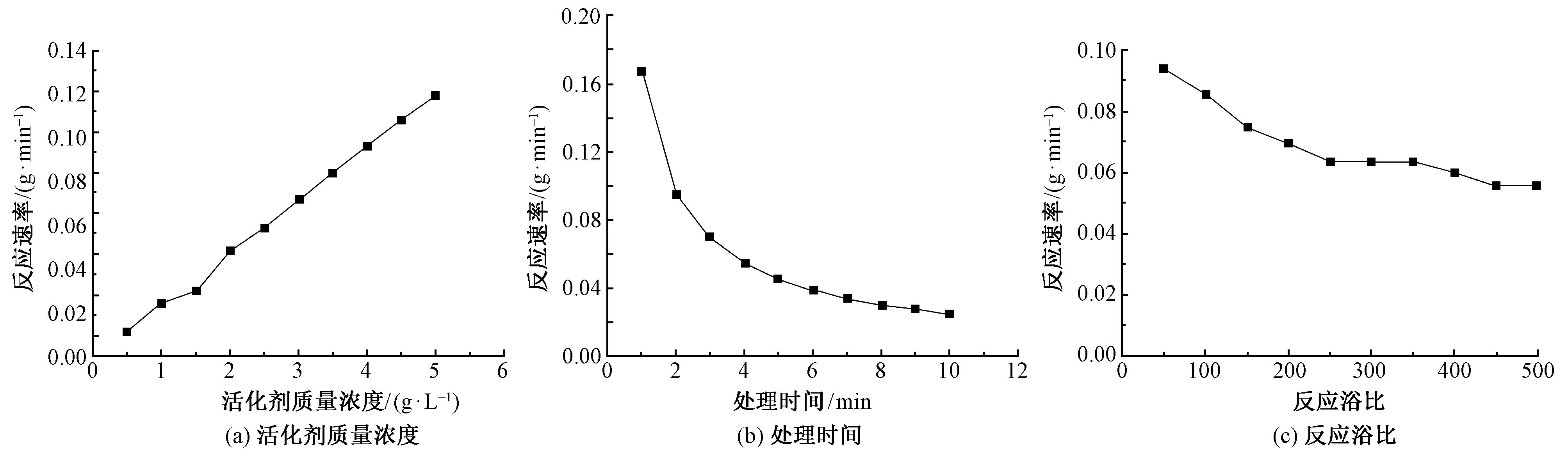
图3 各因素对活化剂反应速率的影响Fig.3 Influence of various factors on reaction rate of activator. (a)Concentration;(b)Time;(c)Bath ratio
2.1.1pH值对蛋白酶活力的影响
在pH值为7.0~10的范围内,设置梯度为0.5配制缓冲溶液,利用不同pH值的缓冲溶液来配制ECOSHINE enzyme 680待测液,根据测试结果绘制pH值与酶相对活力曲线,结果如图1所示。

图1 pH值对ECOSHINE enzyme 680活力的影响Fig.1 Influence of pH on activity of ECOSHINE enzyme 680
由图1可知,蛋白酶活力与pH值关系曲线呈单峰形式。当pH值小于9.5时,随着pH值的增大ECOSHINE enzyme 680的相对活力不断提高;pH值超过9.5后,随着pH值的增大,活力开始降低:因此,根据pH值与酶相对活力曲线可得出ECOSHINE enzyme 680的最适反应pH值为9.5。
2.1.2温度对蛋白酶活力的影响
将待测酶液调至最适pH值9.5,在反应温度为35~65 ℃之间,设置梯度为5 ℃,测试不同温度条件下ECOSHINE enzyme 680的相对活力,根据测试结果绘制温度与酶相对活力曲线,结果见图2。
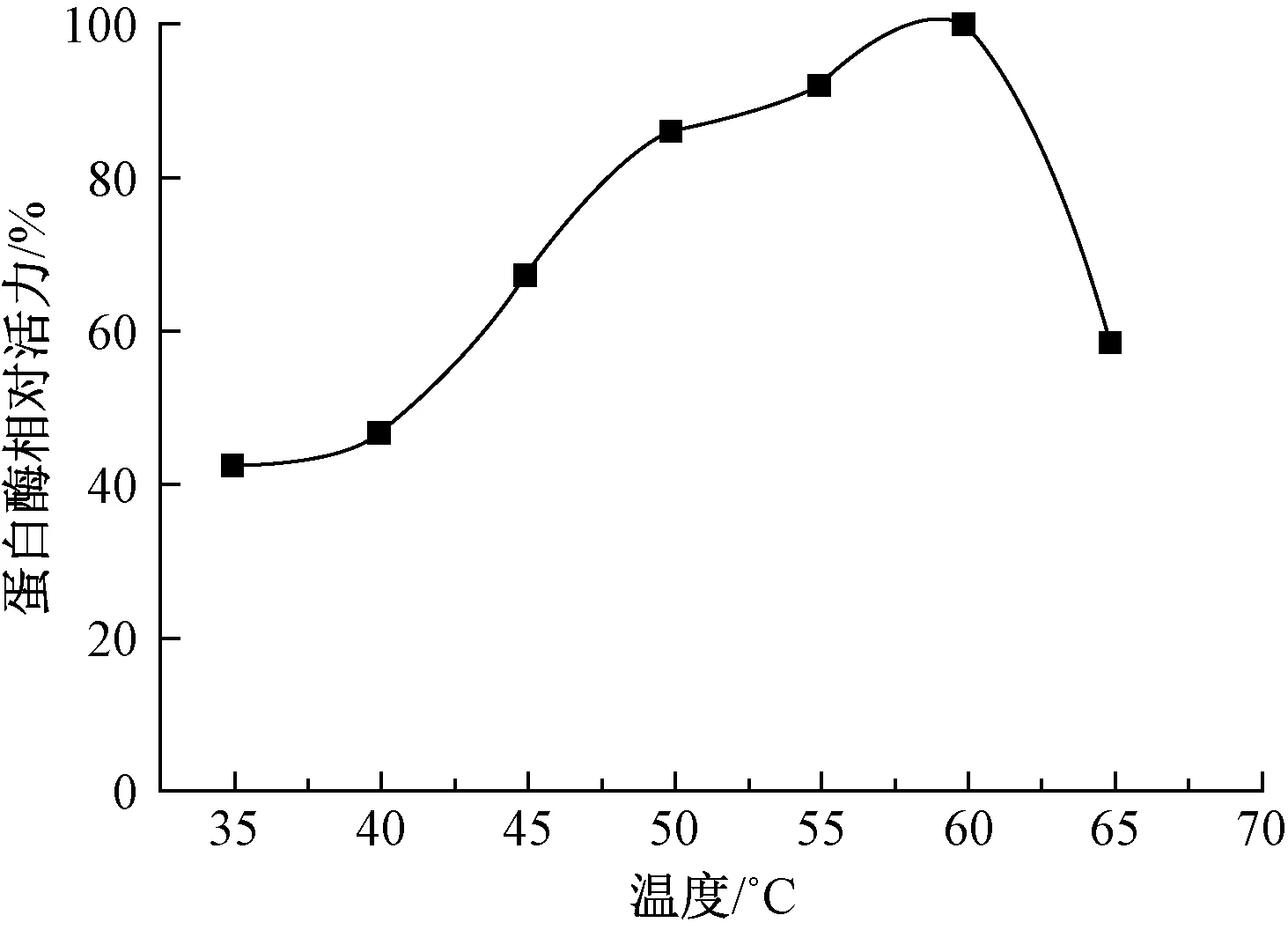
图2 温度对ECOSHINE enzyme 680活力的影响Fig.2 Influence of temperature on activity of ECOSHINE enzyme 680
由图2可看出,反应温度对ECOSHINE enzyme 680活力的影响与pH值的影响相近,均呈现单峰形式。在60 ℃以下,随着反应温度的升高,ECOSHINE enzyme 680的相对活力不断增大;温度超过60 ℃后,随着反应温度的升高,活力迅速降低,因此,根据温度与酶相对活力曲线图可得出ECOSHINE enzyme 680的最适反应温度为60 ℃。
2.1.3各因素对活化剂反应速率的影响
图3示出协同催化体系中活化剂浓度、处理时间与反应浴比对活化剂反应速率的影响。
图3(a)示出活化剂质量浓度对反应速率的影响。可以看出,在0.5~5 g/L的质量浓度范围内,随着ECOSHINE activator 670质量浓度的升高,ECOSHINE activator 670与羊毛的反应速率不断增大,二者近似呈线性关系。这是由于浓度增大,处理液中ECOSHINE activator 670分子数量不断增加,与反应物碰撞的机会不断增加。
图3(b)示出处理时间对反应速率的影响。可以看出,在反应时间为1~10 min时,随着ECOSHINE activator 670与纤维作用时间的延长,ECOSHINE activator 670的消耗速率先急剧降低后变缓慢,说明活化剂与羊毛的反应非常快速,适用于连续化加工;但是由于短时间内消耗较大,在连续化工艺设计中要注意随着反应时间的延长不断补加试剂。
图3(c)示出反应浴比对反应速率的影响。可以看出,随着羊毛对处理液浴比的增大,ECOSHINE activator 670的反应速率先快速下降,然后变得相对缓慢,说明浴比越大越容易使反应速率趋于稳定,越有助于处理前后的均匀性与稳定性[5]。综上所述,为了达到良好的处理效果,需要对各因素进行必要的控制。
2.1.4生物酶在协同催化体系中的有效性
在2.1.1、2.1.2节中已测得了蛋白酶的最佳反应温度和pH值,但生物酶协同催化体系由生物酶与活化剂组成,活化剂为一种有机试剂,为了证实生物酶在协同催化体系中的有效性,需对一浴中的蛋白酶活力进行研究,将单独蛋白酶和协同催化体系处理液分别在室温和50 ℃下放置1~4 h,按1.3节中的方法测试其蛋白酶活力,结果如表1所示。

表1 不同条件下的蛋白酶活力Tab.1 Protease activity under different conditions
由表1看出,在2种不同温度(常温与50 ℃)条件下,单独ECOSHINE enzyme 680溶液与协同催化体系中酶的活力十分接近,变化在正常误差范围内。结果表明,ECOSHINE activator 670对生物酶ECOSHINE enzyme 680无抑制作用,证实了生物酶在协同催化体系中的有效性[5]。
2.2 协同催化体系的快速有效性
2.2.1减量率
减量率可以用来间接表征生物酶作用的有效性与快速性[7]。将单纯活化剂(ECOSHINE activator 670)、单纯蛋白酶(ECOSHINE enzyme 680)及协同催化体系处理羊毛后的减量率做对比,结果见表2。

表2 不同方式处理后羊毛纤维的减量率
由表2看出:随着处理时间的延长,羊毛的减量率均不断增加,但这3种处理方式的减量程度相差较大;相同处理条件下,相比于协同催化体系,经单纯活化剂(ECOSHINE activator 670)、单纯蛋白酶(ECOSHINE enzyme 680)处理后,羊毛的减量率变化不大,约占协同催化体系减量率的40%,同时,短时间的快速减量也体现出协同催化体系的快速有效性。
2.2.2处理液中蛋白含量
蛋白酶对羊毛角蛋白水解时,可将羊毛中的部分大分子链分解为多肽及氨基酸。采用紫外可见分光光度计扫描分析,通过特定吸收峰(280 nm左右)的强度可间接表征处理液中蛋白质的相对浓度[8],测试结果如图4所示。

图4 不同处理方式下蛋白水解液的紫外扫描谱图Fig.4 UV spectra of protease hydrolyte solution with different treatments
从图4看出,在280 nm左右处均出现吸收峰,且3种处理液的吸收峰大小为协同催化体系>>单纯蛋白酶ECOSHINE enzyme 680>单纯活化剂ECOSHINE activator 670;因此,协同催化体系中活化剂、蛋白酶的相互协同作用明显促进了羊毛纤维蛋白的水解速度。
2.2.3力学性能
经协同催化体系处理后,羊毛纤维的鳞片层受到了破坏,因此,其力学性能会受到一定程度的影响。实验测得原毛的断裂强力为7.12 cN,断裂伸长为4.38 mm;生物酶协同催化体系处理羊毛纤维的断裂强力为5.96 cN,断裂伸长为3.59 mm。可见,相较于原毛,经过生物酶协同催化体系处理后纤维的断裂强力下降了16.3%左右,断裂伸长下降了18%左右。经过生物酶协同催化体系处理后羊毛纤维的力学性能出现了一定程度的下降,但在可接受范围内。
2.2.4羊毛纤维表面鳞片状态的变化
图5示出经不同工艺处理后羊毛纤维的扫描电镜照片。可以看出:原毛的鳞片层保存完整,鳞片尖角清晰可见;经单纯ECOSHINE activator 670溶液处理后纤维的鳞片层并未发生显著变化,只是尖角出现稍微翘起的现象,但鳞片的完整性未受到破坏;经单纯ECOSHINE enzyme 680处理后纤维表面的鳞片层与原毛完全一样,且并未出现图5(b)边缘翘起的现象;经过生物酶协同催化体系处理后,纤维鳞片层的完整性已被大幅度破坏,纤维表面只保留少量鳞片残余,相较于氯化防缩处理,生物酶协同催化体系的剥鳞效果更显著。

图5 不同工艺处理后羊毛纤维的扫描电镜照片(×3 000)Fig.5 SEM images of wool fiber after different treatments (×3 000).(a) Raw wool;(b) Simple activator treatment;(c) Simple protease treatment;(d) Biological enzyme synergistic catalytic system treatment;(e) Chlorination treatment
2.3 生物酶协同催化体系作用机制研究
2.3.1染色性能分析
在羊毛纤维染色过程中,纤维表面致密的鳞片层会阻碍染料分子向纤维内部扩散和渗透,因此,通过研究羊毛的染色性能变化情况,可以间接反映羊毛纤维表面鳞片层的状态变化[9]。
图6示出不同处理方式的上染率曲线。可以看出:相较于未经处理的原毛,经氯化处理及协同催化体系处理后,羊毛纤维的染色速率及上染百分率均有了较大提高,且二者上染率曲线十分接近;经单纯活化剂处理后,羊毛的染色性能也得到了一定程度的改善,但相较于生物酶协同催化体系还有一定差距;单纯经蛋白酶处理后羊毛的上染率基本未发生改善,而且出现了略微下降。

图6 不同处理方式的上染率曲线Fig.6 Dyeing rate curves of different treatments
羊毛纤维的染色性能与纤维的鳞片层结构有较大关系。单纯蛋白酶在短时间内很难与角质化的鳞片层反应,因而染料扩散的障碍依然存在;同时蛋白酶自身也占据了染料扩散的通道:所以单纯蛋白酶处理后纤维的染色性能略有下降。单纯活化剂处理的羊毛纤维可将鳞片层中部分二硫键打开(见氨基酸分析中胱氨酸含量的变化),断开了大分子间的相互交联,使致密的鳞片层变得相对疏松,增大了染料进出的通道,但鳞片层依然存在(见图5)。生物酶协同催化体系中蛋白酶与活化剂相互协同催化,导致纤维表面的鳞片被大量剥除,使染料扩散的阻碍减小,同时纤维的吸湿膨胀性提高,使染料进出的通道变大,所以纤维的染色性能出现大幅度提升。
2.3.2氨基酸分析
将原毛、活化剂处理及协同催化体系处理后的纤维分别进行氨基酸分析,部分测试结果如表3所示。通过对比测试结果可初步推断羊毛纤维的变化。
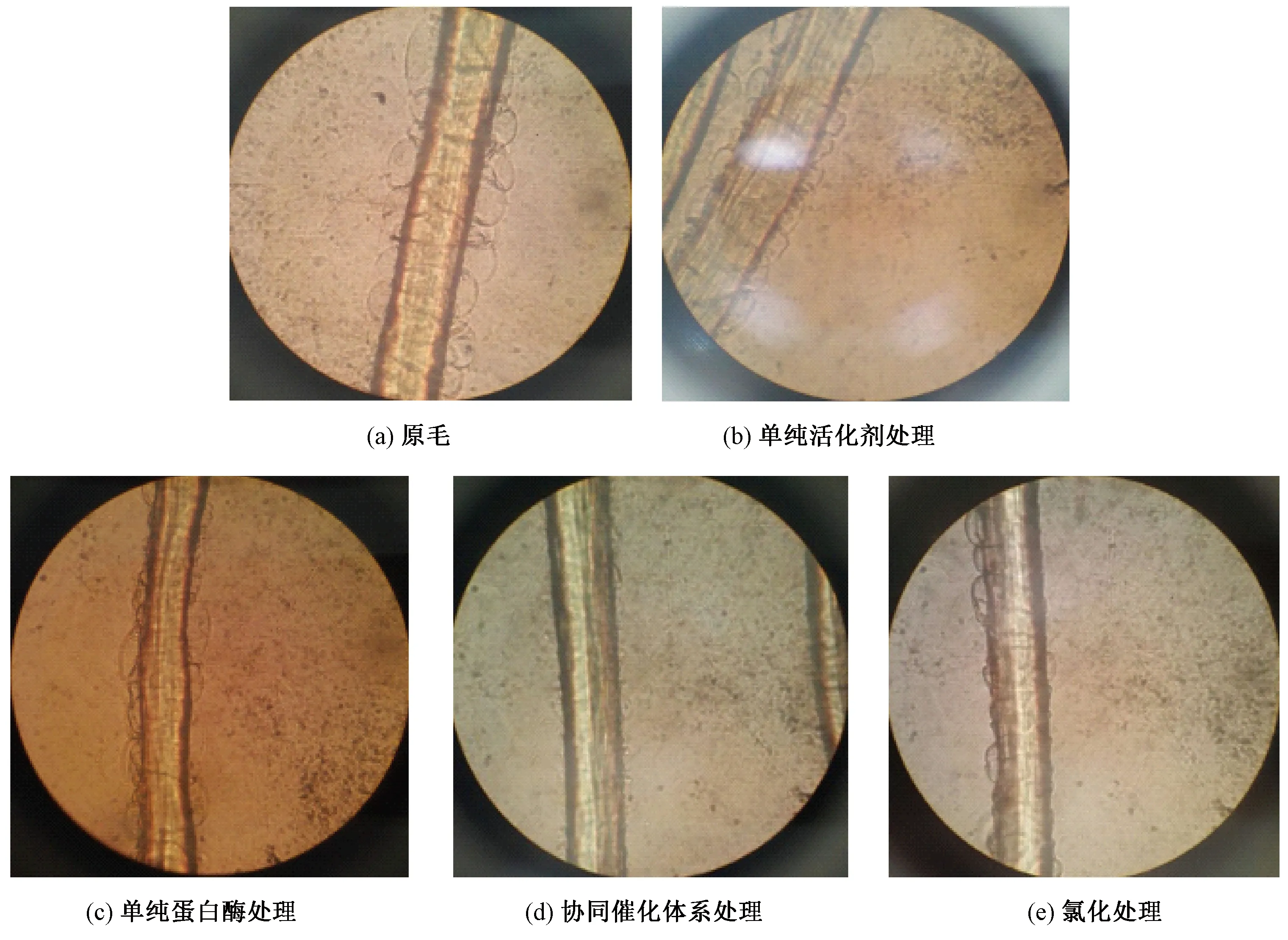
图7 不同处理方式后的Allworden反应Fig.7 Allworden reaction of different treatments.(a) Raw wool;(b) Simple protease treatment;(c)Simple activator treatment;(d) Biological enzyme synergistic catalytic system treatment;(e) Chlorination treatment
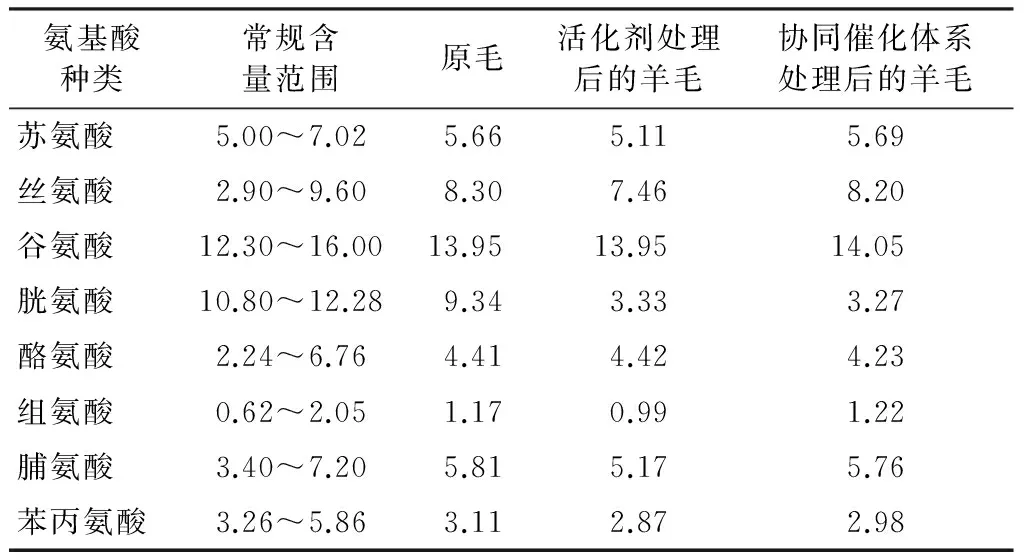
表3 氨基酸分析的部分结果Tab.3 Partial results of amino acid analysis %
注:其他氨基酸含量变化不大,故未全部列出。
由表3可知,无论是单纯活化剂处理还是协同催化体系处理,羊毛的胱氨酸含量均出现明显的下降(相比于原毛下降了65%左右),而其他氨基酸含量基本未发生变化,因此,活化剂ECOSHINE activator 670对胱氨酸的反应有很强的选择性,可将胱氨酸中键能很强的二硫键打开。
2.3.3阿尔瓦登(Allworden)反应分析
Allworden反应是判断羊毛纤维鳞片层完整状况的最好依据。测试结果如图7所示。可以看出,原毛纤维表面整齐的排列着一层密而大的气泡,出现了明显的Allworden反应。单纯生物酶ECOSHINE enzyme 680处理后,相比于原毛表面的气泡仍很多,未发生大的变化。上述现象说明,纤维的鳞片表面保存完整,其中的酰胺键、二硫键等仍保存完好。图7(c)与图7(a)、(b)相比,羊毛纤维表面的气泡变得少而疏,这说明羊毛表面已部分受损,其中的二硫键部分被打开,但酰胺键未受破坏(这在SEM照片及氨基酸分析中得到佐证)。图7(d)中纤维的表面基本看不到气泡,但氯化处理后表面仍保留少量气泡(如图7(e)所示)。这种现象表明,协同催化体系可完全破坏纤维表面的二硫键及酰胺键,而且这种破坏程度可超过传统的氯化处理方法。
2.3.4羊毛纤维表面化学成分分析

图8 羊毛纤维的XPS分析谱图Fig.8 Analysis spectra of wool fiber.(a) Raw wool;(b) Simple activator treatment; (c) Biological enzyme synergistic catalytic system treatment; (d) Chlorination treatment
XPS 分析深度为 0.5~5.0 nm,可较准确地反映羊毛鳞片表面化学结构的微量变化。图8示出不同工艺处理后的XPS谱图。由图可知,4个XPS分析谱图的总体形状相似,在相同的位置均出现了4个特征峰(C1s峰、O1s峰、N1s峰、S2p峰),上述现象说明,相比于原毛,经3种不同方式处理后纤维表面的元素种类并未发生变化,都含有碳、氮、氧与硫等元素。
不同方式处理后纤维表面 C1s、O1s、N1s、S2p的相对元素含量结果如表4所示。

表4 不同处理方式后的表面元素含量Tab.4 Surface element content of different treatments
从表4可看出,4组试样中原毛表面的C元素含量最高,且C、N含量比也比其他3组试样高出很多。这种现象表明原毛的表面覆盖了一层类脂物。经生物酶协同催化体系处理、氯化防缩处理后,相比于原毛C含量降低,N含量大幅增加,C、N含量比也明显降低。这说明纤维表面的C含量很高的类脂层已被去除,纤维中N含量相对高的蛋白肽链或鳞片层蛋白暴露在纤维表面[11]。
从4组试样的O元素含量变化可知,经生物酶协同催化体系处理后,O元素含量略有下降,氯化防缩处理增加了6.3%。产生上述现象的原因是生物酶协同催化体系处理是将二硫键还原打开转变成巯基(—SH);而氯化防缩处理是将表面的部分基团氧化,使其变成—SO3H。
从4组试样的S元素含量的变化可看出:相较于未经处理的原毛,无论生物酶协同催化体系处理,还是氯化防缩处理,S元素含量都出现了大幅下降,分别下降37.7%和52.4%;但单纯活化剂处理后S元素含量并未出现下降。这是由于防缩处理导致鳞片层被剥除,而胱氨酸占鳞片外层氨基酸含量的33%,且鳞片外层又是整个纤维中胱氨酸含量最高的部分;因此,随着纤维鳞片层的去除,胱氨酸含量出现大幅下降。单纯活化剂只是将二硫键打开,而没有蛋白酶的参与,致密坚硬的鳞片层只是变得相对疏松而并没有剥离(这在染色性能及氨基酸分析中可得到验证)。
为进一步研究S元素含量的变化,图9示出不同处理工艺中S2p的波谱图。二硫键(—S—S—)的吸收峰对应的结合能为163.91 eV,硫的氧化物(—SOx)的吸收峰对应的结合能为168.50 eV[12]。
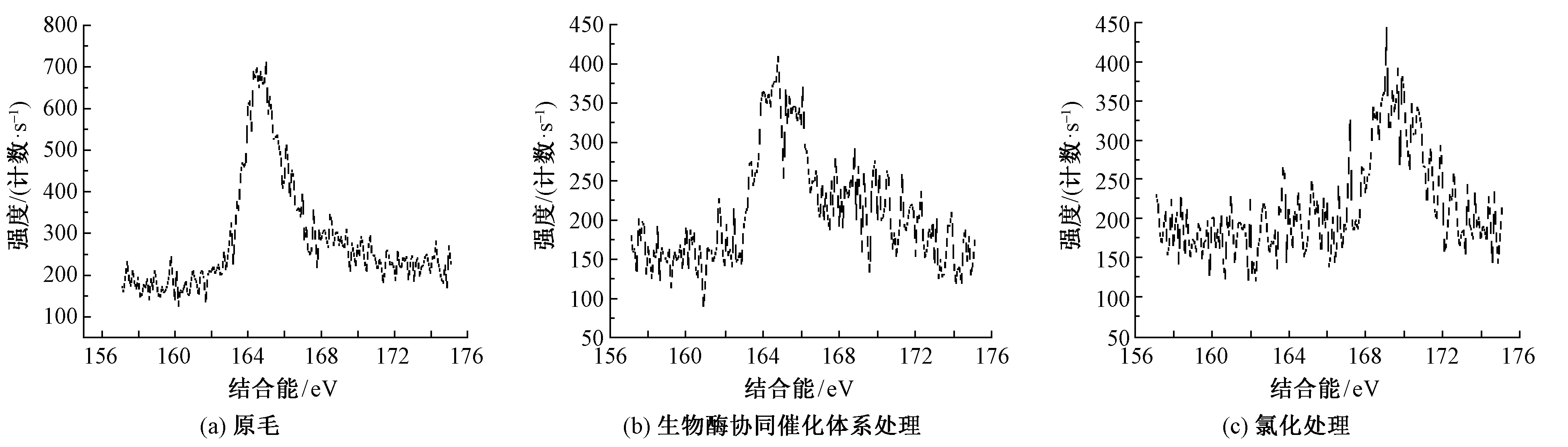
图9 XPS分析中S2p波谱图Fig.9 Spectra of S2p in XPS.(a) Raw wool;(b) Biological enzyme synergistic catalytic system treatment;(c) Chlorination treatment
由图9可看出,在157~175 eV范围内,3种试样均出现了吸收峰。原毛的吸收峰为二硫键(对应结合能为164 eV附近),氯化防缩处理后试样对应的吸收峰为硫的氧化物(对应结合能为169 eV附近);但协同催化体系与上述2个试样的吸收峰有很大差异,在此范围内出现了2个吸收峰。这说明图9(b)中存在2种形式的硫元素:一部分可能是以被还原成的—SH形式存在;而另一部分仍以二硫键形式存在。
3 结 论
1)通过测定ECOSHINE enzyme 680蛋白酶活力,确定生物酶协同催化体系的最适温度为60 ℃,最适pH值为9.5;以活化剂反应速率为评价标准,探究了活化剂浓度、温度及浴比对生物酶协同催化体系中活化剂的影响;将单纯生物酶的酶活与生物酶协同催化体系的酶活进行对比,证实了协同催化体系的有效性。
2)将单纯蛋白酶、单纯活化剂处理与生物酶协同催化体系处理后的减量率、处理液蛋白含量及表面鳞片形态作对比可看出,生物酶协同催化体系可快速将羊毛纤维的鳞片部分甚至全部去除。
3)通过染色性能测试、氨基酸分析、Allworden反应及X射线光电子能谱分析,初步证明生物酶协同催化体系中生物酶与活化剂在羊毛处理中的协同作用机制。活化剂作用于二硫键使致密的鳞片变得相对疏松,生物酶作用于酰胺键使蛋白大分子发生水解;同时,活化剂与生物酶共浴时,互不干扰,相互协同促进,最终达到快速去除鳞片的作用。
[1] 张冰,张弛,肖升木,等. 改性蛋白酶的制备及其在羊毛防毡缩整理中的应用[J]. 纺织学报,2012,33(5): 74-80.
ZHANG Bing, ZHANG Chi,XIAO Shengmu,et al.Preparation of modified protease and its application on antifelting finishing of wool[J].Journal of Textile Research,2012,33(5):74-80.
[2] 周雯,纪惠军,王强,等. 角蛋白酶对羊毛蛋白酶防毡缩整理的促进作用[J]. 纺织学报,2011,32(1): 82-88.
ZHOU Wen,JI Huijun,WANG Qiang,et al.Promoting effect of keratinase in wool anti-felting finishing with protease[J].Journal of Textile Research,2011,32(1):82-88.
[3] 董立,张健飞,徐磊. 碱性蛋白酶对拉伸细化羊毛纤维性能的改善[J]. 纺织学报,2009,30(2):65-69.
DONG Li,ZHANG Jianfei,XU Lei.Improvement on the properties of slenderized wool fibers by alkaline protease treatment[J].Journal of Textile Research,2009,30(2):65-69.
[4] KAUR A, CHAKRABORTY J N.Controlled eco-friendly shrink-resist finishing of wool using bromelain[J].Journal of Cleaner Production,2015(108):503-513.
[5] WANG Le,YAO Jinbo,LIU Jianyong,et al.Study on rapid wool shrinkproof method based on protease treatment[J].Key Engineering Materials,2015(671):324-330.
[6] YIN Xiumei,LIU Jianyong,YAO Jinbo,et al.Application of synergetic protease catalytic system in wool treat-ment[J].Key Engineering Materials,2015(671):19-24.
[7] SCHROEDER M,SCHWEITZER M,LENTING H B M,et al.Chemical modification of proteases for wool cuticle scale removal[J].Biocatalysis and Biotransformation,2004,56(22):299-305.
[8] 胡生荣,纪惠军,王强,等.羊毛DCCA-蛋白酶法防毡缩工艺的改进[J].纺织学报,2010,31(12): 64-69.
HU Shengrong, JI Huijun, WANG Qiang, et al.Improving DCCA-protease process for antifelting of wool[J].Journal of Textile Research,2010,31(12):64-69.
[9] 王隆隆,刘建勇,张伟民,等. TCEP在CE型染料羊毛低温染色中的应用研究[J]. 毛纺科技,2014(10):18-21.
WANG Longlong,LIU Jianyong,ZHANG Weimin,et al.Research of application of TCEP in low temperature dyeing with CE series dyes of wool[J].Wool Textile Journal,2014(10):18-21.
[10] 王平.羊毛表面生物酶改性及机制研究[D].上海: 东华大学,2010:29-30.
WANG Ping.Enzymatic modification of wool surface and its mechanism[D].Shanghai:Donghua University,2010:29-30.
[11] 王平,王强,崔莉,等. Savinase和木瓜蛋白酶处理对羊毛性能的影响[J]. 纺织学报,2011,32(9):74-78.
WANG Ping,WANG Qiang,CUI Li,et al.Effects of enzymatic treatment with savinase and papain on wool properties[J].Journal of Textile Research,2011,32(9):74-78.
[12] 王灿灿.高锰酸钾处理对羊毛与山羊绒结构性能的影响差异[D].西安: 西安工程大学,2013:23-24.
WANG Cancan.The influence of KMnO4treating on the structure and properties of wool and cashmere fibers[D].Xi′an:Xi′an Polytechnic University,2013:23-24.
