甲巯咪唑治疗Graves病甲状腺功能亢进症患者前后血清ZAG水平的变化*
2018-01-29邓晶荣孟凡萍
邓晶荣,郝 坡△,孟凡萍
(1.重庆三峡医药高等专科学校医学技术系 404020;2.重庆三峡中心医院检验科 404000)
Graves病(Graves′ disease,GD)是一种常见的器官特异性自身免疫性甲状腺疾病。GD是原发性甲状腺功能亢进症中最常见及最主要的一种,约占所有甲状腺功能亢进症的85%,其发病率约1%~2%,近年来呈逐年增高趋势[1]。甲状腺的健康问题已成为医学界关注的重点,但关于其具体发病机制尚未明确。目前抗甲状腺药物是甲状腺功能亢进症的主要治疗方式之一。
锌-α2-糖蛋白(Zinc-α2-glycoprotein,ZAG)是一种相对分子质量为41×103的可溶性糖蛋白,可由肝、脂肪组织等分泌[2]。ZAG作为新发现的细胞因子,具有提高胰岛素敏感性、改善胰岛素抵抗、促进机体脂质分解、增强机体能量消耗及降低体质量等作用[3-5]。众所周知,高代谢症候群、基础代谢率增加及体质量降低是GD的主要临床特征,且GD患者治疗前后往往伴随着血清中众多细胞因子的变化[1,6]。然而,关于ZAG在GD病理生理发展过程中的作用尚无相关报道。因此,本研究对初发GD患者血清ZAG浓度及GD病甲状腺功能亢进症患者抗甲状腺药物治疗前后血清ZAG水平的变化进行测定,并进一步分析ZAG与甲状腺功能、血脂的关联关系,为GD的发病机制及其临床治疗提供一定的实验基础。
1 资料与方法
1.1一般资料 选取重庆三峡中心医院内分泌科2014年 12月至2015年11月新发未治疗的 GD 甲状腺功能亢进症(浸润性突眼除外)患者54例为新发GD人群(nGD组),其中男21 例,女 33例,平均年龄(41±13)岁,诊断依据为《中国甲状腺疾病诊治指南》的Graves诊断标准。所有患者于治疗前及甲巯咪唑(methimazol,MMI) 治疗(口服他巴唑 20~40 mg/d,根据患者症状临床体征和甲状腺功能逐渐减量)12周后分别检测血清甲状腺功能激素[促甲状腺素(TSH)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、总三碘甲状腺原氨酸(TT3)、总甲状腺素(TT4)]、甲状腺素相关自身抗体[包括抗甲状腺球蛋白抗体(TGAb)、抗甲状腺髓过氧化物酶抗体(TPO)和促甲状腺素受体抗体(TRAb)]。同时设年龄和性别相匹配的健康体检者62例为健康人群(NC组),其中男28例,女34例,平均年龄(42±9)岁,均无甲状腺疾病史,无甲状腺肿大,甲状腺功能正常且上述自身抗体阴性的门诊患者作为对照组。所有患者均无病毒性肝炎、1型糖尿病、传染性疾病及其他自身免疫病史。排除严重心肺肝脾肾疾病、肿瘤、中枢神经系统疾病、血管性疾病及对MMI不能耐受者。所有受检对象均知情同意。
1.2方法 所有受检者均空腹8~12 h后,于第2天清晨取肘正中静脉血,4 ℃低温4 000 r/min离心分离血清后分为3份,其中1份即时测定甲状腺功能和甲状腺相关自身抗体;1份用于测定三酰甘油(TG)、总胆固醇(TC)、游离脂肪酸(FFA)、低密度脂蛋白-胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C);1份保存于-80 ℃冰箱以待批量检测ZAG浓度。其中TSH、FT3、FT4、TT3、TT4、TGAb、TPO和 TRAb均采用电化学发光法检测(Roche Cobas 601,瑞士),血脂均采用酶法检测(HighTachi 7020,日本),血清ZAG水平利用ELISA法原理,严格按照试剂盒说明书进行操作(武汉优而生科技股份有限公司,中国)。其中ELISA试剂盒抗体为特异的兔抗人ZAG单克隆抗体,与脂联素、血浆胰岛素、抵抗素等肽类激素无交叉反应。最低检测限为1.9 ng/mL;线性范围为 4.69~300.00 ng/mL;批内变异系数(CV)<10%,批间CV<12%。
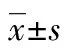
2 结 果
2.1两组甲状腺功能、甲状腺相关自身抗体、血脂水平及血清ZAG水平的比较 与NC组相比较,nGD组FFA、TC、TG、HDL-C、LDL-C、TSH均明显降低(P<0.05),而FT3、FT4、TT3、TT4、TGAb、TPO、TRAb及ZAG明显高于NC组(P<0.05),两组间年龄比较差异无统计学意义(P>0.05),见表1。
2.2nGD组患者经 MMI 治疗前后甲状腺功能、甲状腺相关自身抗体、血脂水平及血清ZAG水平的比较 nGD组患者经 MMI治疗12周后TC、TG、HDL-C、LDL-C、TSH均明显升高(P<0.05),与治疗前相比较,FT3、FT4、TT3、TT4、TRAb及ZAG均显著降低(P<0.05),而治疗前后两组间TGAb、TPO及FFA差异无统计学意义(P>0.05),见表2。
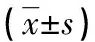
表1 各组人群实验室指标
a:P<0.05,与NC组比较
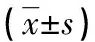
表2 初发GD人群MMI治疗前后实验室指标
a:P<0.05,与治疗前比较
2.3相关性分析 线性相关分析表明:nGD组患者空腹血清ZAG水平与FT3、FT4、TT3及TT4呈正相关(r=0.613、0.796、0.646、0.570,P<0.01);而与TSH、TG、TC、FFA呈负相关(r=-0.789、-0.816、-0.547、-0.428,P<0.01)。以空腹血清ZAG浓度为应变量,以年龄、TC、TG、FFA、HDL-C、LDL-C、TSH、FT3、FT4、TT3、TT4及TRAb等为自变量进行多元线性逐步回归分析,结果表明,TSH、TG及TC分别是血浆ZAG水平的独立相关因素(回归方程为ZAG=61.864-4.28×TSH-0.897×TG-2.012×TC),见表3。
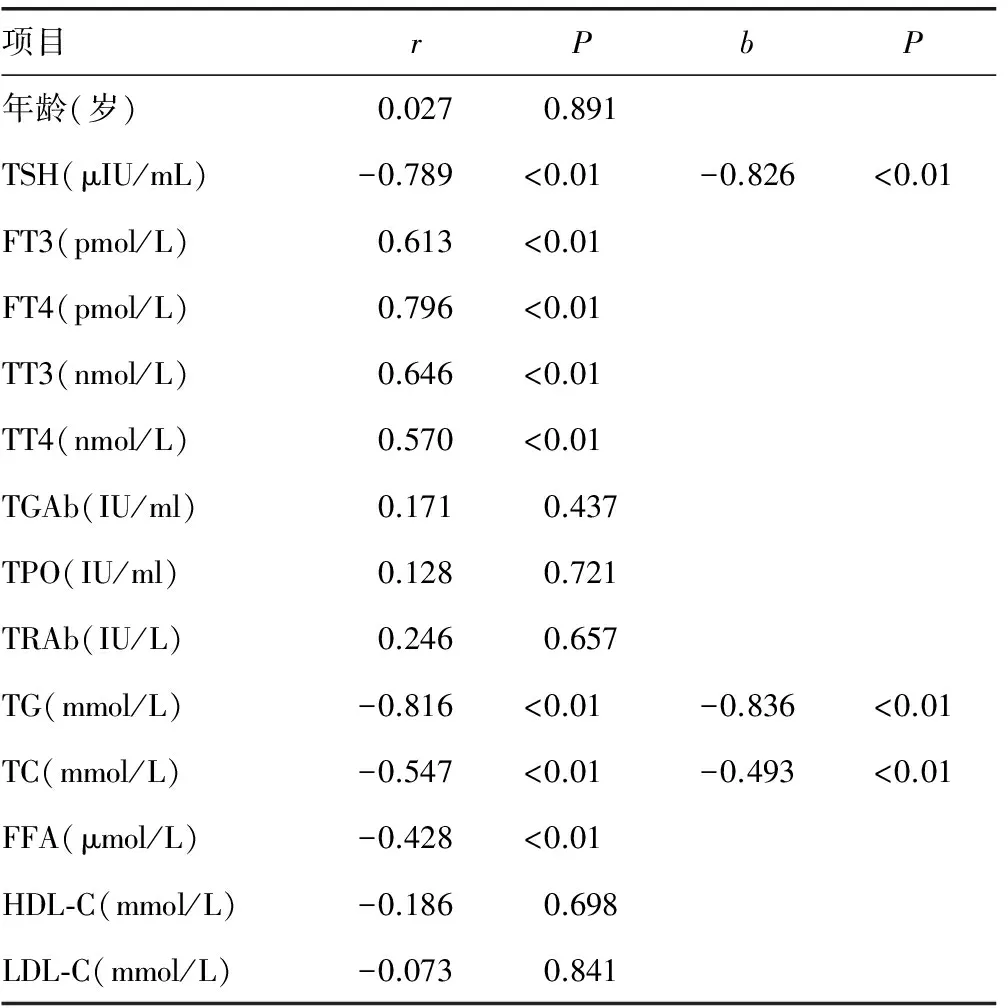
表3 nGD组患者血清ZAG与甲状腺功能、甲状腺相关自身抗体及血脂水平的相关性
3 讨 论
ZAG是1961年从人类血清中提纯获得的一种可溶的分泌性糖蛋白,主要表达于有分泌功能的上皮细胞胞质,如肝脏、胃肠道及汗腺、唾液腺、乳腺、前列腺和支气管等组织的上皮细胞[2,7]。ZAG已被证实是一种促进脂肪分解的脂解因子,具有促进脂肪分解、减轻体脂作用,在许多肿瘤组织特别是恶病质状态下高度表达[3-5,8]。近来,国内外研究表明ZAG在体内外众多病理生理过程及维持机体内环境稳态中发挥着重要的作用,如调节免疫、抑制肿瘤细胞增殖与转移、促进骨骼肌合成、提高胰岛素敏感性、抑制机体炎症等[9-11]。基础代谢率增高、血脂降低及体质量减低作为GD患者最突出的临床表现。然而,作为促脂肪分解因子,ZAG血清水平与GD的相关性尚无报道。因此,为初步阐释ZAG在GD中所发挥的作用,本研究首次通过对新发GD患者(nGD)及经MMI治疗前后新发GD患者血清ZAG浓度变化进行检测,并进一步分析ZAG与甲状腺功能、血脂水平及甲状腺相关自身抗体的相关关系。结果表明:初发GD患者人群血清ZAG水平显著高于健康对照组,这提示ZAG在GD的发生、发展过程中具有一定的作用。
GD患者高代谢症候群主要与甲状腺功能亢进、体内甲状腺激素水平升高密切相关。MMI作为GD患者的主要抗甲状腺治疗药物,通过抑制甲状腺内过氧化物酶活性,从而阻碍甲状腺素和三碘甲状腺原氨酸的合成,并且在外周抑制T4向T3的转化[12]。本研究结果显示,新发GD患者经过MMI治疗12周后,随着体内甲状腺功能的改善,血清ZAG浓度明显降低。其次,相关分析结果显示,nGD患者空腹血清ZAG水平与FT3、FT4、TT3及TT4呈正相关,而与TSH水平负相关。这进一步说明了循环中ZAG与甲状腺功能密切相关。
甲状腺激素通过调节血脂合成、转运和氧化分解等维持血脂稳态。甲状腺激素水平过高时体内脂肪储备减少,引起血浆中的TG、磷脂和TC浓度降低,而甲状腺激素含量不足时常引起血脂不同程度的升高[13-14]。与此结论一致的是,本研究结果显示GD患者血脂水平较健康人群明显降低。
近来研究显示,肥胖患者及肥胖小鼠循环ZAG浓度较正常体质量者降低,可能和体质量的调节相关[15]。注射外源性ZAG蛋白能够促进肥胖小鼠及人源性脂肪细胞TG分解,而抑制脂肪组织ZAG表达能够促进TG蓄积[16-17]。研究表明,ZAG可显著改善肥胖小鼠的糖脂代谢,可能与其抑制肝脏组织长链脂酰CoA合成酶1(ACSL1)和葡萄糖6-磷酸脱氢酶(G6P)表达、促进过氧化物酶体增殖物活化受体协同刺激因子1α(PGC-1α)和人糖原合成酶2(GYS2)表达有关[18]。虽然目前关于ZAG促进脂肪分解的机制尚不十分明确,但能够确定的是ZAG在机体脂代谢稳态中发挥着关键作用。本研究相关分析结果显示,GD患者空腹血清ZAG水平与TG、TC、FFA呈负相关,且多元线性逐步回归表明TG及TC分别是影响血浆ZAG水平的独立相关因素,这说明GD患者脂代谢紊乱可能与ZAG水平升高有关。然而,在GD患者中,甲状腺功能亢进是直接还是间接通过调节ZAG表达影响脂代谢尚不清楚,有待于后续研究深层次阐释。此外,本研究结果显示GD患者血清ZAG水平与甲状腺自身抗体TGAb、TPO及TRAb水平无相关性,说明血清ZAG可能与甲状腺自身免疫无关。然而,由于本研究受样本量及研究人群特定地域的限制,对于他们之间的具体关系需要深入研究。
总之,本研究结果初步揭示了ZAG与GD患者甲状腺功能及血脂代谢密切相关,且MMI影响ZAG分泌水平。但因样本量较小、随访时间短、研究人群分布范围狭窄等,对于ZAG在GD中的表达变化、病理生理发展过程中所发挥的调节作用及其具体机制仍需进一步研究。
[1]BURCH H B,COOPER D S.Management of graves disease:a review[J].JAMA,2015,314(23):2544-2554.
[2]BURGI W,SCHMID K.Preparation and properties of Zn-alpha 2-glycoprotein of normal human plasma[J].J Biol Chem,1961,236(3):1066-1074.
[3]BING C,BAO Y,JENKINS J,et al.Zinc-alpha2-glycoprotein,a lipid mobilizing factor,is expressed in adipocytes and is up-regulated in mice with cancer cachexia[J].Proc Natl Acad Sci U S A,2004,101(8):2500-2505.
[4]BALAZ M,VICIAN M,JANAKOVA Z,et al.Subcutaneous adipose tissue zinc-α2-glycoprotein is associated with adipose tissue and whole-body insulin sensitivity[J].Obesity(Silver Spring),2014,22(8):1821-1829.
[5]RUSSELL S T,TISDALE M J.Antidiabetic properties of zinc-alpha2-glycoprotein in ob/ob mice[J].Endocrinology,2010,151(3):948-957.
[6]ANTONELLIA,FERRARISM,CORRADOA,etal.Autoimmunethyroiddisorders[J].Autoimmun
Rev,2015,14(2):174-180.
[7]TADA T,OHKUBO I,NIWA M,et al.Immunohistochemical localization of Zn-alpha 2-glycoprotein in normal human tissues[J].J Histochem Cytochem,1991,39(9):1221-1226.
[8]RYDÉN M,AGUSTSSON T,ANDERSSON J,et al.Adipose zinc-α2-glycoprotein is a catabolic marker in cancer and noncancerous states[J].J Intern Med,2012,271(4):414-420.
[9]QU F,YING X Q,GUO W,et al.The role of Zn-alpha2 glycoprotein in sperm motility is mediated by changes in cyclic AMP[J].Reproduction,2007,134(4):569-576.
[10]DELORT L,PERRIER S,DUBOIS V,et al.Zinc-α2-glycoprotein:a proliferative factor for breast cancer? In vitro study and molecular mechanisms[J].Oncol Rep,2013,29(5):2025-2029.
[11]HASSAN M I,WAHEED A,YADAV S,et al.Zinc alpha 2-glycoprotein:a multidisciplinary protein[J].Mol Cancer Res,2008,6(6):892-906.
[13]DUNTAS L H.Thyroid disease and lipids[J].Thyroid,2002,12(4):287-293.
[14]KAROUTSOU E,POLYMERIS A.Pathogenesis of Graves′ disease focusing on Graves′ ophthalmopathy[J].Endocr Regul,2011,45(4):209-220.
[15]GONG F Y,ZHANG S J,DENG J Y,et al.Zinc-alpha2-glycoprotein is involved in regulation of body weight through inhibition of lipogenic enzymes in adipose tissue[J].Int J Obes(Lond),2009,33(9):1023-1030.
[16]WARGENT E T,O′DOWD J F,ZAIBI M S,et al.Contrasts between the effects of zinc-α2-glycoprotein,a putative β3/2-adrenoceptor agonist and the β3/2-adrenoceptor agonist BRL35135 in C57Bl/6(ob/ob) mice[J].J Endocrinol,2013,216(2):157-168.
[17]RUSSELL S T,TISDALE M J.Role of β-adrenergic receptors in the anti-obesity and anti-diabetic effects of zinc-α2-glycoprotien(ZAG)[J].Biochim Biophys Acta,2012,1821(4):590-599.
[18]刘美娟,戴宇飞,朱惠娟,等.采用基因表达谱芯片技术研究锌α2糖蛋白对肥胖小鼠肝脏基因表达的影响[J].中华糖尿病杂志,2016,8(6):361-366.
