阿托伐他汀对K562细胞的抗增殖作用及凋亡作用的研究
2018-01-29孔春芳周江龙丁伟荣丁江华陈国安程洪波金成豪
孔春芳,周江龙,丁伟荣,丁江华,陈国安,程洪波,金成豪
(1.江西省人民医院,南昌 330006;2.江西省南昌市第三医院 330006;3.南昌大学第一附属医院 330006)
慢性髓系白血病(chronic myeloid leukemia,CML)是一种发生在多能造血干细胞的恶性骨髓增殖性疾病,目前,CML急变患者治疗效果仍较差,探索对CML急变期有效的新型药物很有必要。他汀类药物是一类3-羟基-3-甲基戊二酰辅酶A还原酶抑制剂,主要用于预防和治疗心脑血管疾病。近期研究证实:他汀类药物对多种实体肿瘤具有抗癌作用[1]。作为第三代他汀类代表,阿托伐他汀临床应用非常广泛。有研究发现,阿托伐他汀等可影响K562细胞的增殖,但具体机制尚不清楚[2]。因此,本研究以K562细胞系为实验对象,探讨阿托伐他汀对其的作用及机制,旨在为阿托伐他汀临床治疗CML急变提供实验依据。
1 材料与方法
1.1材料 人CML急变期细胞系K562细胞由南昌大学第一附属医院血液科实验室提供。主要实验试剂包括:阿托伐他汀、RNA酶(RNAase)、碘化丙啶(PI)均购自美国Sigma公司,CCK-8试剂盒(日本同仁化学研究所),AnnexinV-FITC/PI试剂盒(美国BD公司),半胱氨酸蛋白水解酶(caspase)-3、-8、-9活性测定试剂盒(碧云天公司),RNA提取试剂盒(Qiagen 公司),Quant cDNA 第一链合成试剂盒(Tiangen公司),RealMasterMix(SYBR Green,Tiangen公司)。实验主要仪器为BD FACS流式细胞仪与Mx3000P荧光定量PCR仪。
1.2方法
1.2.1细胞培养 K562细胞培养于10%胎牛血清(FBS)的RPMI 1640培养液中,置于37 ℃、5% CO2饱和湿度的培养箱中培养。取对数生长期细胞用于实验。
1.2.2实验分组 分为不同浓度阿托伐他汀组(12.5、25.0和50.0 μmol/L)与阴性对照组(阿托伐他汀0 μmol/L)。
1.2.3CCK-8法检测细胞增殖抑制 收集对数生长期细胞,调整细胞浓度为1×105个/mL。接种细胞(1×104个/孔)于96孔板,按上述实验分组加入不同浓度阿托伐他汀,同时设立空白对照组(无细胞悬液,不加阿托伐他汀),每组设3个重复孔。置培养箱内分别孵育24、48及72 h,每孔加入CCK-8试剂20 μL,继续培养1 h,酶标仪检测各孔吸光度(A)值,实验重复3次。细胞增殖抑制率=100%-[(A给药组-A空白孔) /(A阴性对照组-A空白孔)]×100%。
1.2.4AnnexinV-FITC/PI双染法检测细胞凋亡率 分不同浓度阿托伐他汀组(即12.5、25.0和50.0 μmol/L)与阴性对照组(阿托伐他汀0 μmol/L)后置培养箱内孵育72 h,收集各组细胞,4 ℃预冷磷酸缓冲盐溶液(PBS)洗涤细胞2次,调整细胞浓度为1×106个/mL。加入500 μL结合缓冲液,离心弃上清,再加入100 μL结合缓冲液混匀后,分别加入5 μL Annexin V-FITC与5 μL PI,充分混匀;室温避光反应15 min。最后加入结合缓冲液400 μL,1 h内流式细胞仪检测细胞凋亡率。
1.2.5流式细胞仪检测细胞周期 分不同浓度阿托伐他汀组(即12.5、25.0和50.0 μmol/L)与阴性对照组(阿托伐他汀0 μmol/L)置培养箱内孵育72 h,收集各组细胞,4 ℃预冷PBS洗涤细胞2次,调整细胞浓度为1×106个/mL,重悬于0.5 mL PBS,加入2~3 mL 70%预冷乙醇中混匀,4 ℃保存过夜。次日离心弃乙醇,再用PBS缓冲液洗涤2次,加入PI/RNase,37 ℃避光孵育30 min,流式细胞仪测定细胞周期。
1.2.6比色法检测细胞caspase-3、-8、-9活性 分不同浓度阿托伐他汀组(即12.5、25.0和50.0 μmol/L)与阴性对照组(阿托伐他汀0 μmol/L)后置培养箱内孵育72 h,收集各组细胞,调整细胞浓度为1×106个/mL,提取蛋白后按Bradford法检测蛋白水平,调整蛋白水平在1~3 mg/mL范围。最后根据 caspase-3、-8、-9活性测定试剂盒说明书,分别检测caspase-3、-8、-9活性。
1.2.7qRT-PCR检测Bcl-2及程序性死亡因子(PDCD5)基因表达 分不同浓度阿托伐他汀组(即25.0、50.0 μmol/L)与阴性对照组(阿托伐他汀0 μmol/L)后置培养箱内孵育72 h,收集各组细胞,调整细胞浓度为1×107个/mL。用Qiagen试剂盒提取总RNA,紫外分光光度法检测RNA含量,A260/A280在1.8~2.0之间说明RNA纯度较好,用于反转录。根据试剂盒说明配制反转录反应体系,37 ℃反应60 min。最后按SYBRGreen说明书进行荧光定量PCR扩增。引物设计:从文献中检索所需要的Bcl-2、PDCD5、β-actin基因引物,后进行验证,通过软件进行评价并选取最优引物,送至上海生物工程公司合成,见表1。

表1 PCR引物序列和产物长度
1.2.8琼脂糖电泳检测扩增产物 分别取Bcl-2、PDCD5、β-actin扩增产物及DNA梯状标志,将上样缓冲液和待测DNA样品混匀,依次加至加样孔中,电泳结束后观察结果并拍照。
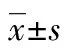
2 结 果
2.1阿托伐他汀对K562细胞增殖的影响 12.5、25.0与50.0 μmol/L浓度阿托伐他汀处理K562细胞24 h后细胞增殖抑制率分别为(6.11±0.74)、(12.50±1.24)、(27.46±1.43)%;48 h后分别为(13.74±1.33)、(26.01±0.62)、(39.33±1.90)%;72 h后分别为(25.29±1.08)、(37.68±1.04)、(59.24±0.81)%,均高于同时间段阴性对照组(P<0.05)。随作用时间延长,阿托伐他汀对 K562 细胞增殖抑制率亦相应增强(P<0.05)。提示阿托伐他汀对K562 细胞增殖抑制作用呈浓度与时间依赖性,见图1。
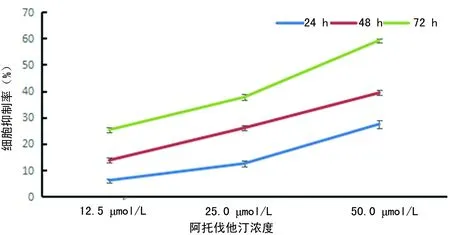
图1 不同浓度阿托伐他汀作用 K562细胞24、48、72 h细胞增殖抑制率
2.2阿托伐他汀对K562细胞凋亡的影响 12.5、25.0与50.0 μmol/L阿托伐他汀处理K562细胞72 h,细胞凋亡率分别为(14.11±1.12)、(22.89±0.87)、(47.35±1.41)%,显著高于阴性对照组(4.85±0.91)%(P<0.01),且3组浓度阿托伐他汀的细胞凋亡率组间比较差异有统计学意义(P<0.01),见图2。
2.3阿托伐他汀对K562细胞周期变化的情况 12.5、25.0与50.0 μmol/L阿托伐他汀作用K562 细胞72 h后,G0/G1期细胞百分比分别为(20.93±1.35)、(40.18±1.07)、(53.29±1.09)%,显著高于阴性对照组(16.35±0.75)%(P<0.01);同样,3组S期细胞百分比分别为 (68.29±0.66)、(49.98±1.14)、(39.09±0.87)%,显著高于阴性对照组 (71.17±1.25)% (P<0.01),表明阿托伐他汀呈浓度依赖性诱导K562细胞阻滞于G1/S期,见图3。
2.4阿托伐他汀作用K562细胞caspase-3、-8、-9活性的变化 12.5、25.0与50.0 μmol/L阿托伐他汀作用 K562 细胞 72 h,与阴性对照组相比较,caspase-3、-8、-9活性明显升高,差异有统计学意义(P<0.01)。表明阿托伐他汀可能通过活化caspase-3、-8、-9诱导K562细胞凋亡,见图4。
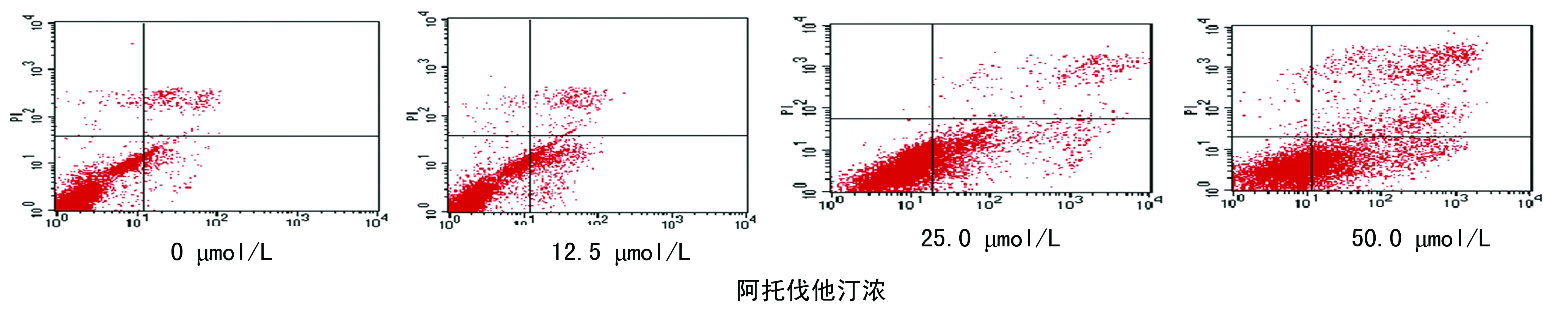
图2 不同浓度阿托伐他汀作用K562细胞72 h的细胞凋亡率
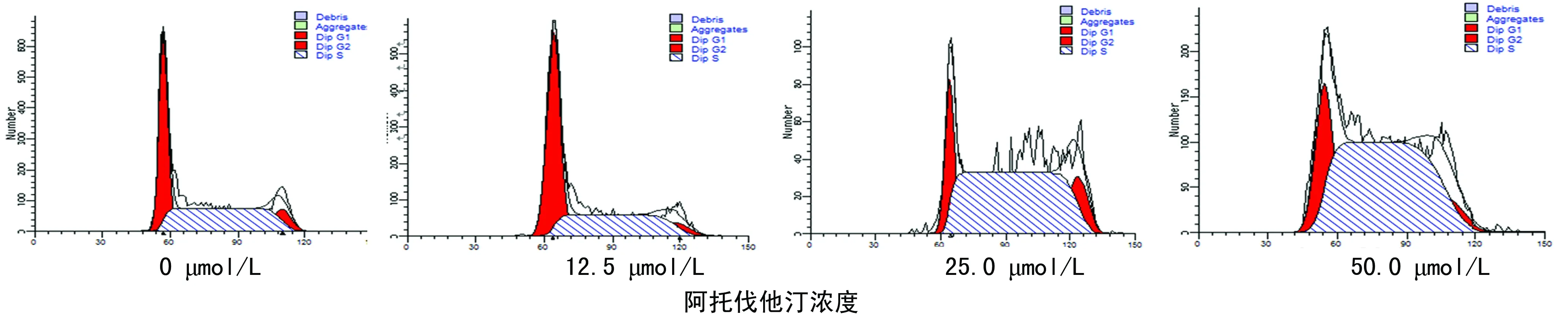
图3 不同浓度阿托伐他汀作用K562细胞72 h的细胞周期变化
2.5阿托伐他汀作用K562细胞Bcl-2及PDCD5基因表达变化 与阴性对照组比较,25.0、50.0 μmol/L阿托伐他汀处理K562细胞72 h, Bcl-2 mRNA分别下降了25.7%和53.6%(P<0.01);而PDCD5 mRNA表达分别上升至5.627倍和17.815倍(P<0.01),见图5。
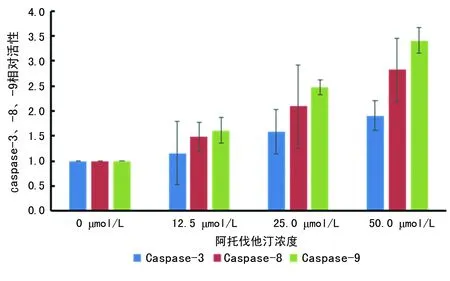
图4 不同浓度阿托伐他汀作用 K562 细胞72 h后caspase-3、-8、-9相对活性
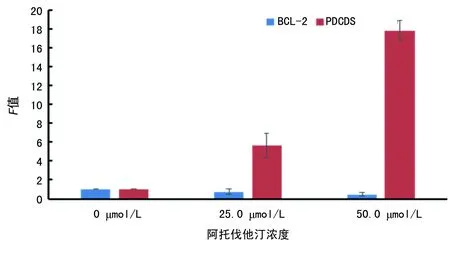
图5 不同浓度阿托伐他汀作用K562细胞Bcl-2、PDCD5 mRNA表达变化
3 讨 论
近年来,CML的治疗从传统的化疗药物到造血干细胞移植再到酪氨酸激酶抑制剂的应用,其临床疗效得到显著的提高;然而,CML急变期的患者仍对该类药物存在原发或继发耐药[3]。因此探索CML急变期新的高效低毒的化疗药物仍非常有必要。研究发现,他汀类药物可抑制肿瘤细胞增殖,诱导细胞凋亡或分化,影响细胞周期及信号传导等作用,而对正常细胞毒副作用不明显[4]。阿托伐他汀作为第三代他汀类的代表药物,不良反应小,其抗肿瘤作用也逐渐成为研究热点。在本实验中,阿托伐他汀呈浓度和时间依赖性抑制K562细胞增殖,与BESSLER等[2]研究结果相似,提示阿托伐他汀在K562细胞中具有抗白血病作用。
抗肿瘤药物在影响肿瘤细胞增殖的同时还可诱导细胞凋亡、导致细胞周期变化。BURANRAT等[5]发现阿托伐他汀可诱导人胆管癌细胞株的凋亡,同时能提升caspase-3及p21的水平。AJITH等[6]发现阿托伐他汀通过诱导淋巴瘤细胞凋亡,发挥抗淋巴瘤的效应。WOLFE等[7]发现辛伐他汀可抑制三阴性乳腺癌细胞的增殖和迁移并诱导细胞阻滞于G1/S期。本实验证实:阿托伐他汀呈浓度依赖性的诱导细胞凋亡并阻滞K562细胞周期于G1/S。caspase家族在细胞凋亡中起关键作用。KANUGULA等[8]发现氟伐他汀通过提高caspase-3、-8活性,诱导乳腺癌细胞凋亡。在本实验中,阿托伐他汀可激活caspase-3、-8、-9的活性,诱导K562细胞凋亡。Bcl-2家族在细胞凋亡中起至关重要作用,其异常表达与CML细胞的恶性增殖与存活密切相关[9]。SCHOINTUCH等[10]发现辛伐他汀明显上调caspase-3表达,而下调Bcl-2,诱导子宫内膜癌细胞凋亡。WOOD等[11]发现,高浓度的辛伐他汀可能通过抑制Bcl-2的表达诱导肿瘤细胞凋亡。PDCD5是一种新的促凋亡基因。本实验结果发现阿托伐他汀明显下调Bcl-2,上调PDCD5表达。
综上所述,阿托伐他汀可作为一种潜在的抗白血病药物。由于本研究属于体外实验,有必要进一步探讨其在体内的抗白血病效应及与化疗药物的协同作用,这将有望为CML急变期的患者设计一些靶向新疗法以提高患者生存质量。
[1]BOUDREAU D M,YU O,JOHNSON J.Statin use and cancer risk:a comprehensive review[J].Expert Opin Drug Saf,2010,9(4):603-621.
[2]BESSLER H,SALMAN H,BERGMAN M,etal.On the factors modulating the effect of statins on malignant cell proliferation[J].Cancer Invest,2007,25(5):279-284.
[3]NAKA K,HOSHII T,HIRAO A.Novel therapeutic approach to eradicate tyrosine kinase inhibitor resistant chronic myeloid leukemia stem cells[J].Cancer Sci,2010,101(7):1577-1581.
[4]VALLIANOU N G,KOSTANTINOU A,KOUGIAS M,etal.Statins and cancer[J].Anticancer Agents Med Chem,2014,14(5):706-712.
[5]BURANRA T B,SENGGUNPRAIL,PRAWAN A A.Simvastatin and atorvastatin as inhibitors of proliferation and inducers of apoptosis in human cholangiocarcinoma cells[J].Life Sci,2016,153(5):41-49.
[6]AJITHTA,ANUV,RIJIT.Antitumorandapoptosispromotingpropertiesofatorvastatin,an
inhibitor of HMG-CoA reductase,against Dalton′s Lymphoma Ascites tumor in mice[J].Exp Ther Oncol,2008,7(4):291-298.
[7]WOLFE A R,DEBEB B G,LACERDA L,etal.Simvastatin prevents triple-negative breast cancer metastasis in pre-clinical models through regulation of FOXO3a[J].Breast Cancer Res Treat,2015,154(3):495-508.
[8] KANUGULA A K,GOLLAVILLI P N,KARNEWAR S,etal.Statin-induced inhibition of breast cancer proliferation and invasion involves attenuation of iron transport:intermediacy of nitric oxide and antioxidant defence mechanisms[J].FEBS J,2014,281(16):3719-3738.
[9]STRNAD M.Expression of Bcl-2 protein and the amplification of c-myc gene in patients with chronic myeloid leukemia[J].Vojnosanit Pregl,2006,63(4):364-369.
[10]SCHOINTUCH M N,GILLIAM T P,STINE J E,etal.Simvastatin,an HMG-CoA reductase inhibitor,exhibits anti-metastatic and anti-tumorigenic effects in endometrial cancer[J].Gynecol Oncol,2014,134(2):346-355.
[11]WOOD W G,IGBAVBOA U,MULLER W E.etal.Statins,Bcl-2,and apoptosis:cell death or cell protection?[J].Mol Neurobiol,2013,48(2):308-314.
