养殖水体邻苯二甲酸二乙酯暴露对凡纳滨对虾壳膜几丁质酶的影响
2018-01-27高平章谢晓兰黄晓平林惠彬
高平章,齐 肖,谢晓兰,黄晓平,林惠彬
(1.泉州师范学院化工与材料学院,福建泉州 362000;2.惠安县净峰镇政府,福建惠安 362100)
凡纳滨对虾(Litopenaeusvannamei)俗称南美白对虾、万氏对虾等,原产于秘鲁北部至墨西哥桑诺拉一带的太平洋沿岸水域,生长于热带、亚热带、暖温带、温带海域。随着人工养殖大规模增加,凡纳滨对虾已成为世界对虾养殖产量最高的三大品种之一。泉州地处沿海地区,水产养殖业比较发达,但养殖环境的污染特别是水质中严重超标的金属离子、有机化合物等都将引起对虾体内生理生化的变化,导致对虾蜕壳困难、生长滞缓、患病率和死亡率升高等问题的出现,造成了巨大的经济损失[1]。
邻苯二甲酸酯类(Phthalic Acid Esters,简称PAEs)又称酞酸酯,作为塑化剂被广泛应用于塑料、涂料、医药、化妆品等产品。研究发现PAEs类化合物是一类环境内分泌干扰物,具有雌激素样活性,能对生物的正常行为及生殖、发育相关的激素代谢过程产生影响,其在环境中富集和随食物链迁移将成为水生动物乃至人类的潜在威胁[2]。邻苯二甲酸二乙酯(DEP)是美国国家环保局(EPA)列出的6种优先控制的PAEs有毒污染物之一,也是我国确定的3种PAEs环境优先控制污染物之一[3]。我国水体的PAEs检出率较高,其中福建九龙江水样含有多种PAEs类化合物,最主要的污染物是邻苯二甲酸二正丁酯(DBP)和DEP,含量分别达17.2 和11.7 μg/L[4]。泉州湾表层海水中各种PAEs类化合物含量均值为82.28 ng/L,DBP、DEP 和邻苯二甲酸二-(2-乙基己基)酯(DEHP)是主要成分,占总含量的71.15%[5]。水生动物对PAEs 有较强的生物富集能力,故近年来关于PAEs在水产品中的富集及毒性报道不少,姜琳琳调查了闽南沿海地区各类水产品中的PAEs残留水平,发现海水鱼类、淡水鱼类、虾类、蟹类、贝类等水产品体内均含有不同量的PAEs,残留量为贝类>淡水鱼>虾≈蟹>海水鱼[6]。王兴强等研究发现DEP暴露会导致凡纳滨对虾血清蛋白含量、血清酚氧化酶和超氧化歧化酶活性降低,虾免疫能力与存活率下降[7]。但目前未见DEP等PAEs污染物对凡纳滨对虾健康发育密切相关的几丁质酶系的影响研究。几丁质酶是多基因家族,广泛分布在虾蟹等甲壳动物的内脏、壳膜等组织中,与甲壳动物的蜕壳、孵化、食物消化及抗菌防御等密切相关。黄乾生等[8-9]克隆出7个凡纳滨对虾几丁质酶基因(LV-CHT1、LV-CHT2、LV-CHT3、LV-CHT4、LV-CHT5、LV-CHT6、LV-CHT7),并分析该基因家族各成员的功能分工,LV-CHT1、LV-CHT3和LV-CHT4基因编码的几丁质酶不仅具有消化酶的功能,还与抗病防御和围食膜蜕换有关;LV-CHT2、LV-CHT6和LV-CHT7基因编码的几丁质酶与对虾的周期性蜕壳密切相关;LV-CHT5基因编码的几丁质酶与对虾的先天免疫有关。
本实验通过凡纳滨对虾养殖水体的DEP暴露实验,采用酶促反应动力学法及实时荧光定量PCR检测对虾壳膜几丁质酶比活力及酶系列基因 mRNA表达量变化,研究结果将阐明DEP对与对虾蜕壳生长发育密切相关的壳膜几丁质酶系的影响机制,同时有助于了解DEP暴露对对虾的毒理机制及为养殖水体塑化剂的监控提供理论指导。
1 实验材料与方法
1.2 实验材料与试剂
实验材料:凡纳滨对虾(购于泉州秀土对虾养殖场),体长约(9.0±1.0)cm
实验试剂:考马斯亮蓝G-250(国药集团化学试剂有限公司);邻苯二甲酸二乙酯(国药集团化学试剂有限公司);牛血清白蛋白(上海蓝季科技发展有限公司);葡萄糖(天津市福晨化学试剂厂);其他化学试剂均为西陇化工股份有限公司。使用的蒸馏水均为玻璃重蒸水。RNA提取试剂盒(OMEGA bio-tek公司);5×PrimeScript Buffer(TaKaRa公司);Taq酶(TaKaRa公司);相关引物均为上海生物工程股份有限公司合成。Beta-actin基因引物:Beta-actin-F:5′-TACACCTTCACGACCACCGC-3′、Beta-actin-R:5′-TCTCCAGCGAGGAGGAGGAA-3′ ;几丁质酶系基因引物:
LV-CHT2-F:5′-CGGCAAGTACAGACCTGAAGACAT-3′
LV-CHT2-R:5′-AATCATAATCAGCCCAAGTGTCGTG-3′
LV-CHT3-F:5′-AACACCTCCGGCGGTTACAA-3′
LV-CHT3-R:5′-ACACCGAAGCCCAATCG-3′
LV-CHT5-F:5′-TGTCTCCGCTTTGGTGAGG-3′
LV-CHT5-R:5′-ATGGTGGTGGGCGTATTGTT-3′
LV-CHT6-F:5′-CGCTTTCATCCAACACCACC-3′
LV-CHT6-R:5′-CCTCGCGGAGTTCCTTAACC-3′
LV-CHT7-F:5′-CTTGTTCCAGATGGCACTGTATTT -3′
LV-CHT7-R:5′-TGGTTCTTGTTCAGGTGTCTTTTC -3′
1.2 实验方法
1.2.1 凡纳滨对虾DEP暴露实验
养殖场购置对虾在实验室驯养稳定后,挑选同一生长期的对虾在50 cm× 35 cm×30 cm的养殖桶中进行暴露养殖。暴露养殖条件:养殖桶放水体20 L,对虾50尾,水温为(22±1)℃,盐度为10,pH 7.6,DEP暴露浓度分别为0(对照)、10、20 μg/L,每个浓度设3个平行组。实验期间,每天持续增氧,定时换水。暴露120、240 h后分别取样备用。
1.2.2 凡纳滨对虾壳膜几丁质酶的抽提制备
凡纳滨对虾在1.2.1的暴露养殖条件下暴露一定时间后,每个浓度组取6条虾,用蒸馏水将虾体冲洗干净,用吸水纸吸干虾体表面水分后,分别取壳膜,研磨均匀,加入预冷的Tris-HCl(pH7.5)缓冲液1 mL,4 ℃下抽提1 h后,12 000 r/min冷冻离心20 min,收集上清液得几丁质酶粗酶液,冷冻备用。
1.2.3 酶蛋白浓度、酶活力及酶比活力测定
按考马斯亮蓝法[10],采用试剂空白,用UV-1800紫外分光光度计测定不同浓度标准蛋白(牛血清白蛋白)溶液经染色反应后在595 nm下的吸光度值(OD),以标准蛋白含量(μg)为横坐标,OD值为纵坐标,绘制标准曲线,回归得标准曲线方程为:Y=4.6×10-3x,R2=0.992 3。根据标准曲线测定方法和标准曲线方程测定酶蛋白溶液。
[10],以N-乙酰氨基葡萄糖作标准物,采用DNS法测定还原糖浓度,以N-乙酰氨基葡萄糖含量(mg)为横坐标,500 nm处的吸光度值为纵坐标绘制标准曲线,回归标准曲线得方程Y=1.25x,R2=0.998。根据文献[11],往0.5 mL 0.1 mol/L pH 6.0磷酸缓冲液中加入等体积的1% 胶体几丁质溶液,混匀后在45 ℃下预热10 min,加入0.3 mL几丁质酶液和0.2 mL蒸馏水,反应1 h后,沸水浴20 min终止反应,并迅速冷却后加入1.5 mL DNS试剂,再沸水浴20 min后,冷却至室温再用蒸馏水定容至25 mL,摇匀后离心取上清,试剂空白,在500 nm下测吸光度,根据还原糖标准曲线换算酶解产物N-乙酰氨基葡萄糖含量。以N-乙酰氨基葡萄糖的生成速度来衡量几丁质酶活性大小。
酶活力单位(U)的定义:在温度45 ℃、pH 6.0的测活条件下,水解胶体几丁质生成1 μg N-乙酰氨基葡萄糖所需要的酶量为一个活力单位;比活力定义为每毫克酶蛋白具有的酶活力单位数。
1.2.4 总RNA提取、纯化与反转录
快速取壳膜的一小部分(大约100 mg)加入1 mL RNA-Slove regent和3颗钢珠,用匀浆机匀浆3 min,4 ℃放置半小时,加入200 μL氯仿,混匀,在冰上放置10 min,12 000 r/min,4 ℃离心15 min,取上清液加入250 μL无水乙醇混匀,用HiBind RNA Spin柱子过滤,分别用300 mL与400 mL Wash Buffer Ⅰ、两次500 mL Wash Buffer Ⅱ各冲洗柱子,并在10 000 r/min离心1 min去除滤液,在14 000 r/min离心2 min甩干,用40 μL DEPC-水将mRNA溶解转移至新的离心管中,即得到总RNA。用微量核酸蛋白分析仪测定RNA浓度。
RT-PCR反应体系:2 μL的5×PrimeScript Buffer(含有PrimeScriptRTase、RNase Inhibitor、Random 6 mers、Oligo dT Primer、dNTP Mixture、反应Buffer),500 ng RNA,最后用DEPC-水补足至10 μL,反应条件为:37 ℃反转录15 min,85 ℃反转录酶失活5 s。在该反转录体系及条件下反转录得cDNA。
1.2.5 几丁质酶的实时荧光定量PCR及mRNA相对表达量测定
在Light Cycle 480 Ⅱ实时荧光定量PCR仪进行扩增。反应体系为:Taq酶(含有TaKaRa Ex Taq HS DNA Polymerase,dNTP mixture,Mg2+,Tli RNaseH和SYBR Green I.)10 μL,前后引物各0.8 μL(0.4 μmol/L),DEPC-水6.4 μL,cDNA模板2 μL,反应条件为95 ℃预变性30 s,共1个循环;95 ℃变性5 s,60 ℃退火20 s,共40个循环。
1.2.6 DEP暴露对凡纳滨对虾壳膜几丁质酶系基因的mRNA表达量影响测定
按1.2.1暴露方法进行暴露实验,暴露一定时间后,每个浓度组取6条虾(同1.2.2的对虾样品),用蒸馏水将虾体冲洗干净,用吸水纸吸干虾体表面水分后,快速取虾壳的一小部分,按1.2.4方法提取mRNA并反转录为cDNA,按1.2.5方法分别对凡纳滨对虾的内参基因Beta-actin和几丁质酶系基因LV-CHT1、LV-CHT2、LV-CHT3、LV-CHT4、LV-CHT5、LV-CHT6、LV-CHT7进行实时荧光定量PCR,PCR反应结束,记录其复制次数。以Beta-actin为内参,根据文献[12]公式ΔΔCT=(CT,Target-CT,Actin)Time x-(CT,Target-CT,Actin)Time 0,用浓度代替其中的时间即可计算在不同浓度下的ΔΔCT值,再计算2-ΔΔCT即可得出各基因相对扩增倍数。
1.2.7 数据处理和分析
采用 SPSS 20.0对实验数据进行单因子方差(ANOVA)和Duncan统计分析,得到平均值和标准差 (mean±SD),当P<0.05时,表示差异显著。
2 结果与分析
2.1 DEP暴露对凡纳滨对虾壳膜几丁质酶比活力影响
以水体终浓度分别为0、10、20 μg/L的DEP进行凡纳滨对虾暴露养殖实验,分别在暴露120、240 h后取样,分析测定壳膜几丁质酶的比活力,由图 1可见,与非暴露组的对虾壳膜几丁质酶比活力比较,养殖水体DEP暴露120 h后,暴露组的壳膜几丁质酶比活力随着DEP暴露浓度增大出现先下降后回升的趋势,10 μg/L的DEP让对虾壳膜几丁质酶比活力下降了32.4%,但20 μg/L的DEP暴露下,对虾壳膜几丁质酶比活力基本没有变化,统计分析各浓度组几丁质酶比活力差异不具有显著性。但随着DEP暴露时间的延长,当暴露240 h后,DEP的胁迫激活了对虾壳膜几丁质酶比活力,10、20 μg/L的DEP 分别让几丁质酶比活力上升了138.7%、71.0%,但这种激活作用也没有显著性。
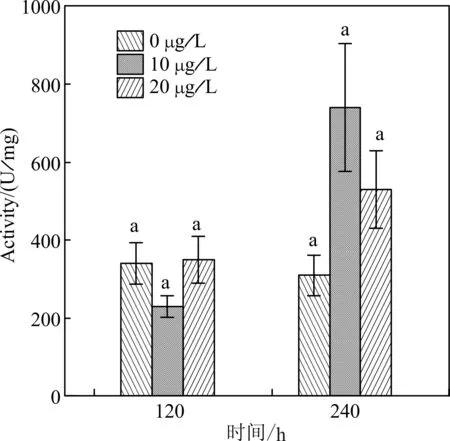
图1 DEP暴露不同时间后凡纳滨 对虾壳膜几丁质酶比活力比较Fig.1 Comparison of the activity of chitinase from epidermis after L.vannamei exposured to DEP for the different time
2.2 DEP暴露对对虾壳膜几丁质酶系基因的mRNA表达量影响
通过凡纳滨对虾养殖水体的DEP暴露实验,采用实时荧光定量PCR分别检测对虾壳膜几丁质酶系基因LV-CHT1、LV-CHT2、LV-CHT3、LV-CHT4、LV-CHT5、LV-CHT6、LV-CHT7的mRNA表达量变化,结果表明,DEP暴露前后,凡纳滨对虾壳膜部位均检测不到LV-CHT1和LV-CHT4基因的表达;但能检测到LV-CHT2、LV-CHT3、LV-CHT5、LV-CHT6和LV-CHT7基因的表达,且在不同浓度的DEP暴露不同时间后,各基因的mRNA表达量均发生不同程度变化。
2.2.1 DEP暴露对对虾壳膜几丁质酶LV-CHT2基因的mRNA表达量影响
凡纳滨对虾分别在含不同浓度DEP的养殖水体中暴露不同时间后取样,分析测定壳膜几丁质酶LV-CHT2基因的mRNA表达量。图 2结果显示,与对照组相比较,凡纳滨对虾在含不同浓度DEP的水体中胁迫养殖120 h与240 h后,壳膜几丁质酶LV-CHT2基因的mRNA表达量均呈现先抑后扬趋势。与其它浓度组相比,10 μg/L的DEP胁迫120 h后让壳膜几丁质酶LV-CHT2基因的mRNA表达量出现显著性下降,而20 μg/L的DEP胁迫120 h则使mRNA表达量上升,这种上升趋势与空白对照组比较不具有显著性,但与10 μg/L浓度组相比具有显著性。DEP暴露240 h后,10 μg/L的DEP使壳膜几丁质酶LV-CHT2基因的mRNA表达量明显下降,而20 μg/L的DEP使mRNA表达量大幅上升,但统计分析显示各浓度组间不存在显著性差异。
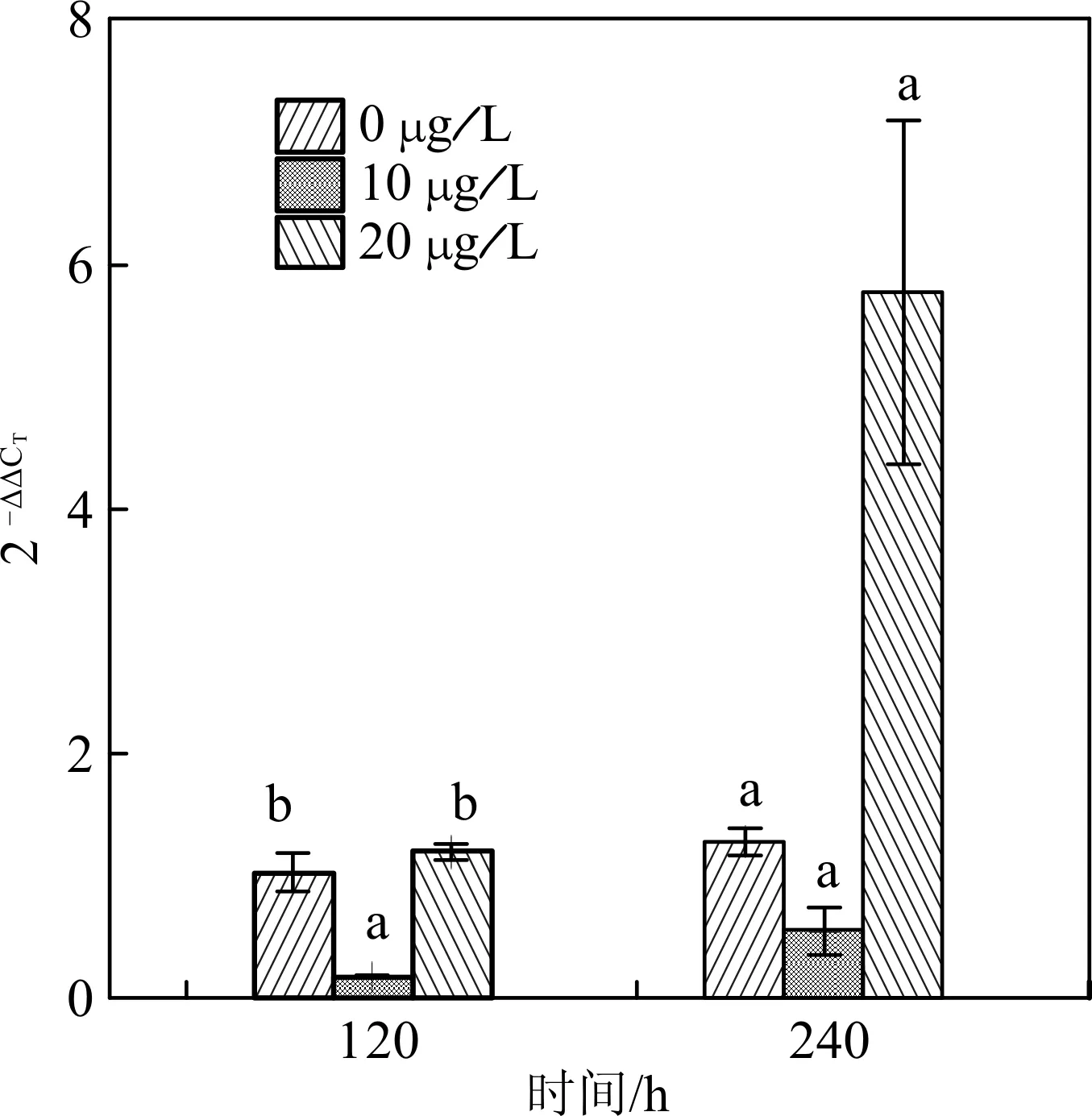
图2 DEP暴露对凡纳滨对虾几丁质酶LV-CHT2 基因的mRNA表达量影响Fig.2 Effects of DEP exposure on the mRNA expression of LV-CHT2 from L.vannamei
2.2.2 DEP暴露对对虾壳膜几丁质酶LV-CHT3基因的mRNA表达量影响
由图3可见,与对照组相比较,凡纳滨对虾在含不同浓度DEP的水体中胁迫养殖120 h与240 h后,壳膜几丁质酶LV-CHT3基因的mRNA表达均被抑制。与其它浓度组相比,对虾在10 μg/L的DEP水体中胁迫120 h后,壳膜几丁质酶LV-CHT3基因的mRNA表达量出现显著性大幅度下降,20 μg/L的DEP胁迫120 h也使mRNA表达量下降,这种下降趋势与空白对照组比较不具有显著性,但与10 μg/L浓度组相比具有显著性。DEP暴露240 h后,与对照组相比,不同浓度暴露组的壳膜几丁质酶LV-CHT3基因的mRNA表达受抑制程度相当,且抑制趋势均不具有显著性。

图3 DEP暴露对凡纳滨对虾几丁质酶LV-CHT3 基因的mRNA表达量影响Fig.3 Effects of DEP exposure on the mRNA expression of LV-CHT3 from L.vannamei
2.2.3 DEP暴露对对虾壳膜几丁质酶LV-CHT5基因的mRNA表达量影响
由图4可知,与对照组相比较,凡纳滨对虾分别在含10、20 μg/L的DEP水体中胁迫养殖120 h后,壳膜几丁质酶LV-CHT5基因的mRNA表达均被小幅抑制,且抑制程度相当,统计分析表明不同浓度组间的mRNA表达量不具有显著性差异。而凡纳滨对虾分别在含10、20 μg/L的DEP水体中胁迫养殖240 h后,壳膜几丁质酶LV-CHT5基因的mRNA表达均被小幅激活,且激活程度相当,同样统计分析表明不同浓度组间的mRNA表达量不具有显著性差异。
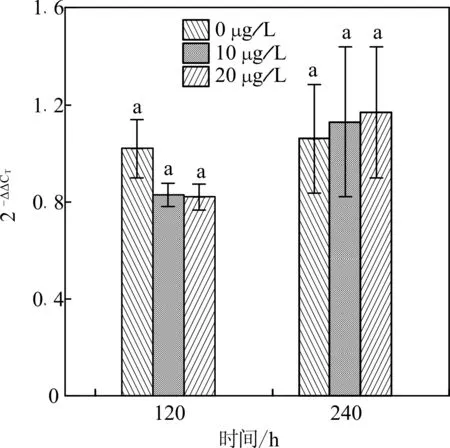
图4 DEP暴露对凡纳滨对虾几丁质酶LV-CHT5 基因的mRNA表达量影响Fig.4 Effects of DEP exposure on the mRNA expression of LV-CHT5 from L.vannamei
2.2.4 DEP暴露对对虾壳膜几丁质酶LV-CHT6基因的mRNA表达量影响
图5结果显示,与对照组相比较,凡纳滨对虾在含不同浓度DEP的水体中胁迫养殖120 h后,壳膜几丁质酶LV-CHT6基因的mRNA表达呈现先激活后抑制趋势。与对照组比较,10 μg/L的DEP胁迫120 h后让壳膜几丁质酶LV-CHT6基因的mRNA表达量约上升了72.4%;而20 μg/L的DEP使mRNA表达量下降了25.8%,进一步统计分析比较不同浓度组间的表达量差异,结果表明不具有显著性。当DEP暴露延长至240 h后,与对照组比较,不同浓度暴露组均因DEP的胁迫使壳膜几丁质酶LV-CHT6基因的mRNA表达被激活,激活程度随着DEP浓度增大而增大,但激活趋势不具有显著性。

图5 DEP暴露对凡纳滨对虾几丁质酶LV-CHT6 基因的mRNA表达量影响Fig.5 Effects of DEP exposure on the mRNA expression of LV-CHT6 from L.vannamei
2.2.5 DEP暴露对对虾壳膜几丁质酶LV-CHT7基因的mRNA表达量影响
由图6可见,与对照组相比较,凡纳滨对虾在含10 μg/L 的DEP水体中胁迫养殖120 h后,壳膜几丁质酶LV-CHT7基因的mRNA表达被显著性抑制,表达量下降了57.0%。而20 μg/L的DEP胁迫120 h后也使壳膜几丁质酶LV-CHT7基因的mRNA表达量下降了14.0%,但这种下降趋势与其它浓度组相比不具有显著性。凡纳滨对虾在含不同浓度DEP中暴露240 h后,LV-CHT7基因的mRNA表达量也均受到不同程度抑制,10 μg/L的DEP对LV-CHT7基因的mRNA表达抑制程度比20 μg/L的DEP抑制程度大,但不同浓度的DEP胁迫对LV-CHT7基因的mRNA表达量影响均不具有显著性。

图6 DEP暴露对凡纳滨对虾几丁质酶LV-CHT7 基因的mRNA表达量影响Fig.6 Effects of DEP exposure on the mRNA expression of LV-CHT7 from L.vannamei
3 讨论
DEP是一种塑化剂,是生产聚氯乙烯的原料,伴随着我国聚氯乙烯产业的发展,DEP造成的水质污染日趋严重。该物质已成为水环境中检出最多的有机污染物之一[13]。王兴强等对凡纳滨对虾进行DEP暴露实验,结果发现经过90 d的暴露实验,由于虾一直处于应激状态,不断消耗对虾体内免疫因子,最终导致血清蛋白、血清酚氧化酶和超氧化歧化酶等免疫因子含量及活性下降,对虾免疫系统崩溃,导致对虾生理机能失调,影响对虾生长[7]。几丁质酶在对虾生长发育过程中发挥多种生化功能,具有促进几丁质类食物消化吸收、调控围食膜和外壳周期性蜕换及抗菌防御等作用[9]。本研究考察DEP暴露120 h和240 h对凡纳滨对虾壳膜几丁质酶的影响,结果表明不同浓度组的DEP暴露对壳膜几丁质酶比活力的影响不具有显著性;但比较同一浓度组暴露不同时间的壳膜几丁质酶比活力,结果显示非暴露组的壳膜几丁质酶比活力基本不变,而暴露组随着暴露时间的延长酶比活力明显提高,说明DEP胁迫对壳膜几丁质酶比活力有促进作用,对虾壳膜几丁质酶对养殖水体DEP的存在会表现出应激反应。几丁质酶活力变化趋势与王兴强等[7]的DEP暴露实验后的酚氧化酶、超氧化歧化酶的变化趋势相反,这可能与几丁质酶具有多种生理功能作用有关,也可能与暴露时间长短有关。
为了进一步了解PAEs 对凡纳滨对虾的免疫毒性和发育毒性,故本研究进一步考察了DEP暴露对凡纳滨对虾壳膜几丁质酶系基因的影响。结果显示10 μg/L DEP暴露120 h后,对虾壳膜几丁质酶系的LV-CHT2、LV-CHT3、LV-CHT7等三个基因的mRNA表达量均是被显著抑制,但随着暴露时间延长到240 h,这种显著性差异转化成非显著性;20 μg/L DEP胁迫对LV-CHT2、LV-CHT3、LV-CHT7等三个基因的mRNA表达量没有显著性影响,不同浓度组的DEP胁迫对LV-CHT5、LV-CHT6等两个基因的mRNA表达量影响也没有显著性。进一步分析同浓度组不同暴露时间点各个几丁质酶基因的mRNA表达量差异,发现在整个实验考察过程中,对照组的各个几丁质酶基因的mRNA表达量均比较稳定,而DEP暴露组中,除了LV-CHT7基因的mRNA表达量基本不受暴露时间影响,LV-CHT2、LV-CHT3、LV-CHT5和LV-CHT6基因的mRNA表达量均会受暴露时间影响。DEP暴露组的壳膜LV-CHT2及LV-CHT5基因的mRNA表达量均随DEP胁迫时间延长而上调;10 μg/L DEP暴露会随胁迫时间延长让壳膜LV-CHT3基因的mRNA表达量提高,但在20 μg/L DEP暴露过程中比较稳定;壳膜LV-CHT6基因在10 μg/L DEP暴露下,会随胁迫时间延长mRNA表达量被轻微回调,但20 μg/L DEP则随着暴露时间延长mRNA表达量被大幅度提高。可见,DEP暴露对对虾壳膜各个几丁质酶基因的mRNA表达具有影响,时间延长基本上导致LV-CHT2、LV-CHT3、LV-CHT5和LV-CHT6基因的mRNA表达量上调。Zhao等[14]研究也表明凡纳滨对虾感染白斑病毒后,体内几丁质酶基因表达上调。本实验室DEP胁迫研究结果说明,在外界胁迫影响和体内病毒感染情况下,对虾产生的免疫反应会使体内几丁质酶基因表达上调,这种基因表达影响将导致酶活力受影响,从而导致对虾的蜕壳生长发育受影响。
进一步整体分析DEP暴露对凡纳滨对虾壳膜几丁质酶活力及基因表达影响,发现DEP暴露对酶活力及基因表达的影响趋势基本一致,短时间低浓度DEP胁迫对对虾壳膜几丁质酶mRNA的表达量和比活力具有抑制现象,这应该是对虾对外界DEP胁迫产生的应激反应。而随着胁迫时间延长,壳膜几丁质酶的mRNA表达量和酶比活力均出现上升趋势,这种趋势与王兴强等[7]研究发现的免疫因子活力受DEP长期胁迫后呈现的下降趋势相反,可见,在我们实验考察的时间范围内,DEP胁迫没有引起对虾的免疫系统崩溃,反而是启动应激免疫调控系统,产生免疫应答反应,但这种免疫应答反应随着暴露时间进一步延长是否将会再发生改变,这还有待今后进一步研究。
参考文献:
[1]朴顺金,谢晓兰,黄乾生,等.不同养殖期的凡纳滨对虾外壳膜NAGase基本性质比较[J].台湾海峡,2006,25(3):348-352.
[2]葛 健,林 芳,韩宝瑜.邻苯二甲酸二乙酯(DEP)在罗非鱼(Oreochromisniloticus×O.aureus)体内代谢动力学和残留研究[J].海洋与湖沼,2011,42(1):137-141.
[3]Wang J L,Ye Y C,Wu W Z.Comparison of di-n-meth ylphthalate biodegradation by free and immobilized microbial cells [J].Biomed Environ Sci,2003,16(2):126-132.
[4]陆 洋,袁东星,邓永智.九龙江水源水及其出厂水邻苯二甲酸酯污染调查[J].环境与健康杂志,2007,24(9):730-735.
[5]庄婉娥,姚文松,汪厦霞,等.泉州湾海水及沉积物中PAEs的分布及化学组成[J].环境与健康杂志,2011,28(10):898-902.
[6]姜琳琳.闽南地区水产品中邻苯二甲酸酯类(PAEs)的分布特征及风险评价[J].渔业科学进展,2015,36(4):139-144.
[7]王兴强,曹 梅,阎斌伦,等.塑料增塑剂对凡纳滨对虾存活、生长和免疫的影响[J].生态毒理学报,2010,5(1):69-75.
[8]杜 娟,谢晓兰,石 艳,等.患红体病的凡纳滨对虾外壳膜NAGase基本性质的改变[J].应用与环境生物学报,2008,14(2):207-210.
[9]Huang Q S,Yan J H,Tang J Y,et al.Cloning and tissue expressions of seven chitinase family genes inLitopenaeusvannamei[J].Fish Shellfish Immunol,2010,29(1):75-81.
[10]余瑞元,袁明秀,陈丽蓉,等.生物化学实验原理和方法[M].第二版.北京:北京大学出版社,2005:240-242.
[11]谢晓兰,曾 炜,高平章,等.黄粉虫几丁质酶的纯化及性质[J].泉州师范学院学报,2012,30(4):56-61.
[12]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J].Methods,2002,25(4):402-408.
[13]李海涛,黄岁樑.水环境中邻苯二甲酸酯的迁移转化研究[J].环境污染与防治,2005,28(11):127-135.
[14]Zhao Z Y,Yin Z X,Weng S P,et al.Profiling of differentially expressed genes in hepatopancreas of white spot syndrome virus-resistant shrimp (Litopenaeusvannamei)by suppression subtractive hybridization [J].Fish Shellfish Immunol,2007,22(5):520-534.
