17α-甲基睾丸酮诱导白斑狗鱼性逆转初步研究
2018-01-27张俊杰
李 飞,胡 琼,张俊杰
(新疆农业大学动物科学学院,乌鲁木齐 830052)
白斑狗鱼(Esoxlucius)是国内外重要的亚冷水性经济鱼类之一,其生长速度快,肉质坚韧,肉味鲜美,营养价值高,没有肌间刺,可食部分大,因此深受人们喜爱;且白斑狗鱼的市场价格居高不下,养殖潜力相当巨大[1]。研究表明,白斑狗鱼雌鱼生长明显快于雄鱼,而且性成熟更晚,寿命更长[2]。如果能实现白斑狗鱼全雌单性生产,将对提高白斑狗鱼养殖效益有着重要的意义。但是未见用17α-甲基睾丸酮诱导白斑狗鱼性逆转的研究报道。
鱼类性别的人工控制方法有很多种,比较常用的几种方式有杂交育种,性激素处理、雌核发育、多倍体育种等。当然,关于鱼类的单性生产及养殖很多学者做了这方面的研究,并且取得了一定的成果。河鲈(Percafluviatilis)[3]、尼罗罗非鱼(Oreochromisniloticus)[4]、黄鳝(Monopterusalbus)[5]和鲫(Crucianauratus)[6]等鱼类用投喂法,温度调控诱导法或外源雄激素埋植法数月后,都获得了功能性雄鱼,即伪雄鱼(其自身遗传物质仍为雌鱼的)。到目前为止,在鱼类的激素诱导性转化实验中至少在15个科47种的雌雄异体和9个科34种的雌雄同体鱼类中取得成果,所使用的激素多达31种,在雄性化诱导中以人工合成的17α-甲基睾酮(17α-MT)诱导转雄效果最好[7]。用性类固醇激素诱导鱼类性转化的研究内容分为以下几个部分:筛选激素、应用的处理方法、处理时间以及处理强度等[8]。
实验用的17α-MT对白斑狗鱼雄性化诱导研究主要目的在于了解白斑狗鱼性腺分化的时间节点和17α-MT对其诱导效果以及是否有严重的致死效应,为今后获得白斑狗鱼伪雄鱼进行全雌鱼苗生产(伪雄鱼与正常雌鱼交配)奠定理论基础;同时为鱼类繁殖生物学研究以及白斑狗鱼性腺发育规律研究奠定基础。
1 材料和方法
1.1 试验材料
试验所用白斑狗鱼为2016年4月12日在室内经人工干法授精,在孵化槽内进行循环流水孵化并于2016年4月20日孵出的仔鱼。这些仔鱼用室内循环流水式系统在水箱(规格为60 cm×40 cm×30 cm)中养殖,水体日交换过滤次数为5次,并用增氧机全天24 h增氧。试验初期水温在11~12 ℃,出膜后逐渐提高到12~14 ℃,最终提高至18 ℃左右饲养。孵出后4 d左右开始投喂人工孵化的卤虫,第10天开始投喂切碎的水蚯蚓,并根据仔鱼的生长情况,逐渐过渡到不再切碎,一直投喂至试验结束为止,试验鱼每天投喂两次以保证饵料充足。
1.2 试验药品及饵料的配制
试验所用17α-甲基睾丸酮购自上海源叶生物科技有限公司。17α-MT为白色粉末状药品,经精密称定完全溶解于无水乙醇中配制成1 mg/mL 的原液储存于4 ℃冰箱中,待使用时只需用水稀释50倍即可,即达到试验所需的浓度20 mg/L;试验所需浓度是根据Yamamoto等[9]建立的有效激素处理标准设置的。试验组所需投喂的水蚯蚓在20 mg/L 的17α-MT中浸泡1 h即可。
1.3 试验设计及样品的处理
试验开始前先将人工孵化的白斑狗鱼随机选出900尾无伤无病的仔鱼,平均分成6个大组每组150尾鱼;每个大组再设置3个平行,每组50尾鱼;其中4个大组为试验组,分别在出膜后的第10、20、30、40天投喂经20 mg/L 17α-MT浸泡的水蚯蚓,投喂以0.5 h吃完为佳,若未吃完则将剩余饵料及时吸出,各组投喂的持续时间均为30 d,然后转为投喂正常的水蚯蚓;第5组为乙醇对照组(简称乙醇组),在出膜40 d后对其投喂与试验组等量的经20 mg/L无水乙醇浸泡的水蚯蚓,连续投喂30 d后转为投喂正常饵料;第六组为空白对照组(简称空白组),始终投喂正常饵料。
所有试验鱼在2016年11月10日和12日将存活的仔鱼分两批进行解剖并取出性腺,在Bouin’s固定液中固定24 h后用加入少量氨水(去除固定液颜色)的70%乙醇冲洗再转入70%乙醇中保存。
在试验鱼饲喂的过程中观察并记录各组仔鱼的反应,尤其是死亡情况及原因。
1.4 组织学分析
采集的样品经乙醇梯度脱水,二甲苯透明,渗蜡,包埋,然后进行连续横切,厚度为5~7 μm,HE染色,最后用Motic光学显微镜观察分析并拍照取图。根据性腺的组织结构判断其性别,记录其性别情况。
1.5 数据分析
将饲喂期间记录的各组死亡数、性腺观察结果的性别情况录入Excel表格;计算各组雄性率及平均存活率和标准差,试验数据都用平均值±标准差(mean±S.D)的形式表示。然后用Spss19.0软件进行单因素方差分析(ANOVA),用LSD多重比较法检验各组间仔鱼存活率是否有显著性差异,显著性水平设置为0.05。
2 结果与分析
2.1 不同处理组对白斑狗鱼存活率的影响
饲喂白斑狗鱼仔鱼时各组鱼进食情况良好,投喂饵料时仔鱼均竞相吞食。但在整个饲喂过程中各组鱼均发生了不同程度的死亡。其中投喂17α-MT的4个实验组的仔鱼的反应基本一致,均表现为一种较空白组稍兴奋的状态,在箱内频繁快速地游动;在激素投喂期内箱内的少部分仔鱼又转变为较空白组安静地状态,食欲不振,甚至停止进食,最后安静的停留在箱底,基本在一周内死亡;激素投喂期结束后继续投喂正常饵料,但在饲养过程中试验组均出现了不同程度的畸形鱼,有的是脊索弯曲,有的是背鳍部位骨质增生,这些鱼有的在后期生长时又恢复了正常形态,有的则在数天后死亡。乙醇组和对照组未出现上述的异常情况,但也有一定数量的死亡,主要死亡原因为仔鱼间相互追咬(白斑狗鱼在幼鱼阶段有残食现象)。
所有仔鱼在培育至2016年11月12日(7月龄)全部处死取出性腺并统计各组存活尾数,计算各组平均存活率(见表1)。统计分析结果显示1、2、3组间存活率无显著差异,4组,乙醇组,空白组间存活率无显著差异。1组分别与4组和乙醇组;2、3组分别与4组,乙醇组,空白组间存活率存在显著差异,即在出膜30 d前投喂17α-MT对其有显著致死效应;乙醇组与空白组间存活率无显著差异,即无水乙醇对其无显著致死效应。

表1 不同处理对各组白斑狗鱼平均存活率影响的多重比较表Tab.1 The impact of different treatments on each E.lucius average survival rate of multiple comparison %
注:*表示有显著差异(P<0.05)
2.2 17α-MT对白斑狗鱼性腺分化及性别比例的影响
将7月龄全部处死取出性腺固定并进行组织切片,显微观察各组鱼性腺发育情况,判断每条鱼的性别。结果显示各组鱼的性腺均出现了三种分化现象:单一精巢结构,单一卵巢结构,精巢卵巢结构混长(如图1所示);由于对照组乙醇组和实验组均出现了这种情况,所以这种情况的出现不是投喂17α-MT导致的,而是白斑狗鱼特殊的性腺分化方式所致。根据观察到的这三种情况进行了分组(雌性,雄性,兼性),统计情况如表2所示。结果显示实验组1(10 d喂药组)的雄性率40.8%,高于其它各组(10%,8.5%、6.3%、8.2%、26.3%),说明试验组在不同的时间投喂17α-MT对其雄性率的影响程度是不同的,在出膜20 d后投喂17α-MT时其性腺已经开始分化,药物对其性别分化影响程度小,因此推断其性腺分化的时间节点可能是在出膜后10~20 d。

图1 各组中白斑狗鱼性腺三种分化现象的组织切片Fig.1 The tissue sections for three differentiation phenomenon of E.lucius gonad in each experimental group 1.单一卵巢组织的性腺,示处于第二时相卵母细胞。2.单一精巢组织的性腺。3.精巢组织与卵巢组织共存的性腺。 (OC:卵巢腔,TA:性腺被膜,L:精小叶,LL:小叶腔)

组别各组仔鱼数/尾开始喂药时间/d喂药持续时间/d最终取样数/尾雄性率/%实验组1150孵化后103049408实验组2150孵化后203040100实验组3150孵化后30304785实验组4150孵化后40306463乙醇组150孵化后40306182空白组150始终投喂正常饵料始终投喂正常饵料57263
在进行性腺发育的形态学观察时,同为7月龄的白斑狗鱼但其性腺发育的程度却存在明显的差异,主要表现为一些性腺饱满里面充满了生殖细胞(卵母细胞,精原精母细胞和精子),性腺的横切面积较大;另一些性腺窄小,性腺内生殖细胞少,横切面积小。性腺窄小的情况主要出现在投喂药物的4个试验组,而乙醇组和空白组相对较为饱满。在整个观察过程中未见有成熟的卵子,大多处于第二时相卵母细胞说明此时还未性成熟,并且染色加深有退化迹象;但却观察到大量的精原母细胞和成熟精子(如图2所示)。
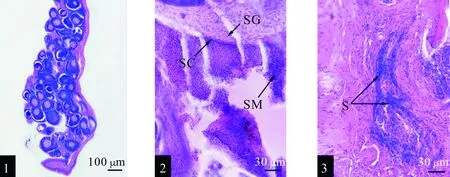
图2 白斑狗鱼卵巢和精巢发育情况的组织切片Fig.2 The tissue section for ovary and testis development situation of E.lucius1.卵巢中退化的卵母细胞。2.精巢中各期雄性生殖细胞。(SG:精原细胞,SC:精母细胞,S:精子细胞) 3.精巢中呈涡流状分布的精子。S:精子
3 讨论
3.1 投喂17α-MT对白斑狗鱼存在显著致死效应
17α-MT是人工合成的雄激素,因其价格低廉诱导效果佳被广泛应用于鱼类雄性化诱导试验中。但有研究指出,性别决定类型为雄性配子异型(XY♂)的鱼类其雌鱼(XX♀)雄性化后(XX♂)的平均存活率仅为24%,同样的雌性配子异型(ZW♀)鱼类其雄鱼(ZZ♂)雌性化后(ZZ♀)的存活率为20%[7]。研究表明,性别表型与遗传型不一致的鱼类生存能力明显减弱。激素诱导鱼类性转化还存在一个耐受阈值,处理强度在此值内对存活率无显著影响,超过这个值就会降低存活率[10]。在黄颡鱼(Pelteobagrusfulvidraco)[11]和斑马鱼(Daniorerio)[12]的雄性化诱导中均表现为MT处理组存活率明显低于对照组,而在七彩神仙鱼(S.aequifasciata)[13]的MT雄性化诱导中激素浓度为40、60 mg/kg其浓度明显高于本试验20 mg/L但对其存活率没有显著影响。还有学者研究发现激素诱导鱼类性转化会造成内脏的损伤[14]。
本试验对白斑狗鱼在出膜30 d前投喂17α-MT出现显著死亡现象分析其原因:第一可能是成功诱导雄性化的仔鱼在后天的养殖过程中因为生存能力较弱而死亡;第二激素诱导的强度过大,超过了白斑狗鱼的耐受阈值;第三可能是激素处理对其内脏造成了不同程度的损伤,致使其生长过程中出现畸形而死亡。出膜40 d投喂组未出现显著死亡可能是其个体较大自身的免疫力较强,具体原因有待进一步研究。因为不同鱼类的最优诱导强度不同,所以关于白斑狗鱼的雄性化诱导强度有待进一步研究。
3.2 各处理组对白斑狗鱼性腺分化的影响
Demska-Zakes等[15]用11β-HA对白斑狗鱼仔鱼进行雄性化诱导浓度为20 mg/kg和30 mg/kg在105 d后复查性别出现了13%,17%的兼性(intersexuality)和74%,83%的雄性比例。随后Luczynski等[16]做了17α-MT对雌核发育的白斑狗鱼雄性化诱导试验,浓度分别为20,30,60 mg/kg,结果出现了13%,17%,24%,76%的兼性和16%,76%,77%,87%的雄性比例,由此确定白斑狗鱼是雄性配子异型(XY)的染色体性别决定类型并总结白斑狗鱼雄性化诱导的最佳浓度为30 mg/kg,最佳处理鱼体长度是在26~30 mm。以上研究出现兼性的原因主要有两点:第一激素处理强度过大主要表现为激素浓度过高,第二在诱导时性腺已经开始分化。本试验中对照组与试验组均出现了不同程度的兼性,而以上研究对照组未出现兼性现象。分析试验组出现兼性的原因也有两点:第一白斑狗鱼性腺的自然分化过程就存在兼性现象,第二激素处理强度过大主要表现为处理持续时间过长。
白斑狗鱼在食物充足的自然水体中雄鱼产生精子在1龄,雌鱼卵母细胞开始积聚卵黄在2龄,体长在29~36 cm[17]。本试验白斑狗鱼在7月龄性腺处于不成熟阶段,但雄鱼产生了精子,说明17α-MT促进了生殖细胞的发展。刘少军[18]在对革胡子鲶(Clariaslazera)雄性化诱导中指出MT对精巢具有雄性催熟作用。喂药的四个试验组中的雌性仔鱼性腺的横切面积较小,卵母细胞个体较小数量较少,其原因可能是MT在对精巢具有雄性催熟作用的同时对卵巢的发育具有一定的抑制作用,赵春刚等[19]在斑马鱼性腺发育的研究中发现外源雄性激素对雌性斑马鱼的性腺发育影响明显,较高剂量时可导致外源激素的阉割作用。
试验结果显示,除试验组1外其它各试验组的雄性率相差不大并且与乙醇组雄性率较为接近(10%,8.5%,6.3%,8.2%),但均表现出低于空白组雄性率(26.3%)。那么反之就是实验2、3、4组和乙醇组的雌性率与兼性率之和要高于空白组的雌性率与兼性率之和,分析其原因有两点:第一20 d后喂药组对其转雄的作用由于性腺已经开始分化而减弱,使其产生了更多的兼性和雌性;第二是无水乙醇也具有一定的雄性化作用,但由于未达到适宜的浓度和作用时间点使其转雄的作用减弱而产生了更多的兼性和雌性。陈本德[20]在MT诱导雌核发育鲫鱼雄性化研究中通过3年的重复试验证明了1 mL/g的95%工业酒精能使雌核发育鲫鱼60%~84.6%成功转雄。但是关于酒精对性腺分化影响的研究较少,本试验的乙醇对照具体作用原因还有待进一步研究。
3.3 白斑狗鱼特殊的性腺分化方式
硬骨鱼类性腺分化方式多种多样。主要可分为三大类:雌雄同体、雌雄异体、兼性。而雌雄同体又可分为连续型雌雄同体和同步性雌性同体;雌雄异体也可分为两种,分化型雌雄异体和未分化型雌雄异体,需要注意的是未分化型雌雄异体又表现出两种不同的类型,雄性先熟型和雌性先熟型[21-22]。兼性是指性腺中既含有精巢组织又含有卵巢组织只是各自所占的比例不同,并且能够产生有活性的卵子或精子[22]。兼性是雌雄异体鱼类中一种少见的现象,在野生种群中兼性的概率仅为0.02,目前认为出现兼性的原因为环境因子对性腺的影响或是性腺内生殖细胞的变异[21]。
Maack等[23]对斑马鱼(Daniorerio)性腺分化组织学形态学研究表明,仔鱼在5周龄时有87%的鱼性腺分化处于核仁周边期卵母细胞,而从5周龄开始一些鱼性腺中卵母细胞数量减少尺寸变小嗜碱性增强,最终退化,在11周龄有40%的性腺发育为早期精巢。皇家丝鲈(Grammaloreto)[24]性腺分化方式也与此类似,并且它们的性腺分化方式都属于未分化型雌雄异体。
本试验中各组白斑狗鱼性腺中均出现了精巢组织与卵巢组织共存的现象,并且7月龄的白斑狗鱼性腺中的卵母细胞均处于第二时相卵母细胞。在试验组与对照组中均观察到不同程度的卵母细胞染色加深(嗜碱性增强)发生皱缩,说明卵母细胞有退化的迹象,可能在向精巢发展。这种分化现象与以上研究结果类似,由此判断白斑狗鱼性腺分化方式可能也属于未分化型雌雄异体型。作者在进行白斑狗鱼雄性化诱导试验的同时也进行了白斑狗鱼性腺自然分化规律的研究(另文发表),结果表明在性腺分化过程中确实存在大量的类卵巢结构,在196 d时出现大量的精巢组织与卵巢组织共存的现象。
4 结论
本试验证明用经浓度为20 mg/L 17α-MT浸泡的饵料连续投喂30 d对白斑狗鱼有明显的致死效应;在进行性腺的组织学分析时发现白斑狗鱼的性腺分化存在一个兼性的分化过程,这种分化类型的特点与未分化型雌雄异体鱼类相吻合。对于未分化型雌雄异体鱼类性别控制由于其性别分化的特殊性,在性别分化时存在一个自身的性别转化过程,如果要成功地控制其性别比例就要找到其雌性和雄性转变的时间节点,在这个分化的节点对其进行激素诱导方可获得较好的效果。白斑狗鱼的性腺分化转雄的时间节点应该在出膜后10-20 d。
[1]郭 焱.新疆鱼类志[M].乌鲁木齐:新疆科学技术出版社,2012:19-23.
[2]Robert M N,David W W,Steven M,et al.Seasonal growth of northern pike (EsoxIucius)in a south dakota glacial lake[J].J Freshw Ecol.1994,9 (3):191-196.
[3]Carole1 C R,Bruno1 J,Patrick K,et al.Sex control and sex determinism study in Eurasian perch,Perca fluviatilis,by use of hormonally sex-reversed male breeders[J].Aquaculture,2002,211(1):81-89.
[4]陈兴汉,刘晓春,蒙子宁,等.温度调控诱导尼罗罗非鱼仔鱼雄性化的研究[J].中山大学学报(自然科学版),2013,52(1):94-99.
[5]Chu Z J,Wu Y X,Gong S Y,et al.Effects of estradiol valerate on steroid hormones and sex reversal of female rice field eel,Monopterus albus (Zuiew)[J].J World Aquac Soc,2011,42(1):96-104.
[6]Luo K K,Xiao J,Liu S J,et al.Massive production of all-female diploids and triploids in the crucian carp[J].Int J Biol Sci,2011,7(4):487-495.
[7]Pandian T J,Sheela S G.Hormonal induction of sex reversal in fish[J].Aquaculture,1995,138(1):1-22.
[8]楼允东.鱼类育种学[M].北京:中国农业出版社,2001.
[9]Yamamoto T,Kajishima T.Sex differentiation [M]//Hoar W,Randall D.Fish Physiology.Academic Press,1969:117-175.
[10]Blazquez M,Zanuy S,Carrillo M,et al.Structural and functional effects of early exposure to estradiol-17β and 17α-ethynylestradiol on the gonads of the gonochoristic teleost dicentrarchus labrax[J].Fish Physiol Biochem,1998,18(1):37-47.
[11]姚道霞.黄颡鱼性分化及激素诱导性转化研究[D].哈尔滨:东北林业大学,2007.
[12]范 鹏.甲基睾酮(MT)对雌性及未性分化斑马鱼(Daniorerio)的影响[D].哈尔滨:东北农业大学,2009.
[13]徐亚飞.七彩神仙鱼的性腺发育及17α-甲基睾丸酮对其性腺发育影响的初步研究[D].上海:上海海洋大学,2014.
[14]Overbeeke A P V,McBride J R.Histological effects of 11-ketotestosterone,17α-methyl testosterone,estradiol,estradiol cypionate,and cortisol on the interrenal tissue,thyroid gland,and pituitary gland of gonadectomized sockeye salmon (Oncorhynchus nerka)[J].Can J Fish Aquat Sci,1971,28(4):477-484.
[15]Demska-Zakes K,Krol J,Luczynski M J,et al.Masculinization of northern pike fry using the steroid 11 β-hydroxy androstenedione[J].N Am J Aquac,2000,62(4):294-299.
[16]Luczynski M J,Demska-Zakes K,Dabrowski K,et al.Masculinization of gynogenetic northern pike juveniles using 17 α-methyltestosterone[J].N Am J Aquac,2003,65(3):255-259.
[17]Treasurer J W.The Annual reproductive-cycle of PIKE,Esox-luciusL,in 2 scottish lakes[J].J Fish Biol,1990,36(1):29-46.
[18]刘少军.甲基睾丸酮诱导革胡子鲇雄性化试验及性腺观察[J].湖南师范大学自然科学学报,1991,(4):346-350.
[19]赵春刚,范 鹏,刘 奕,等.甲基睾酮对雌性斑马鱼性腺发育的抑制作用[J].东北农业大学学报,2010,41(12):70-74.
[20]陈本德.甲基睾丸酮诱导鲫鱼雌核发育子代性转化的研究[J].水产学报,1982,(2):147-152.
[21]游秀容.大黄鱼原始生殖细胞发生、迁移及性腺性别分化的组织学研究[D].福建厦门:集美大学,2012.
[22]苏 敏.黑脊倒刺鲃胚胎、幼鱼的发育及原生殖细胞的起源、迁移和分化的研究[D].福州:福建师范大学,2003.
[23]Maack G,Segner H.Morphological development of the gonads in zebrafish[J].J Fish Biol,2003,62(4):895-906.
[24]Asoh K,Shapiro D Y.Bisexual juvenile gonad and gonochorism in the fairy basslet,gramma loreto[J].Copeia,1997,(1):22-31.
