胎儿超声结构畸形与染色体微阵列分析的相关性
2018-01-27王咏梅
王咏梅
曹 荔1 CAO Li
吴 云1 WU Yun
查 文1 ZHA Wen
王 艳2 WANG Yan
胎儿结构畸形与染色体异常密切相关,随着产前超声诊断技术的发展,越来越多的胎儿结构畸形可在产前被发现[1]。染色体微阵列分析(chromosomal microarray analysis,CMA)是产前检测新技术,又称为分子核型分析,其能进行染色体非整倍体检测,还可以对微缺失或微重复等染色体异常进行检测,而微重复或微缺失是胎儿结构畸形和智力障碍的重要因素,传统核型分析无法检测[2]。本研究拟分析胎儿超声结构畸形与CMA结果的相关性,为建立胎儿结构畸形的产前诊断流程提供可靠的理论依据。
1 资料与方法
1.1 研究对象 选取2016年1月1日-2017年5月1日于南京医科大学附属妇产医院行产前超声筛查显示胎儿结构畸形并行CMA检测的孕妇104例,孕周22~28周,年龄19~46岁,平均(32.6±4.2)岁。
1.2 仪器与方法 采用Siemens Sequoia 512、Philips iU22、GE E8、Philips EPIQ7型彩色多普勒超声诊断仪,探头频率3.0~5.0 MHz,常规超声检测胎儿生长指标后进行胎儿结构筛查,记录胎儿畸形并留存图像。所有孕妇均在超声引导下进行经腹羊膜腔穿刺,抽取10 ml羊水行CMA检测,采用单核苷酸多态性芯片技术进行全基因组拷贝数变异检测。
1.3 诊断标准及分组 胎儿结构畸形的超声诊断标准参照李胜利[3]提出的胎儿先天发育异常标准。104例孕妇按CMA结果分为致病组、Vous(临床意义不明的染色体拷贝数的微缺失和微重复,variants of unknown significance,Vous)组及正常组。
1.4 统计学方法 采用SPSS 17.0软件,计数资料的组间比较采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 CMA检测成功率 104例孕妇均穿刺成功并取得CMA检测结果,成功率为100%。
2.2 孕妇临床资料 高危孕妇共17例(16.34%),包括4例染色体异常胎儿,其中单纯高龄8例,其他高危情况9例,包括不良孕产史、唐筛高风险、夫妻双方核型异常等高危因素。
2.3 超声与CMA结果对照 104例胎儿超声结构畸形种类涉及多个系统,如颜面部异常、消化道异常、心血管异常、中枢神经系统异常、肢体异常等(图1~6)。以心脏畸形最为多见,其中复杂性先天性心脏病53例(50.96%),包括心内膜垫缺损、大动脉转位、左心发育不良综合征、法洛四联症、右心室双出口等。CMA检测结果显示致病组15例(14.42%),Vous组28例(26.92%),正常组61例(58.65%)。致病组中,非整倍体胎儿9例,微缺失或微重复胎儿6例。致病组中,12例涉及2个及以上系统畸形,其中最常见的为复杂性先天性心脏病,有9例;其次为鼻骨缺失或发育不全,有4例,见表1。超声结构畸形的数目与CMA分组对照显示致病组多为2个及以上系统畸形,而正常组与Vous组则多为单系统畸形,3组间差异有统计学意义(χ2=17.34,P<0.01);致病组与Vous组、致病组与正常组比较,差异均有统计学意义(均P<0.01);正常组与Vous组比较,差异无统计学意义(P>0.05),见表2。

图1 31岁,孕26周,鼻骨缺失 (箭)
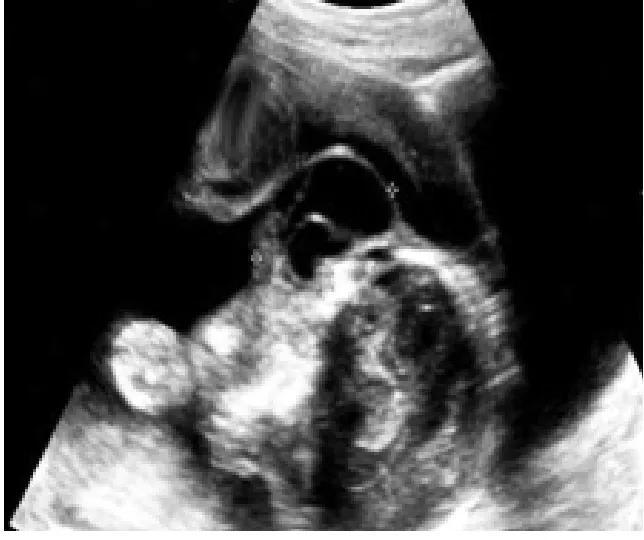
图2 22岁,孕23周,一侧颈部淋巴管囊肿(箭)

图3 29岁,孕24周,足内翻(箭)
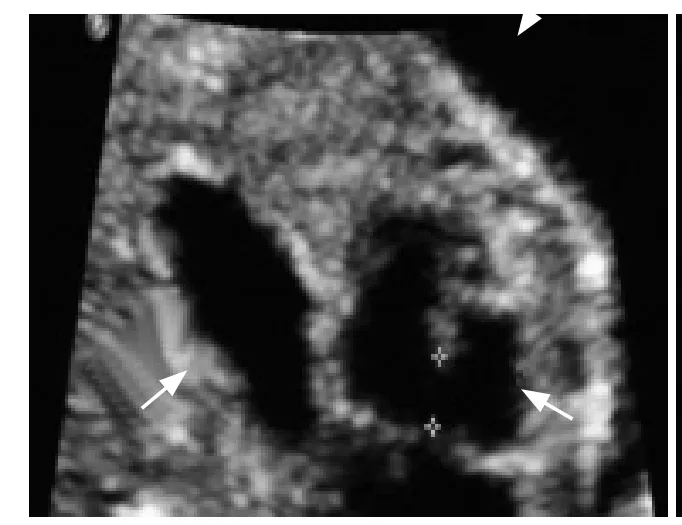
图4 32岁,孕24周,膈疝、室间隔缺损(箭)
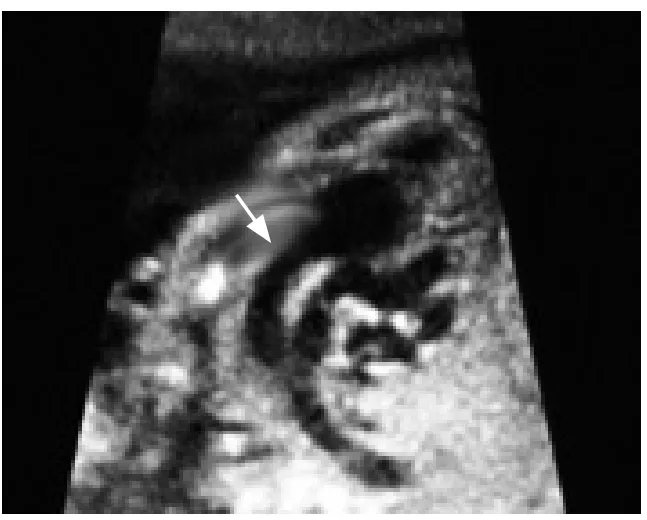
图5 25岁,孕24周,心底两大动脉平行,主动脉发自右心室,肺动脉发自左心室(箭,大动脉转位)

图6 28岁,孕23周,主动脉骑跨于室间隔之上(箭,法洛四联症)

表1 致病组15例胎儿CMA及超声结构畸形的种类

表2 104例超声结构畸形的数目与CMA分组比较(例)
3 讨论
3.1 胎儿染色体异常的产前诊断现状 染色体异常是引起人类出生缺陷的重要原因,占活产婴儿总数的0.5%,以三体综合征及45XO等非整倍体染色体异常最常见。在产前诊断中,无创伤、可重复的超声筛查占绝对优势[4],它能够在产前发现一些染色体异常所致畸形或相关征象,以辅助筛查高危病例,再通过介入性的产前诊断来确诊染色体异常。以往对于染色体异常胎儿的确诊主要依靠传统的核型分析,但其只能检测5~10 Mb以上的染色体片段重复和缺失,而且对致病性的染色体异常检出率低[5]。CMA除能检测染色体非整倍体外,还能检测微缺失或微重复等异常,显著提高染色体异常的检出率[6-7]。国外有学者认为在产前超声发现胎儿超声结构畸形时,CMA的染色体异常检出率明显高于常规核型分析[8-10]。本研究也证实了这种观点,致病组15例胎儿中,微缺失或微重复胎儿6例,通过常规核型分析无法检测,而这些致病性的微缺失或微重复又是胎儿结构畸形和智力障碍的重要因素。Miller等[11]认为CMA的应用使得先天性心脏病胎儿染色体异常的检出率提高到15%~20%。本研究通过分析致病组胎儿的结构畸形种类发现14例胎儿均有明显的结构畸形,超声诊断价值较大;而1例超X综合征仅存在小的室间隔缺损,并未合并其他畸形,可能产前超声对此类疾病诊断价值不大,与杨文娟等[12]的研究结果一致。
3.2 孕妇临床资料分析 本研究中,高危孕妇共17例(16.34%),经CMA检测发现4例染色体异常胎儿,高危因素包括高龄8例,其他高危情况9例,为不良孕产史、唐筛高风险、夫妻双方核型异常等。因此,高危孕妇如合并结构畸形应行CMA检测排除致病性染色体异常。有学者建议将CMA 作为高危孕妇产前诊断的一线检测技术[8-10],但其可行性尚待探讨,且CMA技术在平衡性染色体重排等方面仍无法取代传统的核型分析。
3.3 胎儿超声结构畸形与CMA结果的相关性
3.3.1 结构畸形数目与染色体异常的相关性 本研究104例胎儿中,超声显示2个及以上系统的结构畸形46例(44.23%),其他为单发畸形。CMA检测共发现15例(14.42%)致病组胎儿,其中12例为2个及以上系统的畸形,仅3例为单一结构畸形。因此,产前超声筛查如发现2个及以上系统的结构畸形需行CMA检测排除致病性染色体异常。
3.3.2 结构畸形种类与染色体异常的相关性
3.3.2.1 复杂性先天性心脏病与染色体异常的相关性104例胎儿涉及多个器官畸形,其中以心血管畸形最多见,复杂性先天性心脏病53例(50.96%),存在染色体异常9例(8.65%)。致病组15例胎儿中,7例(46.66%)为复杂性先天性心脏病合并心外畸形,仅2例不合并心外畸形,1例为21三体,1例为微缺失。因此本研究认为先天性心脏病胎儿如合并心外畸形,其染色体异常发生率明显增高,与Shaffer等[13]的研究结果一致。
3.3.2.2 鼻骨缺失与染色体异常的相关性 Ting等[14]认为单发的鼻骨缺失意义不大,但如果合并其他器官畸形将显著增加染色体异常的风险。本研究也证实了这种观点。本组3例单发的鼻骨缺失胎儿染色体均正常,而合并其他器官畸形的5例鼻骨缺失胎儿仅1例染色体无异常,2例为21三体,2例为18三体。胎儿鼻骨缺失的超声诊断,需至少在2个切面均未显示鼻骨回声才可诊断。早孕期除正中矢状面外,还需经冠状面观察鼻后三角,中晚孕期则应增加鼻骨的横切面。Martinez-Ten等[15]还提出通过三维超声来观察胎儿鼻后三角的完整性,评估鼻骨发育情况。因此,超声诊断胎儿鼻骨缺失需谨慎,应多切面扫查,必要时需结合三维超声辅助诊断。此外,对于胎儿鼻骨缺失的遗传咨询,即使CMA检测染色体无异常也需告知孕妇,新生儿有可能出现呼吸障碍的风险,严重者甚至因无法自主呼吸而死亡。
总之,产前超声筛查2个及以上系统胎儿结构畸形的染色体异常检出率高;复杂性先天性心脏病或鼻骨缺失合并其他系统畸形胎儿的染色体异常风险增高;高危孕妇合并胎儿结构畸形,染色体异常风险也相应增高。因此产前诊断遇到此类咨询,均应建议行CMA检测以确定胎儿是否为致病性染色体异常。本研究因样本量偏小,对于不同类型复杂性先天性心脏病的种类与致病性染色体异常的相关性有待进一步深入研究。
[1]吴怡, 王彦林, 韩旭, 等. 胎儿畸形与染色体异常的关系.中国实用妇科与产科杂志, 2013, 29(10): 808-812.
[2]Ahn JW, Mann K, Walsh S, et al. Validation and implementation of array comparative genomic hybridisation as a first line test in place of postnatal karyotyping for genome imbalance. Mol Cytogenet, 2010, 3(1): 9.
[3]李胜利. 胎儿畸形产前超声诊断学. 北京: 人民军医出版社,2004: 123-589.
[4]潘玉萍, 蔡爱露, 赵一理. 产前超声软标志筛查胎儿染色体异常的价值. 中国临床医学影像杂志, 2011, 22(1): 31-33.
[5]Jansen FA, Blumenfeld YJ, Fisher A, et al. Array comparative genomic hybridization and fetal congenital heart defects: a systematic review and meta-analysis. Ultrasound Obstet Gynecol, 2015, 45(1): 27-35.
[6]Dhillon RK, Hillman SC, Morris RK, et al. Additional information from chromosomal microarray analysis (CMA)over conventional karyotyping when diagnosing chromosomal abnormalities in miscarriage: a systematic review and metaanalysis. BJOG, 2014, 121(1): 11-21.
[7]Geng J, Picker J, Zheng Z, et al. Chromosome microarray testing for patients with congenital heart defects reveals novel disease causing loci and high diagnostic yield. BMC Genomics, 2014, 15(1): 1127.
[8]Hillman SC, Mcmullan DJ, Hall G, et al. Use of prenatal chromosomal microarray: prospective cohort study and systematic review and meta-analysis. Ultrasound Obstet Gynecol, 2013, 41(6): 610-620.
[9]Wapner RJ, Martin CL, Levy B, et al. Chromosomal microarray versus karyotyping for prenatal diagnosis. N Engl J Med, 2012, 367(23): 2175-2184.
[10]Lee CN, Lin SY, Lin CH, et al. Clinical utility of array comparative genomic hybridisation for prenatal diagnosis: a cohort study of 3171 pregnancies. BJOG, 2012, 119(5): 614-625.
[11]Miller DT, Adam MP, Aradhya S, et al. Consensus statement:chromosomal microarray is a first-tier clinical diagnostic test for individuals with developmental disabilities or congenital anomalies. Am J Hum Genet, 2010, 86(5): 749-764.
[12]杨文娟, 吴青青, 王莉, 等. 胎儿超声软标记、结构畸形与染色体异常的相关性研究. 中华医学超声杂志(电子版),2011, 8(1): 64-71.
[13]Shaffer LG, Rosenfeld JA, Dabell MP, et al. Detection rates of clinically significant genomic alterations by microarray analysis for specific anomalies detected by ultrasound. Prenat Diagn, 2012, 32(10): 986-995.
[14]Ting YH, Lao TT, Lau TK, et al. Isolated absent or hypoplastic nasal bone in the second trimester fetus: is amniocentesis necessary? J Matern Fetal Neonatal Med, 2011, 24(4): 555-558.
[15]Martinez-Ten P, Adiego B, Perez-Pedregosa J, et al. Firsttrimester assessment of the nasal bones using the retronasal triangle view: a 3-dimensional sonographic study. J Ultrasound Med, 2010, 29(11): 1555-1561.
