乙肝标志物定量测定试剂盒的性能验证及临床应用评价
2018-01-26林健聪王红翠吴英松董志宁李志雄
林健聪 王红翠 吴英松 董志宁 李志雄★
乙型肝炎(hepatitis B)是由乙型肝炎病毒(hepatitis B virus,HBV)引起的全球性流行的传染性疾病。近年来,世界感染乙型肝炎的人数和因乙型肝炎死亡的人数与日俱增。据世界卫生组织(World Health Organization,WHO)报道,全球约有2.57亿乙肝病毒感染者,仅2015年就有88.7万人死于乙型肝炎导致的并发症,如肝衰竭、肝硬化和肝细胞癌等。其中,乙型肝炎在世界卫生组织西太平洋区域和非洲区域的成年人口感染率分别为6.2%和6.1%[1]。我国也是乙型肝炎的重灾区,据估计全国约有9 300万人携带乙肝病毒,其中慢性乙型肝炎患者约2 000万例[2]。另外,据2014年全国1~29岁人群乙型肝炎血清流行病学调查结果显示,1~4岁、5~14岁和15~29岁人群HBsAg流行率分别为0.32%、0.94%和4.38%[3]。
乙型肝炎作为一个极其严重的世界卫生问题,能正确、及时地诊断出其感染的情况,对乙型肝炎的预防控制、及早治疗和疗效观察具有重要的意义。乙型肝炎病毒血清标志物(hepatitis B virus markers,HBV⁃M)是诊断乙型肝炎感染和机体免疫状态的常见标记物[4],通常包括乙型肝炎病毒表面抗原(HBsAg),乙型肝炎病毒表面抗体(抗HBs)、乙型肝炎病毒e抗原(HBeAg)、乙型肝炎病毒e抗体(抗HBe)及乙型肝炎病毒核心抗体(抗HBc),俗称乙肝五项或乙肝两对半。
近年来,随着时间分辨免疫分析、化学发光免疫分析等灵敏度高、线性范围宽的定量检测技术的发展,国内的诊断试剂厂商也开始推出关于HBV⁃M定量检测的试剂盒。本研究拟根据WS/T 420⁃2013[5]技术标准的要求,对国产全自动化学发光免疫分析系统配套的HBV⁃M定量检测试剂盒进行定量分析性能评估,并与国内外主流的雅培HBV⁃M全自动磁微粒化学发光试剂盒进行平行比对,以评价国产全自动化学发光HBV⁃M定量检测试剂盒的定量分析性能及其临床应用价值。
1 材料和方法
1.1 标本来源
本研究涉及的标本均来源于广州军区广州总医院收集的门诊患者的血液标本,收集时间段为2016年6月至2016年12月,所有标本均为患者静脉取血后,经离心分离得到的血清标本,标本放置-20℃储存。
HBsAg、抗HBs和抗HBc项目的参考物质来源于WHO的国际标准物质,分别为NIBSC Code:12/226(HBsAg),07/164(抗 HBs)和 95/522(抗HBc)。HBeAg和抗HBe项目的参考物质来源于德国 Paul⁃Ehrlich⁃Institut研究所的标准物质,分别为 PEI code:129097/12(HBeAg)和 129095/12(抗HBe)。
1.2 仪器与试剂
美国 Abbott Laboratories(以下简称“Abbott”)的全自动免疫分析仪ARCHITECT i2000sr及配套的Abbott HBV⁃M试剂盒、校准品和专用质控品。厦门优迈科医学仪器有限公司的全自动化学发光免疫分析仪Caris200,配套广州市达瑞生物技术股份有限公司(以下简称“达瑞生物”)的HBV⁃M定量检测试剂盒和专用的质控品。
1.3 方法步骤
1.3.1 HBV⁃M试剂定标
根据Abbott和达瑞生物的HBV⁃M系列试剂盒的要求,使用定标品进行定标,定标合格后,再进行下一步的检测操作,且每天进行测试前,测定质控品浓度,保证定标曲线的可靠性。
1.3.2 精密度的验证
用达瑞生物的HBV⁃M系列试剂盒,测定其专用的质控品,连续测试5天,每天重复测量3次。计算检测结果的重复标准差和期间标准差,并与厂家标示的精密度变异系数转化的标准差进行比对,判断试剂盒的精密度是否符合要求。
1.3.3 正确度的验证
本研究采用 WHO 和德国 Paul⁃Ehrlich⁃Institut研究所的标准物质作为参考物质,进行正确度验证实验。各项目的参考物质共稀释成3个浓度梯度,且其中浓度值1为试剂盒的临界值(Cut off值,CO值)。使用达瑞生物的HBV⁃M系列试剂盒测定不同浓度梯度的参考物质,连续测试5天,每天重复测量2次。计算参考物质的偏移值、偏移验证区间,并判断试剂盒的正确度是否符合要求。
1.3.4 线性(测量区间)的验证
线性(测量区间)验证的研究,选用接近试剂盒预期测定上限(线性范围上限)的高浓度标本,再用试剂盒临界值附近的低浓度标本,稀释成不同浓度的标本,具体稀释过程见表1、表2。

表1 HBsAg、HBeAg的线性(测量区间)实验标本的制备Table 1 Preparation of the linear specimen of HBsAg and HBeAg

表2 抗HBs、抗HBe、抗HBc的线性(测量区间)实验标本的制备Table 2 Preparation of the linear specimen of Anti⁃HBs,Anti⁃HBe and Anti⁃HBc
线性(测量区间)验证的标本制备完成后,用达瑞生物对应项目的HBV⁃M系列试剂盒进行测定,每份样本重复测定5次,计算均值。根据标本稀释度和测量浓度均值,作线性回归图,并计算相关系数r值和各浓度标本的差异值,要求相关系数r值或其平方R2大于0.995,且各浓度标本的差异值在厂家标示的允许差异百分数(差异限)内。
1.3.5 样本比对试验
采用达瑞生物和Abbott的HBV⁃M系列试剂盒,同步测定 HBsAg、抗 HBs、HBeAg、抗 HBe、抗HBc项目的标本,其中HBsAg的标本133例,抗HBs的标本219例,HBeAg的标本159例,抗HBe的标本163例,抗HBc的标本165例。检测结束后,统计分析达瑞生物、Abbott 2种HBV⁃M试剂盒的符合率和测值相关性。
1.3.6 统计学方法
精密度、正确度、线性(测量区间)的验证,按照 WS/T 420⁃2013[5]的要求进行统计分析。其他数据采用SPSS18.0软件进行统计分析,测值的差异性,通过配对t检验进行评价,P<0.05为差异有统计学意义。
2 结果
2.1 精密度的验证结果
达瑞生物的HBV⁃M系列试剂盒,厂家标示的重复精密度变异系数为8%,期间精密度变异系数为10%。使用其试剂盒,测定专用的质控品,连续测试5天,每天重复测量3次,得到的总精密度变异系数均不大于8%,其重复标准差(Sr)和期间标准差(Sl)均小于厂家标示精密度变异系数转化成的重复标准差(σr)和期间标准差(σl),详见表3。

表3 达瑞生物HBV⁃M系列试剂盒精密度验证结果Table 3 The results of precision verification of HBV⁃M kit
2.2 正确度的验证结果
使用达瑞生物的HBV⁃M系列试剂盒测定各项目不同浓度梯度的参考物质,连续测试5天,每天测量2次。参考物质是来源于WHO或德国Paul⁃Ehrlich⁃Institut研究所的标准物质,无标示不确定度,故将参考物质测量偏移值的验证区间与参考物质的赋值进行对比,对比结果显示,参考物质的赋值在偏移值的验证区间范围内,表明厂家标示的HBV⁃M系列试剂盒的正确度可靠,详见表4。偏移值的验证区间根据 WS/T 420⁃2013[4]中8.3.6.3.2的公式进行计算,其中参考物质无标示测量标准的不确定度,设定为0。

表4 达瑞生物HBV⁃M系列试剂盒正确度验证结果Table 4 The results of correct verification of HBV⁃M kit
2.3 线性(测量区间)的验证结果
按表1、表2的方法,配制各项目线性(测量区间)验证实验的标本,再用对应项目的达瑞生物的HBV⁃M系列试剂盒进行测定,重复测定5次,计算均值。以标本的稀释度为横坐标、测定浓度的均值为纵坐标绘制线性回归图,详见图1。其中,HBsAg项目的线性回归方程为:y=236.1x+1.059,R2=0.998;抗HBs项目的线性回归方程为y=908.1x+14.93,R2=0.997;HBeAg项目的线性回归方程为:y=131.2x+0.418,R2=0.999;抗HBe项目的线性回归方程为y=16.87x+0.779,R2=0.997;抗HBc项目的线性回归方程为y=17.59x+1.116,R2=0.997。各项目的线性回归相关系数R2,均大于0.995。另外,再根据公式差异百分数(%)=(测定浓度均值⁃理论浓度)/理论浓度×100%,统计试剂盒测定不同浓度标本的差异百分数,详见表5。
2.4 样本比对的阴阳性检测结果
使用达瑞生物和Abbott的HBV⁃M系列试剂盒,同步测定 HBsAg、抗 HBs、HBeAg、抗 HBe、抗HBc项目的标本。其中,HBsAg项目,达瑞公司和Abbott的总符合率为99.25%;抗HBs项目,达瑞公司和Abbott的总符合率为98.63%;HBeAg项目,达瑞公司和Abbott的总符合率为100%;抗HBe项目,达瑞公司和Abbott的总符合率为98.77%;抗HBc项目,达瑞公司和Abbott的总符合率为100%,统计结果详见表6、表7。
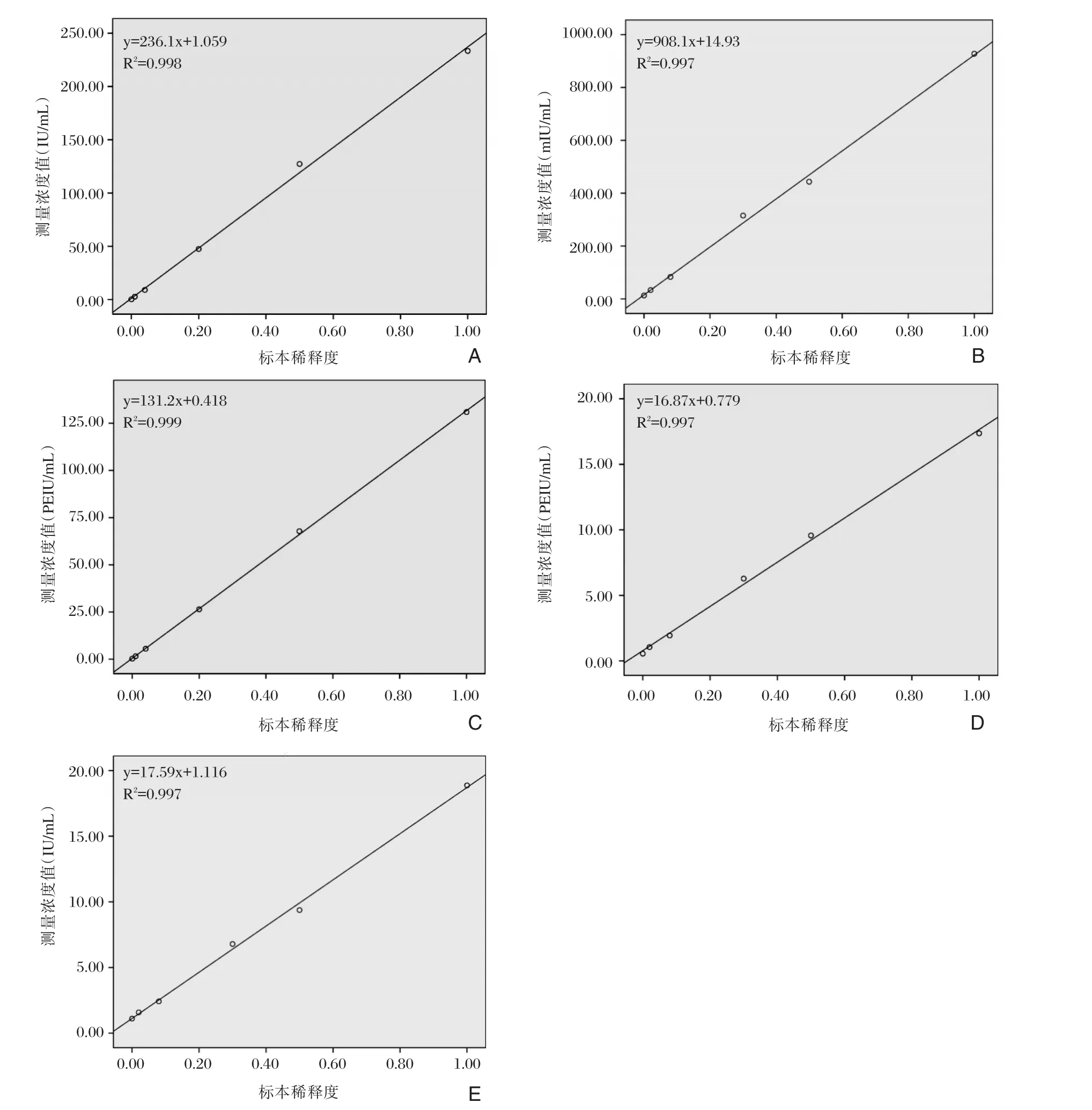
图1 达瑞生物HBV⁃M系列试剂盒线性(测量区间)验证的线性回归图Figure 1 Linear regression diagram of linear verification of HBV⁃M kit
2.5 样本比对的测值相关性分析结果
Abbott的HBV⁃M试剂盒中,HBsAg和抗HBs项目的试剂盒是定量试剂,将达瑞生物试剂的测值与其进行测值相关性的评价。使用SPSS 18.0的软件进行统计分析,以达瑞生物试剂盒的检测结果为横坐标,Abbott试剂盒的测值为纵坐标,对HBsAg、抗HBs的标本检测结果进行相关性分析。HBsAg的相关性系数R2值为0.973,线性回归方程为y=0.981x⁃28.91,两者的检测结果无显著性差异(P>0.05);抗HBs的相关性系数R2值为0.979,线性回归方程为 y=1.016x⁃3.254,两者的检测结果无显著性差异(P>0.05),分析结果见图2、表8、表9。
2.6 差异样本的结果分析
达瑞公司和Abbott的HBV⁃M试剂盒对比,有部分标本的阴阳性判断不一致,使用Roche对应项目的试剂盒进行检测,其中HBsAg、抗HBe项目的检测结果与达瑞生物的一致,且Abbott均为弱阳性测值;抗HBs项目的检测结果,1例与达瑞生物的测值一致,2例与Abbott的测值一致,详细结果见表10。
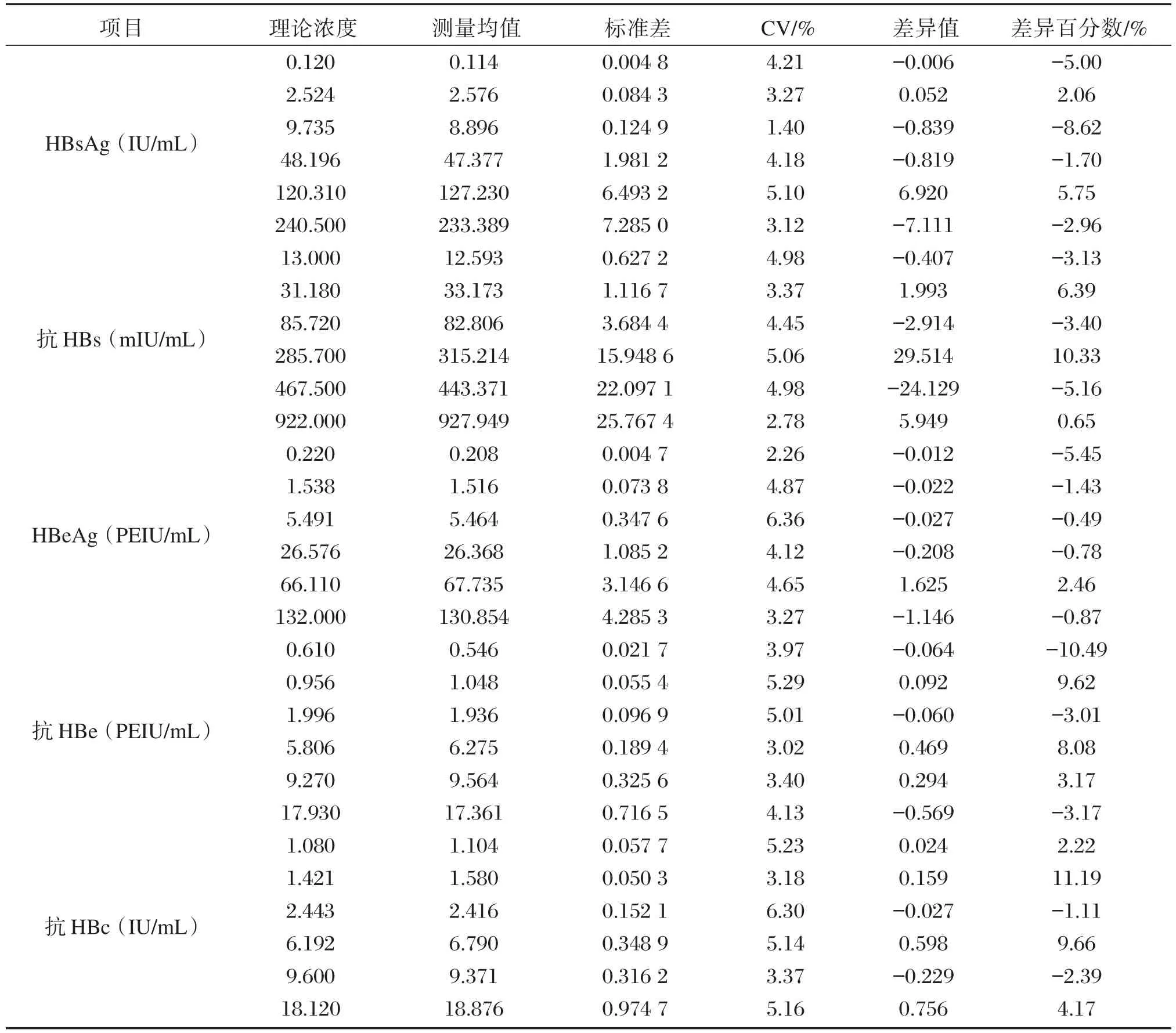
表5 达瑞生物HBV⁃M系列试剂盒线性(测量区间)验证的结果Table 5 The results of linear verification of HBV⁃M kit
3 讨论
HBV⁃M是HBV感染机体后,在体内产生的一系列反映病毒感染状态和机体免疫状态的标志物。其定性检测始于80年代中期,对乙型肝炎的疾病诊断、病程监测、疗效观察等起到了一定的作用[6]。随着定量检测技术的发展,科学家们对HBV⁃M定量检测的研究越来越多,其临床意义及临床指导作用也越来越明确[7]。据李金明教授等[8]的介绍,HBV⁃M 的定性检测和定量检测,其应用目的不同,前者主要用于分析患者HBV感染状态,后者则主要用于抗病毒药物治疗的疗效预测和评估,特别是针对慢性乙型肝炎的治疗。如监控HBsAg的浓度,可评价抗病毒药物的治疗效果和间接反映体内HBV复制的活跃程度等;检测抗HBs的浓度,可反映出机体对HBV抵抗能力的强弱;监控HBeAg的浓度,可判断慢性乙肝病毒携带者是否发病、预测抗病毒治疗的效果、判断抗病毒治疗的终点等[9];测定抗HBe的浓度,可以对慢性乙肝抗HBe定量持续很高的患者进行密切观察,及时给予干预性治疗,避免疾病的加重;测定病人的抗HBc含量,可对HBeAg阳性慢性乙型肝炎患者的聚乙二醇干扰素和核苷(酸)类似物治疗有一定的预测价值[3]。

表6 HBV⁃M系列试剂盒标本检测结果统计表Table 6 The results of specimen of HBV⁃M kit

表7 达瑞生物与Abbott HBV⁃M系列试剂盒符合率结果统计表(%)Table 7 The results of coincidence rate of Darui biotechnology and Abbott HBV⁃M kit(%)

图2 标本测值相关性分析散点图Figure 2 The scatter plot of correlation analysis

表8 HBsAg标本测值配对t检验结果Table 8 The results of t⁃test pairs of HBsAg
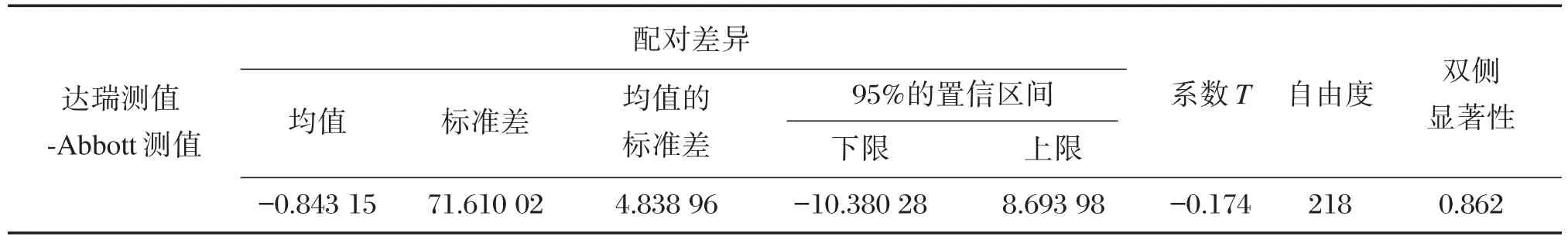
表9 抗HBs标本测值配对t检验结果Table 9 The results of t⁃test pairs of Anti⁃HBs
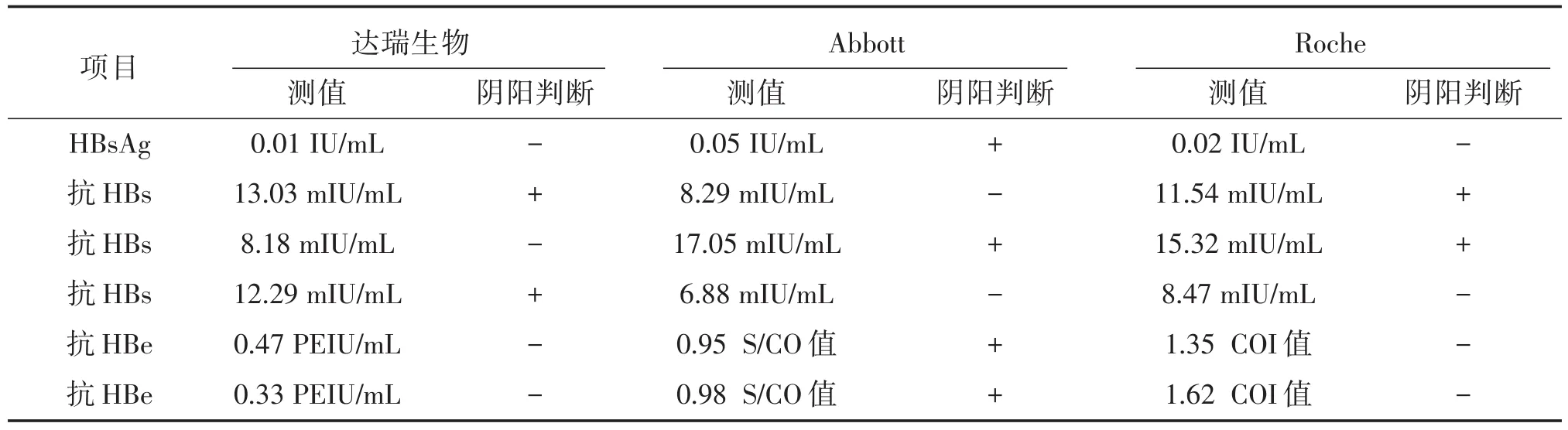
表10 差异样本的检测结果Table 10 The review results of the inconsistant samples
为了满足市场对HBV定量检测的需求,国内越来越多的体外诊断试剂厂家推出相关的试剂产品,试剂的性能参差不齐。对此,本研究选用WS/T 420⁃2013[5]的标准方法,对达瑞生物的 HBV⁃M 定量检测试剂盒的定量检测性能进行了验证。验证结果显示,达瑞生物的HBV⁃M定量检测试剂盒的重复精密度和期间精密度均小于厂家标示的重复精密度和期间精密度;正确度验证中,参考物质的赋值均处于偏移值的验证区间内;线性(测量)区间的验证实验中,各项目的线性回归相关系数R2为0.997~0.999,均大于0.995,且不同浓度标本的差异百分数均不大于20%,符合厂家标示的允许差异百分数。根据 WS/T 420⁃2013[5]的要求可判断,达瑞生物的HBV⁃M定量检测试剂盒的定量分析性能是可靠的。本研究还对达瑞生物与Abbott的HBV⁃M试剂盒检测临床样本的性能进行了对比,结果显示,达瑞生物的 HBsAg、抗 HBs、HBeAg、抗HBe和抗HBc定量检测试剂盒与Abbott相应试剂盒的阴阳性总符合率分别为99.25%、98.63%、100.00%、98.77%、100.00%,说明2种试剂在检测HBV⁃M时的符合性很高。此外,Abbott只有HBsAg、抗HBs项目可以进行定量检测,达瑞生物和Abbott的该项目测值相关系数R2值分别为0.973、0.979,经过配对t检验,两者的检测结果无显著性差异(P>0.05),这说明了2种试剂的测值具有很高的一致性,检测结果具有互通性。据谢而付等[10]的研究显示,Abbott和Roche 2种分析系统在测定HBV⁃M时,具有一定的检测符合率和相关性,而杨凡等[11]则报道了Roche和LIASON化学发光分析系统的HBV⁃M检测结果具有很高的一致性。这说明了进口的化学发光分析系统在检测HBV⁃M技术方面,是比较稳定的。而本研究通过达瑞生物与Abbott的HBV⁃M试剂盒的对比,探讨了国产HBV⁃M化学发光试剂与进口试剂的性能差距,期望能为国产HBV⁃M化学发光试剂的发展提出一些想法。
通过对2种试剂检测结果不一致的样本进行分析,其中抗HBs的检测结果最复杂,达瑞生物、Abbott和Roche等3种试剂盒对3份标本的检测结果不完全一致,该情况与谢而付等[10]的研究结果相符。原因可能是不同的试剂在检测抗HBs时,由于不同厂家使用的活性原料不同、抗HBs产生的原因不同,而导致不同厂家的试剂盒对其反应性存在差异[12]。故抗HBs的阴阳判断,可参考国际上通用的方法,使用多家试剂进行标定,同时结合其他4项HBV⁃M项目的检出结果进行判断[13]。
目前,Abbott、Roche等进口的免疫发光分析系统在国内临床上得到广泛的应用。在提倡减轻患者负担、检验结果互认的情况下,国内新兴的化学发光免疫检测试剂,应与广泛运用的Abbott、Roche等试剂进行对比,并保证较高的符合率和测值相关性。本研究初步验证了达瑞生物HBV⁃M定量检测试剂盒可靠的定量分析性能,且与Abbott同类试剂的对比,具有较高的符合率和测值相关性,因此临床应用价值较高。此外,抗HBs在结果判断,也应引起重视,避免不同试剂测值不一致而难以进行判断的情况。
[1]World Health Organization.Guidelines on Hepatitis B and C Testing[EB/OL].http://www.who.int/hepati⁃tis/publications/guidelines⁃hepatitis⁃c⁃b ⁃testing/en/,2017⁃04/2017⁃10⁃19.
[2]Lu FM,Zhuang H.Management of hepatitis B in Chi⁃na[J].Chin Med J(Engl),2009,122:3⁃4.
[3]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2015年版)[J].实用肝脏病杂志,2016,19(3):1⁃18.
[4]邱华,谭华炳.慢性乙型肝炎病毒感染者健康知识普及研究[J].临床医药文献电子杂志,2016,3(16):3332⁃3334.
[5]中华人民共和国国家卫生和计划生育委员会.WS/T 420⁃2013临床实验室对商品定量试剂盒分析性能的验证[S].北京:中国标准出版社,2013.
[6]刘金涛,曾显坤.乙型肝炎病毒血清学标志物(HBV⁃M)的检出及应用[J].中华医药杂志,2007,7(1):6.
[7]吕迎霞,张学东,于林.乙肝五项定量检测及罕见模式分析[J]. 检验医学与临床,2012,9(14):1820⁃1821.
[8]李金明,张瑞.常用乙型病毒性肝炎血清学标志物检测结果报告解释及临床应用[J].中华检验医学杂志,2012,35(4):296⁃300.
[9]魏来.HBV标志物定量和标准化是临床检测的方向[J]. 中华检验医学杂志,2009,32(9):967⁃970.
[10]谢而付,蒋理,刘雁雁,等.不同化学发光分析系统对乙型肝炎血清标志物检测的比较[C].中华医学会第七次全国中青年检验医学学术会议论文汇编,2012:582⁃584.
[11]杨凡,单咏梅,周宏,等.不同方法学检测乙型肝炎血清标志物结果的评价分析[J].检验医学,2010,25(9):723⁃726.
[12]张学东,张泉,谢惠波,等.不同厂家试剂盒检测人血清乙肝表面抗体浓度值相关性分析[J].科技信息,2009(7):362 ⁃363.
[13]Huzly D,Schenk T,Jilg W,et al.Comparison of nine commercially available assays for quantification of antibody response to hepatitis B virus surface antigen[J].J Clin Microbiol,2008,46(4):1298⁃1306.