渔山列岛海藻场空间分布格局及成因分析
2018-01-26毕远新张亚洲丰美萍王伟定
毕远新,张亚洲,丰美萍,梁 君,王 洋,王伟定
(浙江海洋大学海洋与渔业研究所,浙江省海洋水产研究所,浙江省海洋渔业资源可持续利用技术研究重点实验室,浙江舟山 316021)
渔山列岛地处东海边陲,海洋环境条件优越,生物资源丰富,2008年被列为国家级海洋特别保护区,2012年被认定为国家级海洋公园,2015年被评为首批国家级海洋牧场示范区。海区内清澈透明的水色和众多的岩礁基质为底栖大型藻类的附着生长提供了良好条件,并与其他海洋生物群落共同构成近岸海藻场生态系统。海藻场生态系统与珊瑚礁、海草床、红树林等典型海洋生态系统一样,对维持海洋生物多样性、改善海洋生态环境,以及为多种海洋生物提供摄食、产卵、避敌等栖息场所都起到重要作用[1]。然而,由于受人类活动以及近岸海域环境条件变化等因素影响,全球范围内海藻场出现萎缩和退化的趋势。而在我国东部沿海能够形成海藻场的大型藻类主要由马尾藻属种类构成,已有研究报道了浙江枸杞岛和南麂列岛的海藻场面积已大范围缩减[2-3]。渔山列岛作为东部沿海拥有3个国字号头衔的典型海域,有关海藻场方面的研究鲜见报道,一些学者仅对潮间带大型海藻的种类、分布特征、资源量和季节变化进行了调查研究[4-6],而对于构成海藻场支撑物种的潮下带大型海藻的分布特征、种类组成和生物量等研究尚未见报道。由于渔山列岛海藻场分布及资源量基础调查数据的缺失,这给海洋生态环境变化是否对渔山列岛海区海藻场生态系统带来破坏、海藻场资源量是否衰退及解析其衰退机制、海藻场生态保护和修复策略的提出、以及正确理解海藻场生态系统和生态养护功能等方面都带来了困难。
为探明渔山列岛海域海藻场空间分布格局,本研究从不同空间尺度调查了北渔山岛海藻场支撑物种瓦氏马尾藻和铜藻的分布特征,并测量了不同方位调查站点的暴波强度,通过分析大型海藻在水平和垂直分布上的差异,来解析渔山列岛海域海藻场空间分布格局的成因及海藻场衰退的原因,以期为海藻场的生态保护与修复研究提供依据。

图1 调查站位图Fig.1 Map of the four study sites
1 材料与方法
1.1 调查站点
北渔山岛是渔山列岛两大主岛之一,站点的选取应尽量远离人为干扰区,并根据当地人的经验选择岩礁坡度平缓的区域,在北渔山岛礁周围的东(S1)、南(S2)、西(S3)和北(S4)4个方向上各随机选取1处调查站点,调查站点的位置见图1。
1.2 采样方法
2015年6月初对北渔山岛礁周围海藻场中的支撑物种大型海藻的分布生长情况进行了调查,采用SCUBA(Self-Contained Underwater Breathing Apparatus)潜水的方法进行水下采样并记录。大型海藻分布水深数据从潜水电脑表(MARES NEMO SPORT)上读取,同时记录采样时间。每一站点选取3条样带,样带间隔约为3 m,每一样带垂直于岸线,自有大型海藻分布的水深上限开始选取第一个样方(样方大小30 cm×30 cm),铲除样方内的全部大型海藻装入样袋中。然后再沿样带向下每隔1 m水深采一个样方,直到无大型海藻分布的水深止。大型海藻采回后鉴定种类,并分别测定株数、株高和生物量。
1.3 暴波强度测量
各站点间的暴波强度采用石膏块法测量,通过计算石膏损失量得到各站点受波浪影响程度的相对值[7],这种方法可有效兼顾波浪和水流同时作用的影响。在调查期间,每一站点随机测量3次,每次连续测量24 h后收回,4个方位石膏块都安装在4 m水深。暴波强度指数计算公式为:

式中:EI为暴波指数(无量纲);W1为现场放置石膏块的质量损失(g);W2为静水中放置石膏块的质量损失(g);T1为石膏块在现场放置的时间(h);T2为石膏块在静水中放置的时间(h)。
1.4 数据处理
文中数据使用SPSS13.0软件,采用单因素方差法(One-Way ANOVA)对大型海藻密度、株高指标进行统计分析,以P<0.05作为差异显著性水平,描述性统计值采用平均值±标准误(mean±SE)表示。根据2015年渔山潮汐表,以平均海平面为水深基准面,利用公式法计算采样时刻的采样点水深[8]。大型海藻垂直分布情况按不同水深组进行比较,以平均海平面为水深基准面,因大型海藻在0~1.99 m水深组内无分布,以2.00~2.99 m为第一个水深组,之后每增加1 m为一个水深组。
2 结果与分析
2.1 海藻场水平分布特征
北渔山岛海藻场的支撑物种为瓦氏马尾藻,在岛礁的4个分布方向上,以岛礁的西北向分布最多,在岛礁的东向上分布稀少,在岛礁南向沿采样带左右各20 m的范围内未发现大型海藻植株,而铜藻仅在岛礁北向有零星分布(图2)。瓦氏马尾藻在岛礁北向的密度最大,达到了250 ind/m2,显著高于其他方向密度,生物量也显著高于东向和西向。铜藻仅在岛礁北向有少量分布,平均密度为4 ind/m2,平均生物量为0.21 kg/m2。
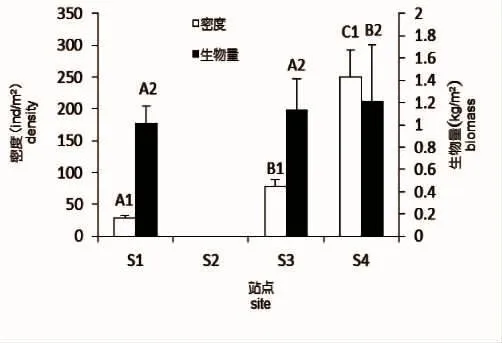
图2 瓦氏马尾藻各方位的平均密度和生物量Fig.2 Average density and biomass of S.vachellianum at four directions
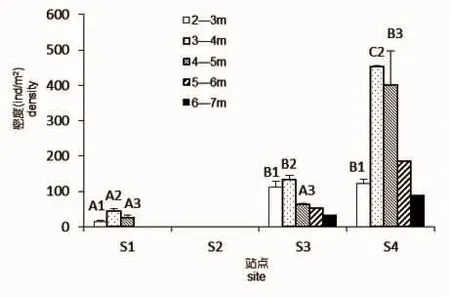
图3 4个方位不同水深组瓦氏马尾藻密度Fig.3 Density of S.vachellianum at different depths of four directions
2.2 海藻场垂直分布特征
除岛南向无瓦氏马尾藻分布外,东、西、北三个方向瓦氏马尾藻在1~2 m水深组均无分布,即瓦氏马尾藻的最高分布水深上限在低潮带下区,三个方向瓦氏马尾藻最高分布上限水深分别为2.95 m、2.17 m、2.35 m,东向瓦氏马尾藻最高分布水深则出现在潮下带。随着水深的增加三个方向瓦氏马尾藻密度均在3~4 m水深组达到最大值,且集中分布在2~5 m的水深范围内,然后随水深增加密度骤减,东向瓦氏马尾藻的分布水深下限在4~5 m水深组,而西和北向则可达到6~7 m水深组,最低分布水深出现在北向的6.35 m处,在垂直分布上呈现出较宽的分布带。岛北向各水深组瓦氏马尾藻密度均显著高于东向各水深组(P<0.05)(图3)。铜藻在岛北向分布上限水深为2.35 m,分布水深下限为5.05 m,随水深增加铜藻密度变化不大,4个水深组铜藻平均密度分别为3 ind/m2、6 ind/m2、4 ind/m2、2 ind/m2。铜藻密度显著低于瓦氏马尾藻密度。
北渔山岛东向瓦氏马尾藻株高随水深增加而增高,3~5 m水深组显著高于2~3 m水深组(图4)。西和北向瓦氏马尾藻株高都以3~4 m水深组为最高,株高平均分别为0.36 m和0.38 m,显著高于其他各水深组,且随着水深的增加株高逐渐降低。在2~5 m的三个水深组范围内,西和北向的瓦氏马尾藻株高显著高于东向三个水深组,而西和北向各水深组间株高差异并不显著。随着水深的增加,铜藻的株高显著降低,4个水深组铜藻平均株高分别为1.21 m、0.91 m、0.31 m、0.27 m。铜藻株高显著高于瓦氏马尾藻。
北渔山岛东、西和北三个方向瓦氏马尾藻分别在3~4 m水深组生物量达到最大值,且以北向生物量最大,达到5.60 kg/m2,北向各水深组的生物量均显著高于东和西向各水深组。随着水深增加各水深组生物量逐渐降低,到6~7 m水深组瓦氏马尾藻生物量降到最低(图5)。随着水深的增加,铜藻的生物量也显著降低,4个水深组铜藻平均生物量分别为0.39 kg/m2、0.31 kg/m2、0.09 kg/m2、0.06 kg/m2。铜藻生物量显著低于瓦氏马尾藻。

图4 4个方位不同水深组瓦氏马尾藻株高Fig.4 Length of of S.vachellianum at different depths of four directions

图5 4个方位不同水深组瓦氏马尾藻生物量Fig.5 Biomass of of S.vachellianum at different depths of four directions
2.3 暴波强度测量结果
北渔山岛东南向暴波强度显著高于西北向暴波强度(P<0.05)(图6),说明瓦氏马尾藻在渔山岛东南向受到波浪和水流的影响大于西北向。
3 讨论
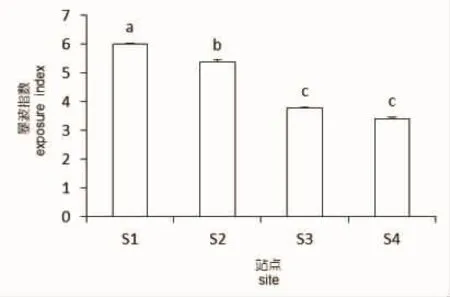
图6 不同方向的暴波指数Fig.6 Exposure index at four directions
3.1 海藻场水平分布格局成因分析
北渔山岛海藻场的支撑物种为瓦氏马尾藻和铜藻,且瓦氏马尾藻的平均密度达到了250 ind/m2,远高于铜藻的密度,是海藻场中的优势种。而这一结果与相近海域的研究正好相反,浙江枸杞岛形成藻场的优势种为铜藻,而瓦氏马尾藻仅在局部地区有小范围的分布[9]。造成这种差异的原因可能与两个海域生态环境状况有关,已有研究表明枸杞岛瓦氏马尾藻藻场生态系统属中度退化,富营养化压力对该藻场生态系统健康状况影响最大[10],虽然针对瓦氏马尾藻分布机制的调查研究极其匮乏,瓦氏马尾藻藻场现今是否已退化尚不清楚,但从同一海区铜藻的分布特征及其受到的环境影响可看出,瓦氏马尾藻也面临着生态环境变化的巨大压力。瓦氏马尾藻和铜藻都是马尾藻属的大型海藻,但生态习性却存在差异,瓦氏马尾藻是我国特有的亚热带性海藻,多年生,而铜藻为北太平洋西部特有的暖温带性海藻,大多为一年生,且铜藻有性生殖产生卵的数量远高于瓦氏马尾藻[11-12],由于枸杞岛更靠近长江口和钱塘江口,导致枸杞岛铜藻孢子体无法附着在沉积物增多的近岸岩礁基质上,使其栖息在近岸浅水区狭窄的分布带上,分布水深出现上移[13]。因此,对于多年生靠营养繁殖的瓦氏马尾藻而言,其抗干扰能力较强,更能够适应生态环境发生的变化,而一旦发生极端破坏事件,可能会造成其种群的灭绝,将难以自然修复,这可能也解释了枸杞岛藻场铜藻占绝对优势的原因。有研究报道了瓦氏马尾藻是浙江省沿岸岛礁的常见种类[14],而近年浙江北部岛礁瓦氏马尾藻数量并不多,也从侧面反映了渔山列岛的生态保护效果较好,瓦氏马尾藻海藻场生态系统相对稳定。
在水平分布方向上,瓦氏马尾藻在岛礁东南向分布稀少、而西北向分布较密集的特点可能与岛礁不同方位受风浪影响的强度有关。已有研究表明中国是世界上登陆台风频率最高、受西北太平洋台风袭击次数最多的国家之一[15],浙江东部海域水深较深、海域开阔,来自东南向的波浪主要在岛礁的东南向产生影响,有效波高可达9~10 m[16]。在高风浪能作用的站点,仅那些具备在藻体形态结构上适应[17]、孢子体能够快速附着[18]、或受损后能快速补充[19]等生物学特征的海藻种类能够存活。由波浪和海流作用产生的拖拽力可将大型海藻移除附着基质[20],尤其是对于那些植株高大且枝叶繁茂的大型海藻来说,受到的水流的拖拽力将会更大。相关研究已表明了大型海藻从幼苗到成藻阶段的密度损失率较高[21],风浪对大型海藻的分布格局产生重要影响[22]。
3.2 海藻场垂直分布格局成因分析
水深是预测底栖大型海藻群落结构最有效的参数[23]。耐干出能力[24]、波浪作用[20]等因素控制着大型海藻的分布上限,而分布下限则受到大型海藻生理因素的限制,如:有效光强限制了大型海藻的光合作用[25],附着基质上沉积物的覆盖则阻碍了大型海藻孢子体的附着[13]。从本文的研究结果中可以看出,北渔山岛瓦氏马尾藻垂直分布范围较宽,且最大分布水深达到了6.35 m,这也是现今环境条件下瓦氏马尾藻实地调查记录到的最大分布水深,而铜藻分布水深下限仅为5.05 m。已有研究表明随着水深的增加,枸杞岛岩礁基质上沉积物数量增多、光照强度降低[26],这些条件不利于铜藻定居生长,说明瓦氏马尾藻比铜藻更能耐受低光照、高沉积物的环境条件。而在浅水区栖息的瓦氏马尾藻则更容易受到波浪移除的影响,2.17 m水深成为北渔山岛瓦氏马尾藻的最高分布上限,2~4 m的水深范围成为瓦氏马尾藻最适宜的栖息水深,在这一狭窄的分布带上,如果不有效保护和改善瓦氏马尾藻的栖息地环境,近岸岛礁区分布的瓦氏马尾藻将处于濒临灭绝的边缘。
尽管本文的调查结果难以直接证明近岸岛礁瓦氏马尾藻分布减少与水域生态环境有关,但近岸水域生态环境的变化已是不可争辩的事实。相关研究结果也表明,由于过去60年间的水体中光照强度的减弱和沉积物的增加[27-28],自上世纪四十年代起大型海藻的最大分布水深已减少[29-30]。保护近岸水域生态环境可能是保护与修复近岸瓦氏马尾藻资源最行之有效的途径。因为北渔山岛较靠近外海,且岛礁面积较小,底栖瓦氏马尾藻受波浪作用的影响势必严重,虽然岛礁附近海域有较高的海水透明度,瓦氏马尾藻能够分布在深水区,本应适宜其生长,但却难见高大植株,最适宜栖息水深的平均株高仅0.38 m,且生物量较低,说明北渔山岛海域生态环境条件还是限制了其生长,一旦瓦氏马尾藻资源受损将很难在海水透明度低、沉积物多的生境中恢复其种群。
3.3 海藻场生态保护与修复的探讨
近年来,由于海洋生态环境的变化,海藻场中的种群结构发生了变化,藻场中的支撑物种也逐渐退化或消失,大型海藻有从多年生种类向周年生种类过度的趋势[31-32],而近岸岩礁栖息地的周年生海藻又逐渐被机会藻类所取代[33]。而在短时间内无法改变受损的大型海藻栖息地生态环境的背景下,若要成功保护和修复大型海藻,必须根据大型海藻的生态习性选择最优的保护和修复策略。本研究通过调查北渔山岛海藻场中支撑物种大型海藻的的分布特征,比较分析了马尾藻属中瓦氏马尾藻和铜藻的分布差异,这些差异也是其在特定生境下生存的重要依据,瓦氏马尾藻在生态习性上比铜藻可能更适宜现有的生态环境。目前,有关瓦氏马尾藻室内繁殖生物学的相关研究已经展开,在掌握其生态习性及分布规律的前提下,可通过人工移植的方法,实现多年生瓦氏马尾藻海藻场的人工修复。
[1]HARROLD C,PEARS J P.The ecological role of Echinoderms in kelp forests[J].Echinoderms Study,1987,2:137-233.
[2]孙建璋,庄定根,王铁杆,等.南麂列岛铜藻场建设设计与初步实施[J].现代渔业信息,2009,24(7):25-28.
[3]陆艳用,马玉心,崔大练,等.中街山列岛保护区底栖海藻分布与资源特征[J].水产科学,2011,30(5):269-275.
[4]王腾飞,蒋霞敏,王稼瑞,等.渔山列岛潮间带大型海藻的分布特征[J].海洋环境科学,2013,32(6):836-840.
[5]阮积惠.渔山列岛潮间带底栖海藻生态的初步研究[J].东海海洋,1994,12(4):48-57.
[6]施慧雄,焦海峰,骆其君,等.渔山列岛潮间带生物生态学初步研究[J].宁波大学学报:理工版,2010,23(4):20-25.
[7]TERRADOS J,DUARTE C M.Experimental evidence of reduced particle resuspension within a seagrass(Posidonia oceanica L.)meadow[J].Journal of Experimental Marine Biology and Ecology,2000,243(1):45-53.
[8]杨守仁.用袖珍计算器求任意时潮高和任意潮高的潮时[J].大连海运学院学报,1981(2):31-36.
[9]章守宇,毕远新,吴祖立.枸杞岛铜藻空间分布格局初探[J].水产学报,2013,37(6):884-893.
[10]柴召阳,霍元子,于克锋,等.枸杞岛瓦氏马尾藻藻场生态系统健康评价[J].海洋环境科学,2013,32(3):386-389.
[11]孙建璋,庄定根,陈万东,等.铜藻Sargassum horneri繁殖生物学及种苗培育研究[J].南方水产,2008,4(2):6-14.
[12]韩军军,白凯强,赵明林,等.瓦氏马尾藻有性繁殖和幼孢子体发育的形态学观察[J].水生生物学报,2016,40(6):1 215-1 220.
[13]BI Yuanxin,FENG Meiping,JIANG Rijin,et al.The effects of sediment on Sargassum horneri in the early life stages on rocky subtidal reefs[J].Aquatic Botany,2016,132(7):17-23.
[14]王伟定.浙江省马尾藻属和羊栖菜属的调查研究[J].上海水产大学学报,2003,12(3):227-232.
[15]曹 楚,彭加毅,余锦华.全球气候变暖背景下登陆我国台风特征的分析[J].南京气象学院学报,2006,29(4):455-461.
[16]黄世昌,赵 鑫,娄海峰,等.浙江沿海超强台风作用下的太风浪波高[J].海洋通报,2012,31(4):369-383.
[17]KOEHL M A R,ALBERTE R S.Flow,flapping and photosynthesis of Nereocystis luetkeana:a functional comparison of undulate and flat blade morphologies[J].Marine Biology,1988,99(3):435-444.
[18]TAYLOR D I,SCHIEL D R.Wave-related mortality in zygotes of habitat-forming algae from different exposures in southern New Zealand:the importance of‘stickability’[J].Journal of Experimental Marine Biology and Ecology,2003,290(2):229-245.
[19]NELSON W A.Distribution of macroalgae in New Zealand:an archipelago in space and time[J].Botanica Marina,1994,37(3):221-234.
[20]PRATT M C,JOHNSON A S.Strength,drag,and dislodgment of two competing intertidal algae from two wave exposures and four seasons[J].Journal of Experimental Marine Biology and Ecology,2002,272(1):71-101.
[21]毕远新,章守宇,吴祖立.枸杞岛铜藻种群分布的季节变化[J].生态学杂志,2013,32(5):1 255-1 259.
[22]毕远新,王伟定.风浪对枸杞岛铜藻(Sargassum horneri)分布格局的影响[J].生态学杂志,2016,35(6):1595-1600.
[23]KAUTSKY H.Quantitative distribution of sublittoral plant and animal communities along the Baltic Sea gradien t[M]//ELFTHERIOU A,Ed.Biology and Ecology of Shallow Coastal Waters.Fredensborg:Olsen and Olsen,1993:23-30.
[24]郭赣林,董双林.干出对潮间带不同垂直位置海藻的生长及光合作用速率的影响[J].海洋湖沼通报,2008,(4):78-84.
[25]BÄCK S,RUUSKANEN A.Distribution and maximum growth depth of Fucus vesiculosus along the Gulf of Finland[J].Marine Biology,2000,136(2):303-307.
[26]毕远新,章守宇,王伟定,等.枸杞岛铜藻垂直分布格局及成因分析[J].生态学报,2014,34(17):4931-4937.
[27]SANDÉN P,HA°KANSSON B.Long-term trends in Secci depth in the Baltic Sea[J].Limnology and Oceanography,1996,41(2):346-351.
[28]JONSSON P,CARMAN R.Changes in deposition of organic matter and nutrients in the Baltic Sea during the Twentieth Century[J].Marine Pollution Bulletin,1994,28(7):417-426.
[29]KAUTSKY N,KAUTSKY H,KAUTSKY U,et al.Decreased depth penetration of Fucus vesiculosus(L.)since the 1940’s indicate eutrophication of the Baltic Sea[J].Marine Ecology Progress Series,1986,28(1-2):1-8.
[30]ERIKSSON B K,JOHANSSON G,SNOEIJS P.Long-term changes in the sublittoral zonation of brown algae in the southern Bothnian Sea[J].European Journal of Phycology,1998,33(3):241-249.
[31]WORM B,LOTZE H K,BOSTRÖM C,et al.Marine diversity shift linked to interactions among grazers,nutrients and propagule banks[J].Marine Ecology Progress Series,1999,185(3):309-314.
[32]WORM B,LOTZE H K,SOMMER U,et al.Algal propagule banks modify competition,consumer and resource control on Baltic rocky shores[J].Oecologia,2001,128(2):281-293.
[33]SUN Jianzhang,NING Xiuren,LE Fengfeng,et al.Long term changes of biodiversity of benthic macroalgae in the intertidal zone of the Nanji Islands[J].Acta Ecologica Sinica,2010,30(2):106-112.
