乳化植物油强化土著微生物修复中高浓度Cr(Ⅵ)污染地下水
2018-01-25刘同喆邓俊巍
董 军,徐 暖,刘同喆,管 锐,邓俊巍
吉林大学环境与资源学院/地下水资源与环境教育部重点实验室,长春 130021
0 引言
铬是一种具有氧化还原活性的重金属,主要以Cr(Ⅲ) 和Cr(Ⅵ)两种形式存在于环境中,其中Cr(Ⅵ)具有毒害性强、易迁移、致癌、致突变性等特性,被许多国家列为“优先污染物”[1]。目前,由于工业生产过程中产生的含Cr(Ⅵ)废水和废渣处置不当,造成局部地区地下水Cr(Ⅵ)污染严重[2];因此,对Cr(Ⅵ)污染的地下水进行修复已迫在眉睫。原位生物修复作为一种低成本、易管理的修复方法备受青睐。其原理是通过外加营养物质,刺激强化土著微生物 (铬还原菌、铁还原菌等) 直接或间接地将低质量浓度(低于10 mg/L)的Cr(Ⅵ) 还原为Cr(Ⅲ) ,前人[3-4]对此已有研究。但在实际场地应用中,国内报道的铬渣堆存场地地下水Cr(Ⅵ)质量浓度高达107.2 mg/L[5-6]。王凤花等[7]研究表明,Cr(Ⅵ)能与微生物体内的大分子物质相结合,影响微生物的新陈代谢,且Cr(Ⅵ)质量浓度越高,抑制作用越强[8]。然而,利用原位生物技术修复中、高质量浓度Cr(Ⅵ)污染是否可行,尚未见报道。另外,从添加营养物质角度来看,已有研究[9]表明,乳化植物油在地下环境中迁移性良好,且能长期提供碳源和电子供体,在原位强化生物化学修复地下水中氯化溶剂类有机物有很好的效果。本文拟采用乳化植物油作为外加碳源,对中、高浓度Cr(Ⅵ)污染地下水进行修复,并对产物稳定性和环境影响进行评估。
1 材料与方法
1.1 实验材料
乳化植物油:将大豆油、Tween80、蒸馏水按比例混合,利用高速多用分散机 (沃的 GF1100) 搅拌30 min,制得50.0 g/L的乳白色的水包油型乳液,静置24 h无分层破乳,备用。K2Cr2O7、酵母浸粉均为分析纯,来自北京化学试剂厂。实验用细砂为吉林省伊通河的天然河砂,经筛分后使用,其pH为6.80,粒径为0.10~0.25 mm,有机质质量分数为1.7%,总铁质量分数为8.34 mg/g,总铬为0 mg/g。
1.2 实验操作
在一系列50.0 mL顶空瓶中分别加入25.0 g细砂和25.0 mL反应液,其中反应液由50 g/L乳化植物油、酵母浸粉、200.0 mg/L的重铬酸钾溶液和蒸馏水配制;配制后各体系的乳化植物油质量浓度为5.0 g/L,酵母浸粉质量浓度为0.20 g/L,重铬酸钾质量浓度分别为0.0、20.0、30.0、50.0、80.0、110.0 mg/L。另外设置Cr(Ⅵ)质量浓度为20 mg/L的不添加乳化植物油和灭菌对照组。顶空瓶密闭,混合摇匀,然后置于20 ℃暗光恒温培养箱中培养。每个梯度处理重复13瓶,定期取新反应瓶,测定上部液体pH和溶解氧 (dissolved oxygen,DO)、Fe(Ⅲ)、总铁 (total iron,TFe)、Cr(Ⅵ)、总铬 (total chromium,TCr) 和总有机碳 (total organic carbon,TOC) 的质量浓度。反应结束后,采用Tessier连续提取法[10]分析介质表面铬的存在形态。
1.3 测定方法
DO质量浓度使用美国哈希公司Hach Sension+ DO6溶解氧仪测定;pH使用美国YSI公司便携式YSI pH100型pH计测定。水样经0.45 μm水系滤膜过滤后,采用火焰原子吸收分光光度法 (HJ 757-2015) 测定TCr质量浓度;采用二苯碳酰二肼分光光度法 (GB 7467-87) 测定Cr(Ⅵ)质量浓度;采用硫氰酸盐分光光度法(DZ/T 0064.24-93)测定Fe(Ⅲ)和TFe质量浓度,TFe与Fe(Ⅲ)的浓度差值为Fe(Ⅱ)质量浓度;采用重铬酸钾氧化分光光度法 (HJ 615-2011) 测定TOC质量浓度。
2 结果与讨论
2.1 Cr (Ⅵ) 的还原
图1a为ρ(Cr(Ⅵ))随时间(t)的变化,由其可见,各反应体系中ρ(Cr(Ⅵ))均有明显下降,反应77 d后,各体系ρ(Cr(Ⅵ))分别从初始的20.0、30.0、50.0、80.0、110.0 mg/L下降到0.0、5.8、19.0、43.6、65.8 mg/L,去除率分别为100.0%、80.7%、61.9%、45.5%、40.2%。其中:20 mg/L的体系在反应的第42天ρ(Cr(Ⅵ))降到0.25 mg/L;第56 天时,该体系检测出Fe(Ⅱ),累积ρ(Fe(Ⅱ))为4.6 mg/L,说明Cr(Ⅵ)得到了有效的还原。图1b的ρ(TCr) 变化趋势与图1a的ρ(Cr(Ⅵ))的变化趋势相一致,说明Cr(Ⅵ)得到了有效还原并沉淀进入介质中[11]。如图1c所示:未添加乳化油和灭菌对照组中ρ(Cr(Ⅵ))在实验初期稍有降低,之后基本保持稳定;77 d时Cr(Ⅵ)去除率分别为7.3%和7.0%,说明实验组ρ(Cr(Ⅵ))的降低主要是由于乳化油植物油作为碳源和电子供体刺激强化土著微生物还原Cr(Ⅵ)的结果。各体系的ρ(Cr(Ⅵ))在实验初期均有一定的下降,首先主要可能是由于介质中的胶体物质和团粒结构对Cr(Ⅵ)的吸附和包被作用[12];其次,介质中的Fe(Ⅱ)等还原性组分的还原作用也能使ρ(Cr(Ⅵ)) 降低。随着实验继续进行,微生物适应了环境体系,生物还原作用成为ρ(Cr(Ⅵ))持续降低的主要动力。迄今为止,已有许多种具有铬还原作用的微生物被证实,包括地杆菌属、希瓦氏菌属、地弧菌属、地发菌属、脱硫单孢菌属等[13],各种微生物对于Cr(Ⅵ)胁迫的响应不同[12,14]。 陈子方[15]以工业糖浆作为碳源生物修复Cr(Ⅵ)污染地下水研究中,对修复过程中微生物群落的分析表明,丰度总和超过50%的微生物具有Cr(Ⅵ)还原能力,以铬还原菌和异化铁还原菌为主。本研究中的功能微生物种群及其演化规律还有待进一步研究。此外,随着ρ(Cr(Ⅵ))的升高,各体系ρ(Cr(Ⅵ)) 下降的数值是逐渐增加的,可能是由于初始ρ(Cr(Ⅵ)) 不同,导致驯化的具有还原作用微生物种类、数量不同。

图1 铬质量浓度随时间变化Fig.1 Variation of the concentration of Cr over time
2.2 地下环境的变化
2.2.1 铁质量浓度变化
由图2可见,未添加Cr(Ⅵ)的反应体系,反应15 d时检出ρ(Fe(Ⅱ))为17.9 mg/L;之后快速累积,42 d时ρ(Fe (Ⅱ))达到117.0 mg/L,表明异化铁还原微生物可以快速生长,Fe(Ⅲ)异化还原为Fe(Ⅱ)。但当Fe(Ⅱ)浓度过高时,会抑制铁还原微生物的生长生存[16],而导致42 d以后ρ(Fe(Ⅱ))不断降低;同时,体系中的Fe(Ⅱ)发生了矿化作用,形成了蓝铁矿、菱铁矿等矿物,细砂的颜色也从最初的黄色变为灰黑色,Thomas等[17]的研究也出现了此现象。这些新形成的二价铁矿物具有较大的比表面积,并含有Fe(Ⅱ)和羟基组成的表面官能团,具有较强的还原、吸附能力,可有效防止Cr(Ⅵ)污染羽扩散。
初始ρ(Cr(Ⅵ))为20.0 mg/L的体系,在Cr(Ⅵ)被完全还原后,反应56 d时检测出Fe (Ⅱ),其滞后于液相中ρ(Cr(Ⅵ))降低到0.0的时间点(图1a) 。这可能是由于介质中吸附的Cr(Ⅵ)的解吸,即当Cr(Ⅵ)被完全还原之后,体系中才会有Fe(Ⅱ)的积累[17]。实验初始时,产生的Fe(Ⅱ) 均与Cr(Ⅵ)发生反应,因此未见积累,当ρ(Cr(Ⅵ))降低之后,Fe(Ⅱ)才开始积累。ρ(Fe(Ⅱ))从56 d到77 d的快速积累表明,Cr(Ⅵ)被完全还原后,异化铁还原作用仍在持续进行,同时也说明乳化植物油缓慢释放碳源和电子供体的性能。

图2 二价铁质量浓度随时间变化Fig.2 Variation of the concentration of Fe(Ⅱ) over time
2.2.2 pH变化
由图3可以看出:各反应体系中的pH均呈下降趋势,而且ρ(Cr(Ⅵ))初始浓度越低,pH下降越明显;77 d时,各体系pH分别从初始的7.71、7.57、7.35、7.35、7.13、6.89下降到6.23、5.81、6.69、6.69、6.41、6.46。反应体系中pH的变化,首先可能是由于乳化植物油中的长链脂肪酸,如棕榈酸(C16H32O2)、油酸(C18H34O2)、亚油酸 (C18H32O2)、亚麻油酸 (C18H30O2) 等经过β氧化,产生乙酸等小分子有机酸,使pH降低[18];其次,微生物异化铁还原作用生成OH-,使pH升高[19],Fe(Ⅱ)还原Cr(VI)并沉淀伴随生成H+,使pH降低[20];再次,碳源代谢的终产物CO2溶于水,形成CO32-和HCO3-,引起pH降低;最后,重铬酸钾在溶液中发生水解反应[21]

产生H+,也可使pH降低。pH的降低促进了Fe (Ⅲ)的溶出,有助于促进异化铁还原作用的进行[22]。

图3 pH随时间变化Fig.3 Variation of the value of pH over time
结合图2和图3,初始ρ(Cr(Ⅵ))为0.0和20.0 mg/L的反应体系,其Fe(Ⅱ)快速积累阶段,反应体系的pH均有明显的下降,这主要是由于异化铁还原作用使反应体系变成了水解酸化微生物,更适宜生存的厌氧环境,水解酸化的增强使得体系pH下降。而ρ(Fe (Ⅱ))过高,抑制了异化铁还原过程,体系pH过低也使得水解酸化作用减弱,此时体系中的产甲烷菌利用CH3COOH、H2、CO2形成甲烷,使得初始ρ(Cr(Ⅵ))为0.0的反应体系后期pH升高。
综上所述,各反应体系中的生物、化学等作用是体系中pH变化的主要动力。总体来看,pH处在中性或偏酸性范围,且地下环境介质具有一定的酸缓冲能力,因此,一般情况下不会对地下环境中重金属的存在状态产生显著影响。
2.2.3 DO质量浓度变化
从图4可以看出,ρ(DO)随时间不断下降。初始ρ(Cr(Ⅵ))对ρ(DO)的变化影响并不明显。反应77 d时,各体系的ρ(DO)均降至0.0~1.5 mg/L,形成了兼性厌氧环境。反应初期兼性细菌在产酸的过程中消耗了体系中的氧气并生成小分子有机酸,从而使ρ(DO)和pH都降低。初始ρ(Cr(Ⅵ))为0.0的体系,微生物的生长没有受到抑制,体系中的氧消耗速度更快,更易形成厌氧环境;而添加Cr(Ⅵ)的体系,ρ(DO)的下降速率相对较慢,可能是由于ρ(Cr(Ⅵ))较高,对耗氧微生物有一定的抑制作用。
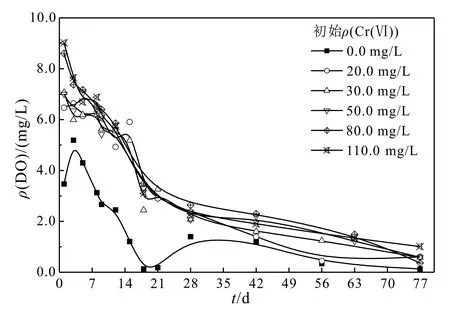
图4 溶解氧质量浓度随时间变化Fig.4 Variation of the concentration of DO over time
2.2.4 TOC质量浓度变化
从各反应体系中ρ(TOC)随时间变化图(图5)可知:1)初始添加5.0 g/L的乳化植物油后,反应体系的ρ(TOC) 为9 891.0 mg/L;在第1 天时,各反应体系液相中ρ(TOC)均低于2 200.0 mg/L,出现了大幅下降。其主要原因是,细砂能够吸附大量的乳化植物油[23];此外,Ca2+、Fe2+可以和其中的油酸等成分形成沉淀[24],也导致了液相体系中ρ(TOC)的降低。2)7 d以后,ρ(TOC)基本趋于稳定降低,说明体系进入稳定的反应阶段。初始ρ(Cr(Ⅵ))为0.0的体系,ρ(TOC)在中后期偏低,主要是由于体系微生物不受抑制的大量生长,消耗了大量的有机物。3)实验进行77 d后,体系中除了被大量吸附的乳化植物油,液相中的ρ(TOC)仍然超过600.0 mg/L,说明乳化植物油在地下环境中可以长期提供碳源和电子供体,以便微生物生长和降解污染物,这与Robert等[25]的研究是一致的。

图5 TOC质量浓度随时间变化Fig.5 Variation of the concentration of TOC over time
2.3 还原产物的稳定性
如图6,用Tessier连续提取法对反应后介质样品中Cr的存在形态进行分析,发现其主要以铁锰结合态和有机结合态的形式存在,其他形态的Cr并未检出,这与生贺[26]的研究结果基本一致。铁锰结合态和有机结合态的Cr均能够在自然环境下稳定存在,其再次释放进入环境的风险大大降低[27]。通常情况下,在pH=6~8时,Cr(Ⅵ)和Cr(Ⅲ)转化的氧化还原电位为420~840 mV,在加入乳化植物油等碳源后,地下环境的ORP(氧化还原电位)会迅速降低,通常为缺氧或者厌氧的还原环境,远低于420 mV,为Cr(Ⅵ)还原产物的稳定存在创造良好条件。

图6 细砂中铬存在形态Fig.6 Existing forms of Cr in the sand
3 结论
1) 乳化植物油能作为长效缓释碳源强化土著微生物原位修复质量浓度高达110.0 mg/L的Cr(Ⅵ)污染地下水,还原产物主要以能够在自然环境中稳定存在的铁锰结合态和有机结合态等形式存在。
2) 原位生物修复过程对地下环境的影响较小。外加乳化植物油强化土著微生物修复Cr(Ⅵ)污染的过程中,地下水的DO质量浓度会显著降低,形成还原环境;各种生化反应过程导致的pH变化范围较小,不会对地下环境重金属类的存在产生影响。
[1] 杨维,王立东,徐丽,等. 铬污染地下水的PRB反应介质筛选及修复实验[J]. 吉林大学学报 (地球科学版) ,2008,38 (5):854-858.
Yang Wei, Wang Lidong, Xu Li, et al. Experiment on Selection of PRB Media and Remediation of Chromium Contaminated Groundwater [J]. Journal of Jilin University (Earth Science Edition) , 2008, 38 (5): 854-858.
[2] 刘海龙,马小龙,袁欣,等. 基于多元回归分析的铬污染地下水风险评价方法[J]. 吉林大学学报 (地球科学版),2016,46 (6):1823-1829.
Liu Hailong, Ma Xiaolong, Yuan Xin, et al. Risk Assessment Method of Chromium (Ⅵ) Polluting Groundwater Based on Multiple Regression Analysis [J]. Journal of Jilin University (Earth Science Edition), 2016, 46 (6): 1823-1829.
[3] Francis C A, Obraztsova A Y, Tebo B M. Dissi-milatory Metal Reduction by the Facultative Anaerobe Pantoea Agglomerans SP1 [J]. Applied and Environmental Microbiology, 2000,66 (2):543-548.
[4] Tebo B M, Obraztsova A Y. Sulfate-Reducing Bac-terium Grows with Cr(Ⅵ) , U(Ⅵ) , Mn (Ⅳ) and Fe(Ⅱ) as Electron Acceptors [J]. Fems Microbiology Letters, 2006,162 (1):193-198.
[5] 孟凡生. 中国铬渣污染场地土壤污染特征[J]. 环境污染与防治,2016,38 (6):50-53.
Meng Fansheng. Pollution Characteristics of Soils Polluted by Chromium Slag in China [J]. Environmental Pollution and Control, 2016, 38 (6): 50-53.
[6] 张森琦,王建荣,李其江,等. 青海海晏海北化工厂地下水Cr(Ⅵ)污染机理及治理方案[J]. 现代地质,2009,23 (1):94-102.
Zhang Senqi, Wang Jianrong, Li Qijiang, et al. Cr (Ⅵ)-Pollution Mechanism and Control Method of Groundwater in Haibei Chemical Plant of Haiyan County, Qinghai Province [J]. Geoscience, 2009, 23 (1): 94-102.
[7] 王凤花,罗小三,林爱军,等.土壤铬 (Ⅵ) 污染及微生物修复研究进展[J]. 生态毒理学报,2010,5 (2):153-161.
Wang Fenghua, Luo Xiaosan, Lin Aijun, et al. Process on Microbial Remediation of Chromium-Contaminated Soil [J]. Asian Journal of Ecotoxicology, 2010, 5 (2): 153-161.
[8] 黄顺红,杨志辉,柴立元,等. 铬渣堆放场中金属铬对周边土壤微生物毒性效应[J]. 中南大学学报 (自然科学版) ,2009,40 (1):25-30.
Huang Shunhong, Yang Zhihui, Chai Liyuan, et al. Toxicity of Metal Chromium to Microorganism Activities in Soil Around Chromium-Containing Slagheap [J]. Journal of Central South University (Science and Technology) , 2009, 40 (1): 25-30.
[9] Guoping T, Watson D B, Wei M W, et al. U(Ⅵ) Bioreduction with Emulsified Vegetable Oil as the Electron Donor:Model Application to a Field Test [J]. Environmental Science And Technology, 2013,47 (7):3218-3225.
[10]Tessier A,Campbell P G C, Bisson M. Sequential Extraction Procedure for the Speciation of Particulate Trace Metals [J]. Analytical Chemistry, 1979,51 (7): 844-851.
[11] 汤洁,王卓行,徐新华. 铁屑-微生物协同还原去除水体中Cr(Ⅵ)研究[J]. 环境科学, 2013,34 (7):2650-2657.
Tang Jie, Wang Zhuoxing, Xu Xinhua. Removal of Cr (Ⅵ) by Iron Filings with Microorganisms to Recover Iron Reactivity [J]. Environmental Science, 2013,34 (7):2650-2657.
[12] 毛晖,曲东,周莉娜. 稻田土壤中添加不同浓度铬对异化铁还原和铬还原的影响[J]. 中国农学通报, 2005,21 (6):235-237.
Mao Hui, Qu Dong, Zhou Lina. Effect of Variant Chromate and Ferrihydrite on Dissimilatory Fe (Ⅲ) Reduction in Paddy Soil [J]. Chinese Agricultural Science Bulletin, 2005,21 (6):235-237.
[13] 黎慧娟,彭静静. 异化Fe (Ⅲ) 还原微生物研究进展[J]. 生态学报,2012,32 (5):1633-1642.
Li Huijuan, Peng Jingjing. Recent Advances in Studies on Dissimilatory Fe (Ⅲ) -Reducing Microorganisms [J]. Acta Ecologica Sinica, 2012,32 (5):1633-1642.
[14] Peng L, Liu Y, Gao S H, et al. Assessing Chromate Reduction by Dissimilatory Iron Reducing Bacteria Using Mathematical Modeling [J]. Chemosphere, 2015,139:334-339.
[15] 陈子方. 工业糖浆原位修复Cr (Ⅵ) 污染地下水反应机理及效能实验研究[D]. 长春:吉林大学,2016:30-34.
Chen Zifang. Study on the Mechanisms and Efficiency of In-Situ Remediation of Cr (Ⅵ) Contaminated Groundwater with Syrup[D]. Changchun: Jilin University, 2016: 30-34.
[16] Eric E R, Matilde M U. Influence of Biogenic Fe(Ⅱ) on Bacterial Crystalline Fe(Ⅲ) Oxide Reduction [J]. Geomicrobiology Journal, 2002,19 (2):209-251.
[17] Thomas B, Ruben K, Andreas K, et al. Biogeoche-mical Redox Processes and Their Impact on Contaminant Dynamics [J]. Environmental Science and Technology, 2010,44 (1):15-23.
[18] 张兰英,刘娜,王显胜.现代环境微生物技术[M]. 3版. 北京:清华大学出版社, 2005:127,139-142.
Zhang Lanying, Liu Na, Wang Xiansheng. Modern Environmental Microbial Technology [M].3rd ed. Beijing: Tsinghua University Press, 2005:127,139-142.
[19] Boris F, Hazen T C, Long P E, et al. In Situ Long-Term Reductive Bioimmobilization of Cr (Ⅵ) in Groundwater Using Hydrogen Release Compound [J]. Environmental Science And Technology, 2008,42 (22):8478-8485.
[20] Hansel C M, Wielinga B W, Fendorf S. Structural and Compositional Evolution of Cr/Fe Solids After Indirect Chromate Reduction by Dissimilatory Iron-Reducing Bacteria [J]. Geochimica Et Cosmochimica Acta, 2003,67 (3):401-412.
[21] Guertin J, Jacobs J, Avakian C P. Chromium(Ⅵ) Handbook [M]. Boca Raton: CRC Press, 2004:71-72.
[22] Paul L, Smolders E. Inhibition ofIron(Ⅲ) Minerals and Acidification on the Reductive Dechlorination of Trichloroethylene [J]. Chemosphere, 2014,111:471-477.
[23] Borden R C. Effective Distribution of Emulsified Edi-ble Oil for Enhanced Anaerobic Bioremediation [J]. Journal of Contaminant Hydrology, 2007,94 (1/2):1-12.
[24] Li Z, Wrenn B A, Venosa A D. Effect ofIron on the Sensitivity of Hydrogen, Acetate, and Butyrate Metabolism to Inhibition by Long-Chain Fatty Acids in Vegetable-Oil-Enriched Freshwater Sediments [J]. Water Research, 2005,39 (13):3109-3119.
[25] Robert C B, B Ximena Rodriguez. Evaluation of Slow Release Substrates for Anaerobic Bioremediation [J]. Bioremediation Journal, 2006,10 (1):59-69.
[26] 生贺.乳化油反应带强化修复Cr (Ⅵ) 污染地下水研究[D]. 长春:吉林大学,2015:38-40.
Sheng He. Study on Enhanced Remediation of Cr(Ⅵ) Contaminated Groundwater by Emulsified Oil Reaction Zone [D]. Changchun: Jilin University, 2015:38-40.
[27] 张垒. 铬污染的城市土壤毒性与修复研究[D]. 成都:四川农业大学,2012:6-7.
Zhang Lei. Toxicity of Chromium Contaminated in Urban Soiland Phytoremediation [D]. Chengdu: Sichuan Agricultural University, 2012:6-7.
