罗非鱼皮多肽的制备及其对烫伤修复的应用
2018-01-25李高荣欧阳茜茜陈法锦李普旺李思东罗荣琼
李高荣,欧阳茜茜,杨 萍,陈法锦,黄 娜,李普旺,李思东,罗荣琼
(1.广东海洋大学海洋与气象学院,广东 湛江 524088;2.广东海洋大学食品科技学院,广东 湛江 524088;3.中国热带农业科学院农产品加工研究所,广东 湛江 524001;4.湛江健力源医疗用品有限公司,广东 湛江 524022)
近年来,随着人们生活方式的改变和生活节奏的加快,烧烫伤的发生率日益增高,给患者及家属带来无法弥补的伤害和巨大的经济损失[1]。目前治疗烧烫伤的常用药物有磺胺嘧啶银和醋酸磺胺米隆,但是这些药物具有生产成本高、副作用严重,对深部烧伤治疗效果差、难以清除烧伤瘢痕等缺点[2-3]。因此,为满足临床应用的迫切需求,开发一些治疗烧烫伤的新型有效药物十分必要。
海洋胶原蛋白是指从海洋动物中分离提取的胶原蛋白[4],通过化学水解或酶水解可得到海洋胶原肽[5]。与海洋胶原蛋白相比,海洋胶原肽具有分子量较低、易于吸收、亲水性强等特点[6]。由于海洋高压、低温和高盐度的特殊环境,海洋胶原肽的物理化学性质和氨基酸组成与陆源胶原肽的差别很大[7],并具有独特的生理功能,如抗菌、抗高血压、抗氧化、抗皮肤老化和神经保护等[8-12]。据报道,来自鲑鱼皮肤的海洋胶原肽的口服给药可增强大鼠的皮肤伤口愈合和血管生成[13],罗非鱼胶原蛋白静电纺丝纳米纤维可以促进大鼠皮肤的伤口愈合[14]。
罗非鱼是我国鱼类养殖业的重要品种之一,据统计,我国每年罗非鱼产量已超过140万t,占世界产量的36.41%[15]。其中,10%以上的罗非鱼经过简单加工,以冻鱼片形式出口,在加工过程中产生了大量鱼皮、鱼鳞等下脚料。目前这些下脚料除了加工饲料外,没有进行高附加值的利用,造成极大的资源浪费[16]。有文献报道,罗非鱼皮含有丰富的胶原蛋白,可作为制备胶原蛋白肽的理想原料[17]。
鉴于此,本研究以海水养殖罗非鱼皮为原料,通过酶的筛选和酶解正交试验,分别获得木瓜蛋白酶和碱性蛋白酶酶解罗非鱼皮的最优酶解条件,在两种酶的最优酶解条件下进行分步复合酶解制备罗非鱼皮多肽,并探究罗非鱼皮多肽对新西兰兔皮肤烫伤创面的修复作用,以期为罗非鱼皮多肽烫伤修复产品的开发和临床应用提供理论依据。
1 材料与方法
1.1 试验材料
罗非鱼皮,由湛江国联水产科技有限公司提供;菠萝蛋白酶、木瓜蛋白酶、胰蛋白酶、胃蛋白酶、碱性蛋白酶、中性蛋白酶,南京庞博生物工程有限公司产品;盐酸、氢氧化钠、硫酸、硼酸、硫酸铜、硫酸钾、甲基红、溴甲酚绿、无水乙醇,均为分析纯,广东光华科技股份有限公司产品;戊巴比妥钠(AR),Sigma产品;湿润烧伤膏(成分:黄连、黄柏、黄芩、地龙、罂粟壳),汕头市美宝制药有限公司产品。
实验动物为新西兰兔,60只,普通级,雌雄各半,体重为2 000(±200)g,由广东省医学实验动物(三水基地)中心提供,实验动物生产许可证:SCXK(粤)2014-0035,实验动物质量合格证明编号:44411600003615。
主要试验仪器包括FA2004电子天平(上海闵胜科技有限公司)、PHS-3C型pH计(上海新苗医疗器械制造有限公司)、HH·S21-8-S电热恒温水浴锅(上海新苗医疗器械制造有限公司)、Kjeltec™8400自动凯氏定氮仪〔福斯华(北京)科贸有限公司〕、喷雾干燥机(无锡市大峰喷雾干燥设备有限公司)、YSL-5Q台式超级控温烫伤仪(北京众实迪创科技发展有限公司)、IX73荧光显微镜(Olympus)。
1.2 试验方法
1.2.1 罗非鱼皮多肽的制备 罗非鱼皮预处理及酶解工艺流程如下:罗非鱼皮→除杂预处理→均质打碎→恒温酶解→高温灭酶→离心分离→微孔膜抽滤→酶解液→喷雾干燥→多肽粉末。
将罗非鱼皮剔除残留的鱼鳞和碎肉,加适量蒸馏水,经100℃沸水浴加热10 min,用均质机均质打碎(10 000 r/min),再加适量蒸馏水调节底物浓度,调节pH值,加酶恒温酶解,控制反应时间。100℃沸水浴灭酶后,10 000 r/min离心20 min,取上清液,经0.45 μm微孔滤膜真空抽滤,得到酶解液,最后经喷雾干燥得到多肽粉末。
(1)酶的筛选:选取实验室常用的蛋白酶,在各酶最适pH值和温度下进行酶解,底物浓度、酶用量以及酶解时间一致,以酶解液的蛋白质回收率为评价指标,筛选出最合适的蛋白酶种类。各酶的酶解条件如表1所示。
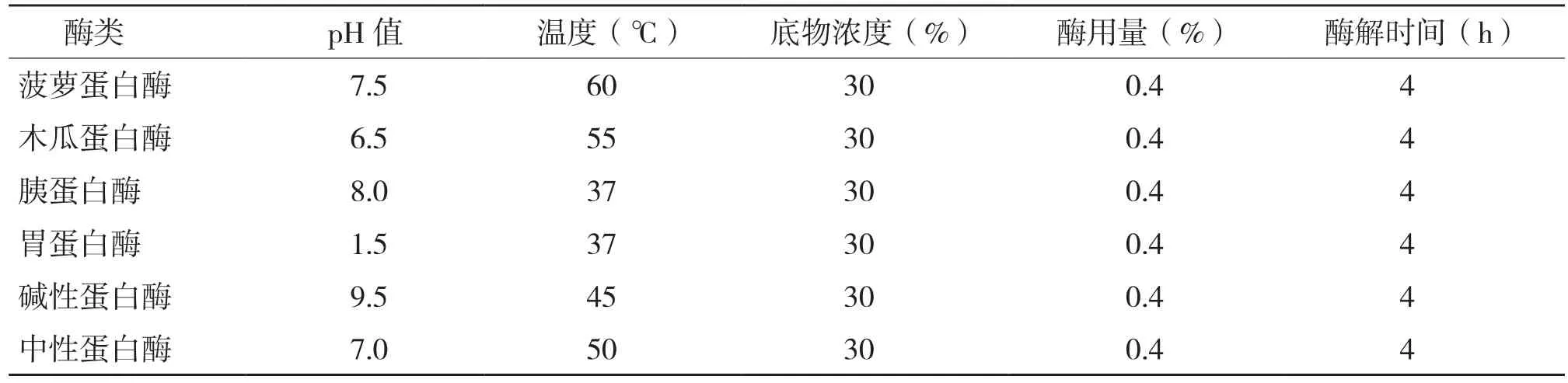
表1 常用酶类酶解条件
(2)酶解正交试验:选取酶解效果最好的两种蛋白酶,以酶解pH值、酶解温度、底物浓度以及酶用量为考察因素,以酶解液的蛋白质回收率为评价指标,采用L9(34)正交表进行正交试验。两种酶正交试验的因素和水平设计如表2所示。
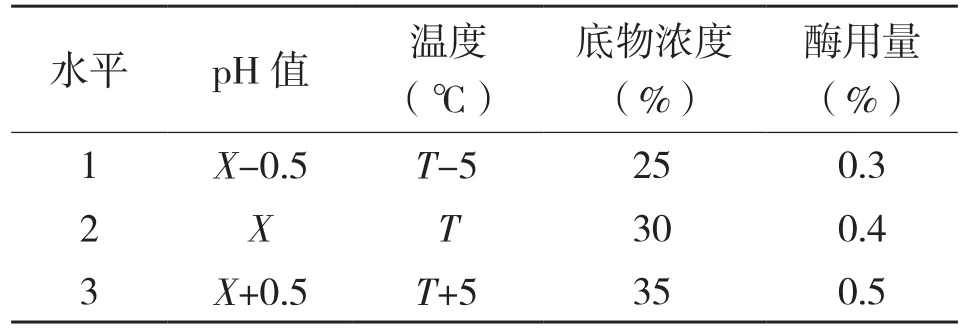
表2 酶解正交试验因素和水平
(3)复合酶解制备罗非鱼皮多肽:根据酶解正交试验的结果,在两种酶的最适酶解条件下进行分步复合酶解,制备罗非鱼皮多肽。
(4)蛋白质回收率测定:用凯氏定氮法分别测定酶解液和原料中的氮含量,计算蛋白质回收率:

1.2.2 罗非鱼皮多肽对新西兰兔Ⅱ度烫伤的修复作用 (1)新西兰兔烫伤模型的制备:试验前24 h在新西兰兔背部剃毛,用10%硫化钠涂抹剃毛区进行脱毛,待毛脱干净时用生理盐水清洗干净,单笼饲养。新西兰兔静脉注射3%戊巴比妥钠(30 mg/kg)进行麻醉,背部脱毛区皮肤以75%乙醇消毒后,使用YLS-5Q台式超级控温烫伤仪在兔背部中线外侧2 cm各制备1个烫伤创面,创面面积为3 cm2,烫伤条件为:烫头温度100℃、作用压力1 000 g、烫头与皮肤接触时间为6 s。
(2)试验分组和给药:模型兔随机分为3组,分别是模型对照组、阳性对照组、实验组,20只/组(雌雄各半)。模型对照组造模后不进行给药;阳性对照组造模后1 d开始,烫伤创面以润湿烫伤膏进行涂抹治疗,每天涂抹1次(约1 mL),连续涂抹28 d;实验组造模后1 d开始,烫伤创面以罗非鱼皮多肽糊剂进行涂抹治疗,每天涂抹1次(约含罗非鱼皮多肽100 mg),连续涂抹28 d。在造模当天以及每次换药时观察创面的大小、颜色、炎症、渗出液、感染、结痂以及脱痂等情况,并拍照记录。
(3)烫伤创面愈合率测定:分别于造模后 1、3、7、10、14、17、21、24、28 d使用标准半透明称量纸覆盖在兔背部的烫伤创面,使用标准半透明称量纸覆盖在兔背部的烫伤创面,将创面边缘描绘在半透明的称量纸上,剪出创面形状,计算纸片的面积,按照公式:创面愈合率(%)=(原始创面面积-未愈合创面面积)/原始创面面积×100,计算创面愈合率。
(4)创面病理组织学观察:分别于造模后1、7、14、21、28 d,各组随机选取新西兰兔4只,雌雄各半,切取背部各皮肤伤口中心及周围区域的皮肤组织。所有皮肤样品制成病理切片,经苏木精-伊红(HE)染色,于放大倍数为200×的光学显微镜下观察各组创面愈合情况。
采用SPSS 18.0 统计软件进行数据处理。通过单因素方差分析比较各组间差异,P<0.05则认为差异具有统计学意义。
2 结果与分析
2.1 酶种类选择
采用常用蛋白酶对罗非鱼皮进行酶解,结果各酶酶解所得的蛋白质回收率分别为:菠萝蛋白酶61.28(±2.65)%、木瓜蛋白酶89.62(±1.45)%、胰蛋白酶71.95(±3.27)%、胃蛋白酶67.71(±2.21)%、碱性蛋白酶88.43(±1.84)%、中性蛋白酶86.52(±1.62)%。可见,木瓜蛋白酶和碱性蛋白酶酶解所得的蛋白质回收率最高,水解效果最好,因此选择木瓜蛋白酶和碱性蛋白酶作为水解酶。
2.2 解正交试验及优化验证
2.2.1 碱性蛋白酶和木瓜蛋白酶的正交试验 碱性蛋白酶和木瓜蛋白酶的正交试验结果和方差分析结果见表3~表6。由表3、表5可知,影响罗非鱼皮酶解所得蛋白质回收率的主次因素顺序:碱性蛋白酶为A>B>D>C,即pH>温度>酶用量>底物浓度;木瓜蛋白酶为A>B>C>D,即pH>温度>底物浓度>酶用量;酶解罗非鱼皮最优因素组合:木瓜蛋白酶为A2B2C2D3,即pH6.5、温度55℃、底物浓度30%、酶用量0.5%;碱性蛋白酶为A2B2C3D2,即pH9.5、温度45℃、底物浓度35%、酶用量0.4%。
由表4、表6可知,通过蛋白质回收率的显著性方差分析可知,pH值对木瓜蛋白酶和碱性蛋白酶酶解所得蛋白质回收率的影响均显著,其他3个因素的影响则都不显著。
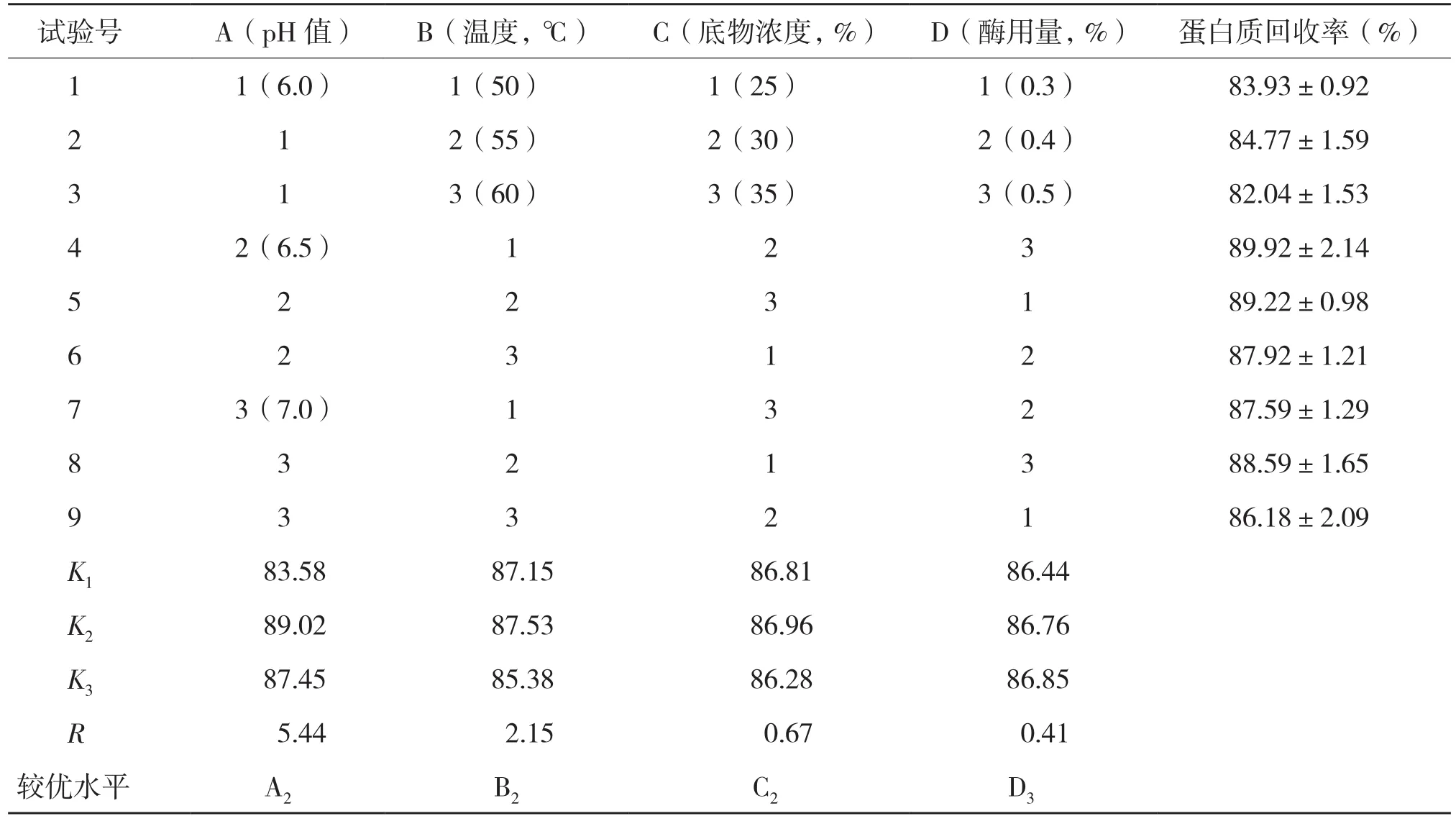
表3 木瓜蛋白酶酶解罗非鱼皮L9 (34)正交实验结果
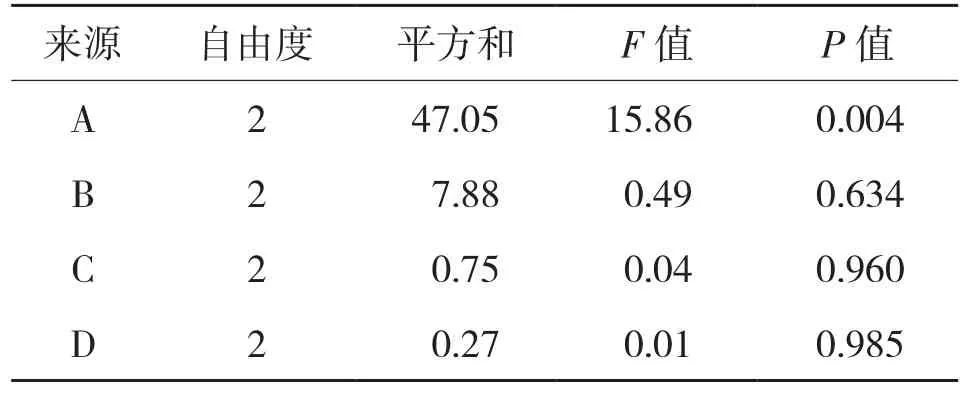
表4 木瓜蛋白酶酶解所得蛋白质回收率的方差分析
2.2.2 正交优化条件的验证 经正交试验优化得到两种酶的最优因素组合:木瓜蛋白酶为pH6.5、温度55℃、底物浓度30%、酶用量0.5%;碱性蛋白酶为pH9.5、温度45℃、底物浓度35%、酶用量0.4%。以蛋白质回收率为指标,验证正交优化条件,结果蛋白质回收率分别为:木瓜蛋白酶90.54(±1.72)%、碱性蛋白酶89.22(±2.14)%。
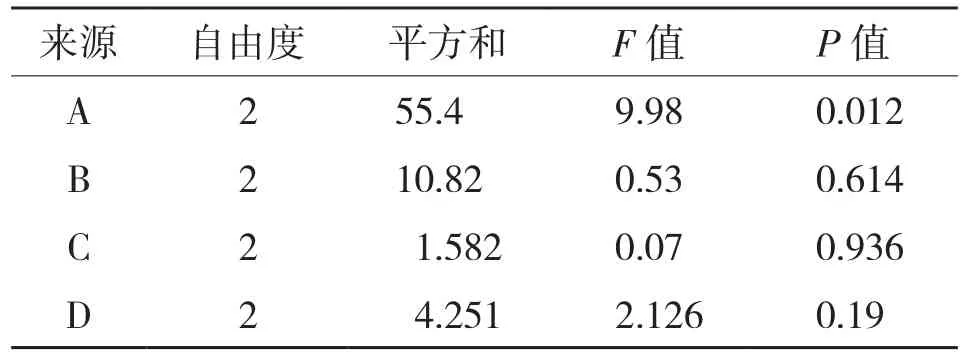
表6 碱性蛋白酶酶解所得蛋白质回收率的方差分析
2.3 碱性蛋白酶与木瓜蛋白酶的复合酶解
在正交试验基础上,设定木瓜蛋白酶、碱性蛋白酶两种酶的最优酶解条件,通过改变酶添加顺序进行复合酶解,先加木瓜蛋白酶酶解2 h后加碱性蛋白酶酶解2 h的蛋白质回收率为95.13(±1.42)%;先加碱性蛋白酶酶解2 h后加木瓜蛋白酶酶解2 h的蛋白质回收率为95.05(±1.12)%,均值为95.09(±1.27)%。可见,添加酶的先后顺序几乎不影响复合酶解的结果,这可能是因为两种酶对底物的作用位点不同,且一种酶的酶解作用不影响另一种酶的作用。复合酶解所得的蛋白质回收率比单一酶的更高,较最优酶解条件下的木瓜蛋白酶和碱性蛋白酶分别提高5.03%和6.58%,说明由于不同蛋白酶具有不同作用位点,采用复合水解可产生互补效应,能进一步提高酶解度。综上,选择在两种酶的最优酶解条件下,分步复合酶解制备罗非鱼皮多肽。
2.4 烫伤创面的宏观评价
各组烫伤创面不同时间的愈合情况如图1(彩插三)所示:造模后1 d,各组烫伤创面呈近圆形,与周围组织界限分明,部分表皮剥脱,真皮层软化发白;造模后4 d,各组烫伤创面均出现坏死症状,有组织液渗出和脓性物分泌,创周炎症反应明显,创缘红肿、扩张;造模后7 d,实验组与阳性对照组烫伤创面水肿开始消退,部分痂皮覆盖,创面干燥、无组织液渗出,模型对照组烫伤水肿未见明显消退,少量痂皮覆盖,创面较为湿润,创周有少量脓性分泌物;造模后14 d,各组烫伤创面外周痂皮大部分脱落,创面干燥,无组织液渗出和脓性物分泌,创面缩小,创周与周围正常组织界限不明显,实验组和阳性对照组的创面缩小情况均优于模型对照组;造模后21 d,实验组烫伤创面痂皮基本脱落,而模型对照组和阳性对照组中间部分仍有少量痂皮附着,呈淡红色;造模后28 d,各组烫伤创面痂皮均已基本脱落,创面已全愈合,创面区域无毛发生长。
2.5 烫伤创面愈合率的变化
各组烫伤创面不同时间的创面愈合率变化如表7所示。由于烫伤创面的坏死和炎症反应,组织液渗出和脓性物分泌引起创周红肿及边缘扩大,因此药后3 d的愈合率出现负值,也导致给药后的前7 d,3组的创面愈合率无明显差异。与模型对照组相比,实验组的创面愈合率在造模后10 d开始出现显著性差异,而阳性对照组在造模后14 d才开始有显著性差异,尤其是造模后17、21、24 d,实验组和阳性对照组的创面愈合率极显著高于模型对照组。实验组与阳性对照组的创面愈合率未见明显差异,愈合效果相近。
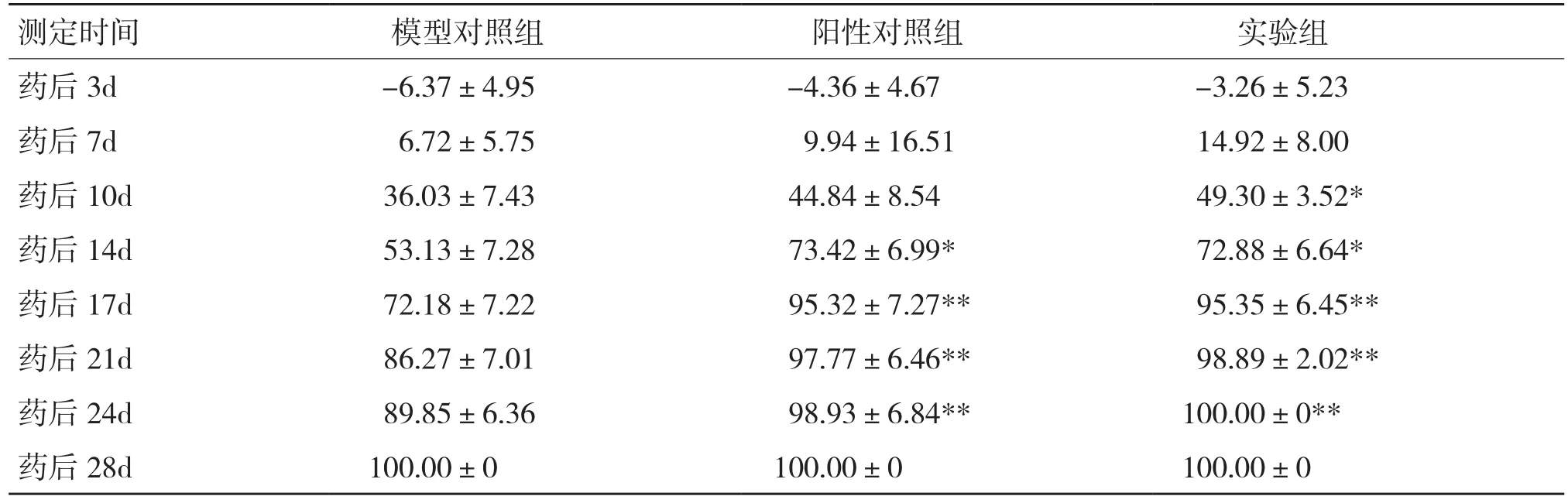
表7 各组烫伤创面不同时间的创面愈合率(%)比较
2.6 烫伤创面的病理组织学评价
创面组织切片的HE染色观察如图2(彩插三)所示:造模后1 d,创面表皮层和部分真皮层凝固性坏死,可见皮下水肿,炎性细胞浸润,真皮间质扩张疏松,皮肤附件被严重破坏,符合Ⅱ度烫伤病理特征;造模后7 d,各组均观察到炎性细胞浸润,并有明显的痂皮出现,但未观察到再上皮化;造模后14 d,模型对照组炎性细胞较多,表皮恢复不明显,阳性对照组和实验组创面再上皮化明显,表皮恢复较好,角质层重建表皮恢复较好,角质层重建,真皮层间质紧密;造模后21 d,模型对照组伤口仅部分再上皮化,阳性对照组大部分完成伤口的再上皮化,实验组已完成伤口的再上皮化;造模后28 d,模型对照组、阳性对照组和实验组均已完成伤口再上皮化,实验组表皮增厚最大,真皮层间质紧密,成纤维细胞成梭型有序排列,恢复情况最好。
3 结论与讨论
本研究以罗非鱼皮为原料,通过酶的筛选,选取酶解效果最好的木瓜蛋白酶和碱性蛋白酶,进行酶解正交试验,得到两种酶的最优酶解条件,并在最优酶解条件下,进行双酶分步复合酶解制备罗非鱼皮多肽,所得的蛋白质回收率均比最优酶解条件下单酶的更高。对复合酶解所得的罗非鱼皮多肽进行新西兰兔烫伤试验,结果表明,罗非鱼皮多肽对皮肤烫伤创面有很好的修复作用。
由于蛋白酶对底物作用具有一定的专一性,不同的蛋白酶具有不同的作用位点,采用单酶水解时,只能从特定的水解位点,即从几个固定的氨基酸残基进行水解,故水解程度受到限制。采用多酶复合酶解可以通过不同水解位点的互补作用弥补单酶水解的不足,进而提高底物的水解程度[18]。
烧烫伤在临床上比较常见,是一种由热力、化学物质、电流及放射线所引起的外伤性疾病,其中以热烧伤最为常见[19]。伤口愈合是最复杂的生物过程之一,通过细胞增殖、迁移、胞外基质合成、血管形成、上皮化以及组织重建等一系列修复作用而实现[20]。角质形成细胞再上皮化是伤口愈合的细胞机制之一,其主要依赖角质形成细胞增殖和迁移[21]。角质形成细胞增殖可确保更多的细胞迁移,加速再上皮化过程,促进伤口愈合[22]。转化生长因子 -β1(TGF-β1)是伤口愈合过程中发挥关键作用的重要因素,在伤口愈合的每个阶段,TGF-β1可抑制炎症反应并促进肉芽组织的形成[23]。本研究认为,罗非鱼皮多肽可通过减少炎症反应,促进上皮再生,从而加速烫伤创面的愈合过程、提高愈合效果。推测罗非鱼皮多肽可促进TGF-β1的释放,从而抑制炎症反应并促进肉芽组织的形成[24],促进角质形成细胞的增殖并刺激表皮分化,加速再上皮化[14]。
[1] Edelman L. Social and economic factors associated with the risk of burn injury[J]. Burns,2007,33(8):958-965.
[2] Shanmugasundaram N,Uma T S,Ramyaa Lakshmi T S,et al. Efficiency of controlled topical delivery of silver sulfadiazine in infected burn wounds[J]. Journal of Biomedical Materials Research(Part A),2009,89(2):472-482.
[3] Johnson R M,Richard R. Partial-thickness burns:identification and management[J].Advances in Skin & Wound Care,2003,16(4):178-187.
[4] 蒋升,蔚一博,徐晓刚. 海洋胶原蛋白的提取及在组织工程学中的研究进展[J]. 药物生物技术,2017(2):180-184.
[5] Vijaykrishnaraj M,Prabhasankar P. Marine protein hydrolysates:Their present and future perspectives in food chemistry—A review[J].RSC Adv,2015,5:34864-34877.
[6] Fan L,Cao M,Gao S,et al. Preparation and characterization of sodium alginate modified with collagen peptides[J]. Carbohydr Polym,2013,93:380-385.
[7] Lin Y K,Deng C L. Comparison of physical–chemical properties of type I collagen from different species[J]. Food Chemistry,2006,99(2):244-251.
[8] Ennaas N,Hammami R,Gomaa A,et al.Collagencin,an antibacterial peptide from fish collagen:Activity,structure and interaction dynamics with membrane[J]. Biochem Biophys Res Commun,2016,473:642-647.
[9] Kim S K,Ngo D H,Vo T S. Marine fish-derived bioactive peptides as potential antihypertensive agents[J]. Adv Food Nutr Res,2012,65:249-260.
[10] 刘文颖,徐姗姗,谷瑞增,等. 海洋胶原低聚肽中抗氧化肽的分离及鉴定[J]. 食品工业科技,2017(6):101-105,109.
[11] Tanaka M,Koyama Y,Nomura Y. Effects of collagen peptide ingestion on UV-B-induced skin damage[J]. Biosci Biotechnol Biochem,2009,73:930-932.
[12] Xu L,Dong W,Zhao J,et al. Effect of marine collagen peptides on physiological and neurobehavioral development of male rats with perinatal asphyxia[J]. Mar Drugs,2015,13:3653-3671.
[13] Zhang Z,Wang J,Ding Y,et al. Oral administration of marine collagen peptides from Chum Salmon skin enhances cutaneous wound healing and angiogenesis in rats[J]. J Sci Food Agric,2011,91:173-179.
[14] Zhou T,Wang N,Xue Y,et al. Electrospun tilapia collagen nanofibers accelerating wound healing via inducing keratinocytes proliferation and differentiation[J]. Colloids Surf B Biointerfaces,2016,143:415-422.
[15] 张红燕,袁永明,贺艳辉,等. 中国罗非鱼生产与贸易现状分析及建议[J]. 中国渔业经济,2015(3):95-100.
[16] 赵志霞,吴燕燕,李来好,等. 我国罗非鱼加工研究现状[J]. 食品工业科技,2017(9):363-367,373.
[17] 叶小燕,曾少葵,余文国,等. 罗非鱼皮营养成分分析及鱼皮明胶提取工艺的探讨[J]. 南方水产,2008(5):55-60.
[18] 王运改,林琳,李明辉,等. 鮰鱼皮明胶抗氧化肽的制备工艺研究[J]. 食品科学,2010,31(19):254-258.
[19] 黄梦玲,王雄,吴金虎. 中药治疗烧烫伤的作用机制研究进展[J]. 医学综述,2017,23(11):2240-2244.
[20] Pazyar N,Yaghoobi R,Rafiee E,et al. Skin wound healing and phytomedicine:a review[J].Skin Pharmacology and Physiology,2014,27(6):303-310.
[21] Gurtner G C,Werner S,Barrandon Y,et al.Wound repair and regeneration[J]. Nature,2008,453(7193):314-321.
[22] Chen X,Shi Y,Shu B,et al. The effect of porcine ADM to improve the burn wound healing[J].International Journal of Clinical & Experimental Pathology,2013,6(11):2280-2291.
[23] Werner S,Grose R. Regulation of wound healing by growth factors and cytokines[J]. Physiological Reviews,2003,83(3):835-870.
[24] Liu H,Mu L,Tang J,et al. A potential wound healing-promoting peptide from frog skin[J].The International Journal of Biochemistry & Cell Biology,2014,49:32-41.
