脊柱原发非霍奇金淋巴瘤的影像和病理表现特征
2018-01-24杨帆孙鹏飞那曼丽庞超楠韩嵩博张滨唐丽丽
杨帆, 孙鹏飞, 那曼丽, 庞超楠, 韩嵩博, 张滨, 唐丽丽
原发性骨淋巴瘤(primary lymphoma of bone,PLB) 起源于骨髓腔,且病变局限于骨骼,占原发性骨恶性肿瘤的3%~7%,占淋巴结外恶性淋巴瘤的4%~5%[1]。PLB于1928年首次报道,1939年首次将其定义为一种独立疾病。2013版WHO骨与软组织肿瘤分类中,PLB被定义为由恶性淋巴细胞组成的位于骨骼的单发或多发病变,不伴任何上位引流淋巴结或其他淋巴结外器官受累[2]。PLB为一种较少见的淋巴结外恶性淋巴瘤,以非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)常见,霍奇金淋巴瘤罕见[3]。最新文献报道显示脊柱原发非霍奇金淋巴瘤的发病率有增高趋势[4]。本文对脊柱原发非霍奇金淋巴瘤的影像学表现与病理学进行对照分析,旨在提高对该病的认识。
材料与方法
1.病例资料
搜集经病理证实的12例脊柱原发非霍奇金淋巴瘤患者的临床和影像学资料,诊断标准依据2013年WHO关于骨/软组织肿瘤分类中的有关规定[2],即骨内产生单灶或多灶病变,没有任何上位引流淋巴结受累或淋巴结外病变。12例患者中男6例,女6例,年龄29~75岁,中位年龄55.5岁。临床表现主要为骨痛和局部肿块,病程2周~1.5年。12例患者均行CT平扫,其中9例行CT增强检查;11例患者行MRI平扫,其中10例行MRI增强检查。患者一般资料及临床表现、发病部位详见表1。
2.检查方法
CT检查采用GE LightSpeed 64排螺旋CT机,管电压120 kV,管电流280 mA,层厚4 mm,螺距1。增强扫描采用含碘的非离子型对比剂碘海醇(350 mg I/mL),采用高压注射器经肘静脉注入,流率3 mL/s,剂量2 mL/kg。
MRI检查采用Siemens Trio 3.0T超导型磁共振仪,体部相控阵线圈,患者取仰卧位。常规扫描序列及相应参数:矢状面TSE T1WI(TR 550 ms,TE 11 ms)、TSE T2WI(TR 2800 ms,TE 109 ms)及T2反转恢复序列(TR 3440 ms,TE 102 ms,TI 200 ms),视野为280 mm×280 mm;横轴面T2WI(TR 504 ms,TE 14 ms),视野为160 mm×160 mm;扫描层厚3 mm,层间距0.3 mm。增强扫描以0.2 mmol/kg剂量经肘正中静脉手推注入对比剂钆喷酸葡胺(Gd-DTPA),注射流率2 mL/s,注射后用20 mL生理盐水冲洗管道,常规行TSE T1WI抑脂横轴面(TR 713 ms,TE 12 ms)、矢状面(TR 600 ms,TE 11 ms)及冠状面(TR 600 ms,TE 11 ms)扫描,层厚4 mm,层间距0.4 mm。
结果
本组12例均经穿刺活检或手术证实为脊柱原发非霍奇金淋巴瘤(10例经CT引导下经皮穿刺组织活检确诊,2例经手术确诊),全部病例均行常规组织切片HE染色和免疫组化检查,病理结果均为NHL,其中以弥漫性大B细胞性淋巴瘤(diffuse large B cell lymphoma,DLBCL)为主(83.3%,10/12),免疫组化CD20(+)11例,CD79a(+)9例。
1.发病部位
肿瘤位于颈椎2例,单椎体伴右侧椎弓受累1例,C2-3椎体同时受累1例;胸椎单椎体受累4例,伴附件受累3例,多椎体受累3例(2例呈跳跃性改变);腰椎单椎体受累2例,伴附件受累1例,L3~L4椎体伴附件受累1例(表1)。
2.CT表现
病变骨外形基本正常2例,同时伴有病变骨质周围明显的软组织肿块围绕。溶骨性骨质破坏9例,呈软组织样密度,伴骨皮质连续性中断,1例伴有轻度膨胀性改变,7例病灶边缘和/或破坏区可见残存骨质(图1、2a);病理性骨折6例,其中4例椎体压缩(图2b);溶骨性骨质破坏进一步分为虫蚀型和浸润型,其中7例为虫蚀型(图1a),周围软组织肿块范围与骨质破坏范围基本一致;2例为浸润型,周围软组织肿块范围明显大于骨质破坏范围。同时合并溶骨性骨质破坏、骨质硬化及混合型1例,溶骨性骨质破坏均为虫蚀型。本组1例连续随访病例早期仅见椎体溶骨性骨质破坏伴病理性骨折,破坏区内见粗大骨嵴,随着病程进展,461天后影像学图像上可见软组织肿块形成,且椎体呈明显压缩改变(图2)。所有病例均未见明显骨膜反应改变,无钙化灶。CT增强扫描骨内软组织与周围软组织病灶强化程度一致,呈轻-中度强化,坏死区未见强化。
3.MRI表现
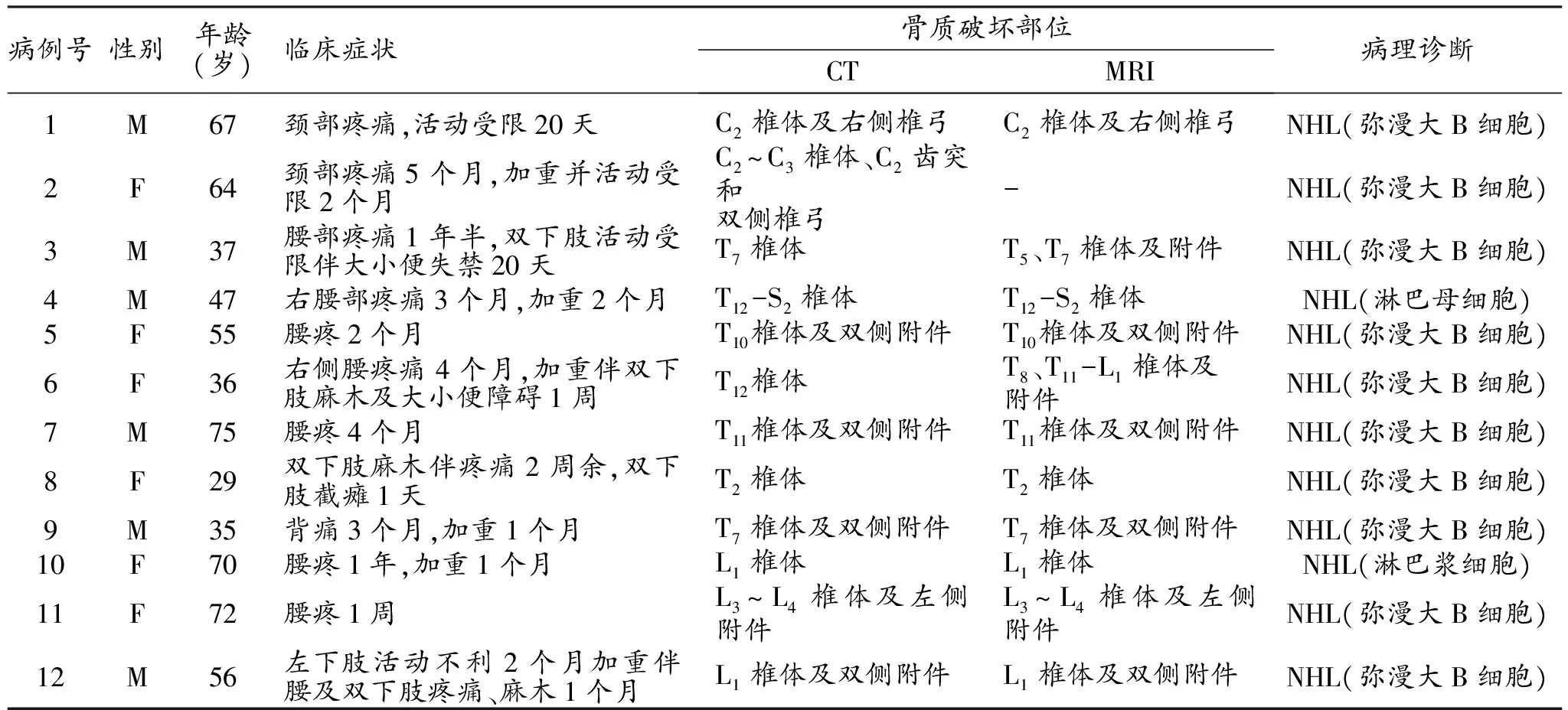
表1 12例脊柱PLB患者的临床表现和病理诊断
注:M,男性;F,女性;NHL,非霍奇金淋巴瘤
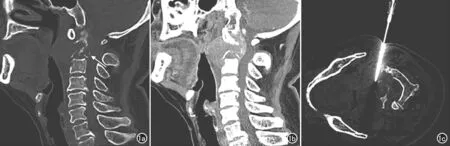
图1 女,64岁,C2~C3淋巴瘤。a) CT平扫示C2椎体、齿突及C3椎体前缘溶骨性骨质破坏(虫蚀型),轻度膨胀性改变,骨质破坏边缘见“残存骨”(箭); b) CT增强扫描示椎体周围软组织肿块包绕椎体生长,颈髓受压向后移位,增强扫描示病灶呈中度均匀强化; c) CT引导下穿刺活检。
11例病例中,病变区T1WI呈等、略低信号,T2WI呈略高信号,脂肪抑制序列呈高信号(图2d),2例CT示骨质"接近正常"的病例,在MRI上均发现髓腔呈早期浸润改变(图3a~b),且均为多发病灶(表1),表现为髓腔内形态不一的斑片状长T2信号。在显示软组织肿块范围方面,MRI较CT更清晰,椎管内硬膜外受侵10例,脊髓或脊髓圆锥受压7例(图3b);矢状面图像示软组织肿块呈分叶状10例,冠状面图像表现为软组织肿块包绕椎弓根呈椎间孔内外生长8例。MRI增强扫描实性软组织肿块呈均匀轻-中度强化,1例病变骨内可见大片状低信号未强化区,周边见不规则环形强化带,似“镶边征”,周围软组织肿块内合并小片状坏死(图3c)。所有病例椎间盘形态正常,椎间隙正常。
讨 论
1.脊柱PLB的病理表现
原发性骨淋巴瘤(PLB)可发生在各个年龄段,30岁以上患者好发,中位发病年龄文献报道不一[5],男性发病率高于女性。PLB患者早期多无明显临床症状,常以骨痛就诊,其次是局部肿块,脊柱原发性非霍奇金淋巴瘤还可以出现神经损害症状,部分患者可出现高钙血症,并引起意识障碍[6,7]。本组脊柱原发性非霍奇金淋巴瘤病例中,中位年龄55.5岁,其中大部分(11/12)发病年龄>30岁;男女比例1:1,低于文献报道,分析其原因,可能与本组样本量偏少有关。所有患者均出现不同程度骨痛,5例伴有神经损害症状。
原发性非霍奇金淋巴瘤的分类较复杂,大多为B细胞淋巴瘤,80%为DLBCL,其发病机制可能与Bcl-2和TP53的异常表达有关[8,9]。肿瘤细胞在髓腔内呈溶骨浸润性生长,中央区正常骨小梁多溶解而被肿瘤细胞取代,周围仍可见保存完好的骨小梁,表现为骨小梁变形、变细小,低倍镜下可见存在于正常骨小梁和髓脂肪间的骨髓造血组织被浸润性瘤细胞取代。肿瘤细胞直接渗透至骨小梁内,累及骨细胞陷窝时,骨质呈溶解性改变;肿瘤细胞也可沿内骨膜处直接破坏骨皮质,经哈弗氏管浸润,使骨皮质呈虫蚀状缺损或筛孔状改变,病灶相互融合呈斑片状溶骨性改变,边界模糊不清;当瘤细胞穿破骨皮质并侵入到周围软组织内,则形成软组织肿块。CT引导下经皮穿刺组织活检是病理检查组织获取的重要方法之一,是早期确诊脊柱原发非霍奇金淋巴瘤的重要手段,尤其适用于没有发现其他病灶时;本组病例中10例(10/12)行CT引导下经皮穿刺组织活检,成功率达100%。脊柱PLB常利用免疫组化分析其免疫表型及分化程度,常用指标为CD20、CD79a、CD45及CD10,本组CD20、CD79a阳性率较高,分别为91.7%、75.0%,与文献报道相符[10]。
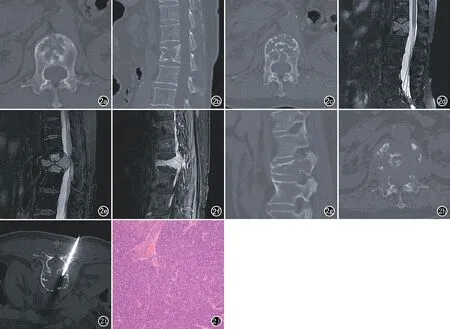
L1椎体骨质破坏较前加重,脊髓圆锥受压向后移位,椎旁软组织肿块形成; f) 增强扫描示病灶呈中度均匀强化; g) 第三年8月16日CT示L1椎体呈明显前窄后宽压缩改变; h) 溶骨性骨质破坏区较前增大,见“残存骨”; i) CT引导下L1病灶穿刺活检; j) 病理图提示淋巴浆细胞性淋巴瘤(×100,HE)。
图2 女,70岁,L1淋巴瘤。a) 第一年4月28日CT平扫示L1椎体溶骨性骨质破坏,骨嵴形成,病理性骨折; b) 椎体上下缘轻度压缩,椎旁未见软组织肿块; c) 第二年2月5日CT平扫示L1椎体溶骨性骨质破坏区较前增大; d) 第二年2月25日MRI示L1椎体病灶脂肪抑制序列呈高信号,邻近椎间隙正常,硬膜囊未见受压,椎旁未见软组织肿块; e) 第三年8月15日MRI示
2.脊柱PLB的CT、MRI表现
相关文献[4,7,11-14]报道PLB最显著的影像学表现是骨质破坏程度轻,周围软组织受侵明显。本组脊柱非霍奇金淋巴瘤患者中9例出现溶骨性骨质破坏,溶骨性骨质破坏进一步分为虫蚀型和浸润型,其中7例出现虫蚀状骨质破坏,2例出现浸润性骨质破坏,虫蚀型骨质破坏范围与软组织肿块范围基本一致,而浸润型骨质破坏相对较小或并不明显,但软组织肿块较大。本组1例混合型骨质破坏范围与软组织肿块范围相当,故笔者认为脊柱原发性非霍奇金淋巴瘤骨质破坏与软组织肿块的关系,仍需结合骨质破坏的类型进行分析。有学者报道当肿瘤细胞引起破骨细胞活动增强、骨质吸收增加时,骨质多以大片状、斑片状或斑点状溶骨型破坏为主,部分溶骨性破坏区或边缘可见小块状或斑点状“残存骨”,发生于椎体的溶骨性骨质破坏常波及椎弓根等附件[14]。本组7例(7/12)病灶边缘和/或破坏区出现残存骨质,附件受累9例。PLB起自髓腔,常伴病理性骨折[11,12],层状或放射状的骨膜反应常见于四肢长骨[15];本组脊柱原发性非霍奇金淋巴瘤均起自椎体,6例伴病理性骨折,表现为骨皮质和/或骨小梁的连续性中断,4例(4/6)椎体压缩,均未见明确的骨膜反应,这可能与脊柱原发非霍奇金淋巴瘤在骨内的浸润性及侵袭性生长方式有关,同时也说明脊柱原发非霍奇金淋巴瘤病理性骨折可能以脊柱压缩为主,骨膜反应不像长骨病变那么多见,当然这种推测有待大量病例的证实。
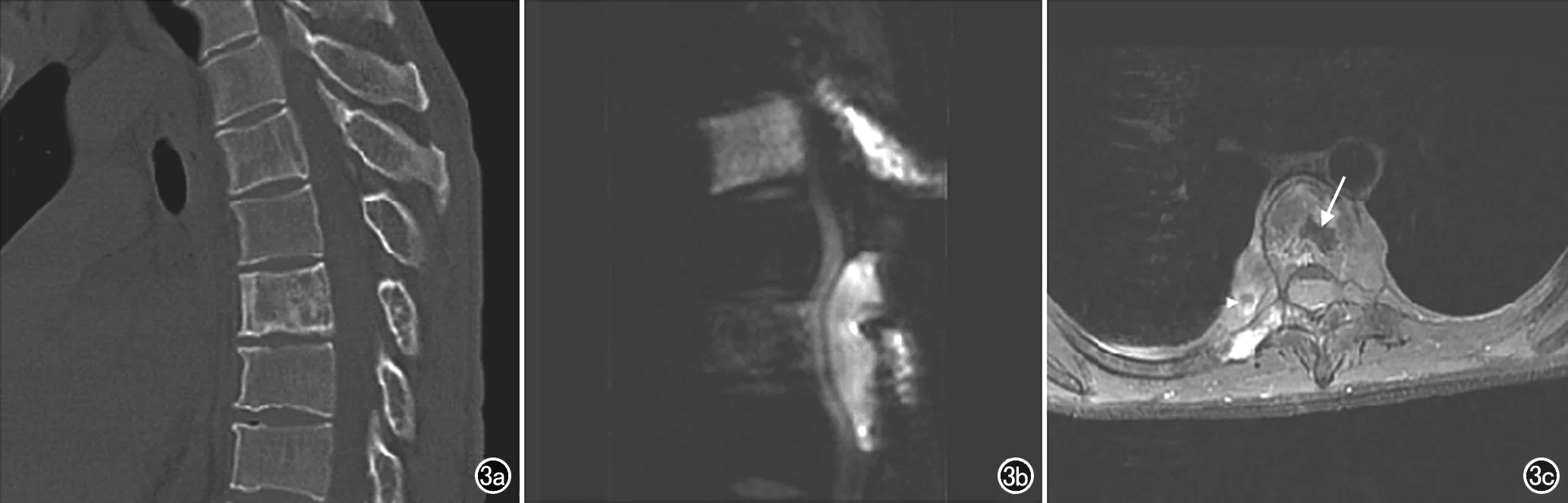
图3 男,37岁,T5、T7淋巴瘤。a) CT平扫示T7椎体及附件骨质密度不均匀减低,内见粗大骨嵴,椎体未见压缩; b) DWI示T5椎体及T5、T7棘突的早期骨髓浸润灶,胸髓受压向前移位; c) MR增强扫描示T7椎体“镶边征”及椎旁软组织肿块片状坏死(箭)。
与CT比较,MRI可发现骨质破坏不明显时髓腔内的早期浸润灶[13],本组2例CT显示骨质“接近正常”的病例,在MRI上均可见骨髓的早期浸润灶,主要表现为髓腔内形态不一的斑片状长T2信号。MRI较CT能更清晰地显示软组织受侵范围,本组患者中软组织信号均与骨内软组织信号相同,T1WI呈等、略低信号,T2WI呈略高信号,这可能与肿瘤内部纤维含量的多少、纤维组织的成熟程度及排列顺序有关;软组织包绕病变骨质生长,合并病理性骨折时常提示预后不良,本组所有病例均伴软组织肿块形成,包绕病变椎体生长,有学者认为这可能是肿瘤细胞经小的血管通道向周围软组织扩张所致,也有可能与肿瘤细胞产生IL-21、IL-26和肿瘤坏死因子(tumor necrosis factor,TNF)等细胞因子引起骨质吸收形成细小的“肿瘤通道”有关,且高分辨力MRI可以清晰显示“肿瘤通道”[13,14]。本组病例中均未见皮质内线样长T2信号“肿瘤通道”影,这可能说明脊柱原发非霍奇金淋巴瘤可能不形成“肿瘤通道”,结合9例伴有骨皮质连续性中断病例进行分析,软组织肿块形成可能与肿瘤细胞直接侵犯和脊柱特定的解剖位置有关。本组1例连续随访病例,CT、MRI显示早期椎体呈明显溶骨性骨质破坏,病理性骨折,周围软组织正常,461天后才在影像学上显示软组织病变,病理诊断为淋巴浆细胞性NHL,这也说明脊柱原发非霍奇金淋巴瘤患者早期可以不引起“肿瘤通道”的形成,肿瘤细胞仅局限于骨质内,分析原因也可能与NHL亚型有关。因受脊柱解剖关系的影响,脊柱原发非霍奇金淋巴瘤的软组织肿块常位于椎旁及椎管内外,呈纵向梭形生长,多达2个椎体节段,椎管内受侵多位于硬膜外,压迫并包绕脊髓呈纵形生长趋势;冠状面图像上表现为软组织肿块包绕椎弓根呈椎间孔内外生长,软组织肿块密度、信号多均匀,椎间盘形态及信号正常,椎间隙正常[11]。本组病例中,8例符合上述形态学表现,9例密度或信号均匀;2例软组织肿块内出现囊变区,病理诊断为弥漫性大B细胞性淋巴瘤,这可能与肿瘤血供丰富、生长迅速、肿瘤细胞包绕血管周围呈套袖状浸润生长并破坏血管壁有关。CT(9/12)、MRI(10/11)增强扫描骨质内外软组织肿块呈轻-中度强化,与相关文献报道一致[7,11];本组1例跳跃性病例MRI增强扫描显示病变骨内大片状低信号未强化区,周边见不规则环形强化带,似“镶边征”[16],周围软组织肿块合并小片状坏死,CT仅见栅栏状粗大骨嵴,结合病理为弥漫大B细胞性淋巴瘤进行分析,可能与病灶呈跳跃性分布、肿瘤血管自发形成血栓引起囊变、坏死有关,当然对于这种骨内破坏区、周围软组织肿块同时出现坏死的现象,有待于进一步行病理和免疫组化分析。
3.鉴别诊断
脊柱原发非霍奇金淋巴瘤为单椎体侵犯或连续椎体侵犯,以溶骨性骨质破坏(单纯虫蚀性、浸润性或合并骨质硬化)为主,伴软组织肿块形成,绝大多数可见硬膜外软组织肿块且包绕病变椎体生长,CT可清晰显示骨质破坏类型、程度及范围。继发性脊柱淋巴瘤也易形成较大软组织肿块,但后者全身症状较重,且常常有明确的淋巴瘤病史。在MRI上,脊柱原发非霍奇金淋巴瘤与多发骨髓瘤表现类似,较转移瘤的骨质破坏程度轻,MRI可清晰显示病变椎体的骨髓受累情况;当有明确白血病病史,弥漫性浸润多分布于红骨髓区时,应首先考虑白血病骨髓浸润;当软组织肿块内出现流注样改变时,需与结核区分,后者常伴椎体的虫蚀样骨质破坏及椎间隙狭窄。如出现软组织肿块、骨髓信号改变、仅少量骨质破坏,应考虑脊柱原发非霍奇金淋巴瘤可能;如病灶穿透骨皮质、病理性骨折及软组织肿块同时出现,则提示预后不良。目前其确诊主要依赖于CT引导下的穿刺活检,并结合全身检查。
本研究为回顾性研究,纳入病例数较少,有待进一步扩大样本量进行后续研究,全面分析脊柱原发非霍奇金淋巴瘤的发病特点及影像学表现,为其诊断和治疗提供更有价值的信息。
[1] Blume P,Charlot-Hicks F,Mohammed S.Case report and review of primary bone diffuse large B-cell lymphoma involving the calcaneus[J].J Foot Ankle Surg,2013,52(5):666-672.
[2] Hogendoorm PCW,Kluin PM.Primary non-Hodgkin lymphoma of bone[M].Lyon:IARC Press,2013:316-318.
[3] 陈远钦,张永辉,陈燕红,等.骨原发性霍奇金淋巴瘤临床病理观察[J].诊断病理学杂志,2015,22(6):361-363.
[4] Zhang X,Zhu J,Song Y,et al.Clinical characterization and outcome of primary bone lymphoma:a retrospective study of 61 Chinese patients[J].Sci Rep,2016,6:28834.
[5] Bhagavathi S,Fu K.Primary lymphoma of bone:a review[J].Semin Diagn Pathol,2014,31(1):48-52.
[6] Marina V,Milena R,Vesna P,et al.Complementary roles of bone scintigraphy and MR imaging in the detection and long-term follow-up of primary non-Hodgkin's bone lymphoma in a child-case report[J].Skeletal Radiol,2015,44(6):863-868.
[7] Zhou HY,Gao F,Bu B,et al.Primary bone lymphoma:a case report and review of the literature[J].Oncol Lett,2014,8(4):1551-1556.
[8] Patel S,Sudesh P,John R,et al.Primary non Hodgkin's lymphoma of talus in a child-a rare presentation[J].Foot (Edinb),2014,24(4):210-212.
[9] H?ussler MD,Fenstermacher MJ,Johnston DA,et al.MRI of primary lymphoma of bone:cortical disorder as a criterion for differential diagnosis[J].J Magn Reson Imaging,1999,9(1):93-100.
[10] Ren S,Tao Y,Jia LU,et al.Fever and arthralgia as the initial symptoms of primary bone marrow diffuse large B-cell lymphoma:a case report[J].Oncol Lett,2016,11(5):3428-3432.
[11] Jawad MU,Schneiderbauer MM,Min ES,et al.Primary lymphoma of bone inadult patients[J].Cancer,2010,116(4):871-879.
[12] Inklab M,Steingart RH,Freeman JK,et al.Primary lymphoma of bone presenting as spindle cell neoplasm of the vertebral body:a case report and review of the literature[J].Case Rep Hematol,2015,2015:518307.
[13] Krishnan A,Shirkhoda A,Tehranzadeh J,et al.Primary bone lymphoma:radiographic MR imaging correlation[J].Radiographics,2003,23(6):1371-1383.
[14] 于宝海,刘杰,钟志伟,等.骨原发性淋巴瘤影像分析[J].中华放射学杂志,2011,45(7):653-656.
[15] Mulligan ME,McRae GA,Murphey MD.Imaging features of primary lymphoma of bone[J].AJR,1999,173(6):1691-1697.
[16] 郑红伟,胡秀荣,祁佩,等.骨原发性淋巴瘤的CT、MRI表现[J].医学影像学杂志,2014,24(1):111-115.
