邻苯二甲酸二异癸酯对小鼠学习记忆的影响
2018-01-23胡赢丹李秋林刘潇童华中师范大学生命科学学院遗传调控与整合生物学湖北省重点实验室湖北武汉430079
路 雨,李 瑶,胡赢丹,李秋林,赵 云,邹 鉴,刘潇童,杨 旭,李 睿 (华中师范大学生命科学学院,遗传调控与整合生物学湖北省重点实验室,湖北 武汉 430079)
邻苯二甲酸酯(PAEs)是一种人工合成的有机化合物,可以作为增塑剂添加到塑料制品中以增加其可塑性、柔韧性和延展性,因此被大量生产并广泛应用于工业和制造业中[1].研究表明,传统增塑剂邻苯二甲酸二乙基己酯(DEHP)可对实验动物的脑、肾脏、肺脏、肝脏等多种器官造成损伤[2-3],从而被以邻苯二甲酸二异癸酯(DIDP)为首的一些新型增塑剂逐渐取代.目前,DIDP已经在全球范围内得到广泛应用,主要用于聚氯乙烯(PVC)薄膜、食品包装材料、家具地板等建筑材料和医疗用品中[4].塑料中的 DIDP释放后,扩散至空气、土壤和水体中,造成环境富集[5].DIDP可通过口腔摄入、气道吸入、皮肤暴露、医疗注射等途径进入人体.由于儿童极易将PVC材质的玩具放入口中,所以其经口腔摄入 DIDP的风险相对较大[6].流行病学调查显示,PAEs暴露与儿童和塑料行业工人的过敏症高发率之间存在一定联系[7],而Shen等发现DIDP的长期暴露可使小鼠形成获得性过敏性体质并加重过敏原诱导的过敏性皮炎[8].
DIDP可对健康造成一定危害,且其在全球范围内应用广泛,因此相关的毒理学研究非常重要.欧盟在对于 DIDP的风险评估报告中指出,DIDP在生殖方面无明显毒性,但是对小鼠后代存在不利影响[9].此外,研究表明,DIDP可使小鼠肝肾器官出现明显肿大,同时高浓度 DIDP暴露可促进小鼠肝细胞腺瘤的增殖[10].对于传统增塑剂 DEHP、邻苯二甲酸丁基苄酯(BBP)、邻苯二甲酸二异壬酯(DINP)等物质的研究表明,此类物质可对小鼠大脑产生损伤,影响其学习记忆能力[11-12].然而,目前有关新型增塑剂 DIDP神经毒性的研究相对较少,特别是其对大脑功能的影响更是鲜有报道.为此,本研究通过对不同浓度DIDP暴露下的小鼠进行 Morris水迷宫实验,测定 DIDP对小鼠学习和记忆的影响以及白藜芦醇(Res)对机体的保护作用,并通过测量受试小鼠脑组织中氧化应激和炎症因子指标,以期深入探索DIDP的神经毒性以及氧化应激在DIDP致小鼠神经毒性中的作用.
1 材料与方法
1.1 实验动物
本研究选用5~6周龄SPF级雄性昆明小鼠,体重(26±2)g,购自湖北省实验动物中心.动物饲养于华中师范大学实验动物中心.每天光照 12h,黑暗12h,给予充足的水和食物.
1.2 试剂与仪器
试 剂 :DIDP(Sigma,纯 度 >99%),吐 温 -80(Amresco),Res(Sigma,纯度>97%),8-羟基脱氧鸟苷(8-OHdG)酶联免疫吸附试剂盒(Bluegene),肿瘤坏死因子(TNF-α)、白细胞介素 1β(IL-1β)酶联免疫吸附试剂盒(eBioscience)、微量还原型谷胱甘肽(GSH)试剂盒(南京建成),2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)(Sigma,纯度>97%),硫代巴比妥酸(TBA,上海试剂二厂),其他试剂均为国产分析纯.
仪器:低温冷冻离心机(Eppendorf-5415R),三用电热恒温水箱,FL×800荧光酶标仪(Bio-Tek,全波长酶标仪(DNM-9602).
1.3 实验方法
将42只雄性昆明小鼠随机分成6组,每组7只,分别标记为 A:生理盐水组;B:1.5mg/(kg⋅d)D IDP 组;C:15mg/(kg⋅d) DIDP 组;D:150mg/(kg⋅d)DIDP 组;E:Res 组;F:150mg/(kg⋅d)DIDP+Res 组.用生理盐水将DIDP与吐温80以体积比1:1配制成 15mg/mL的染毒母液,使用时按照比例用生理盐水稀释成 0.15,1.5mg/mL的染毒液进行染毒.每天每只小鼠的DIDP灌胃量(mL)与小鼠体重(g)的比值是 1:100,确保最终的染毒剂量.Res:先加入无水乙醇对Res粉末进行促溶,然后加入所需体积的生理盐水配置成 2mg/mL的Res溶液,确保最终的剂量是 20mg/(kg⋅d),现用现配;对照组按照同样比例灌胃生理盐水.每天清晨进行灌胃,连续染毒 9d,其中 150mg/(kg⋅d)DIDP+Res组在染毒2h后进行Res灌胃.本实验全部测试,均重复3次.
1.4 Morris水迷宫实验
Morris水迷宫由英国心理学家Morris于上世纪80年代设计而成,主要应用于啮齿类动物学习和记忆能力的研究,如今在神经生物学领域内得到广泛应用.本实验采用的水迷宫如图1所示,小鼠被放置在一个直径为1.2m的内壁不反光的不锈钢圆形水箱中,所处的实验环境安静,光线布局合理.其中水池深为 60cm,水温为(24±1)℃.将圆形水池按照东西南北4个等距点分为4个象限(NW、NE、SE、SW),每个象限的池壁上对应不同的图形,小鼠可根据图形识别位置并产生空间记忆.逃逸平台位于NW象限的正中央距离池壁30cm,淹没于水下 1cm.实验时,根据方案选择恰当的水点,使小鼠面向池壁,将其轻放入水中,让其自由游泳.水池上方的摄像机将其游泳轨迹、速度以及逃逸时间等记录并传入计算机,由smart 3.0软件记录并分析[13].

图1 Morris水迷宫实验装置示意Fig.1 Experimental system of Morris water maze
水迷宫实验主要由定向航行和空间探索两个实验组成:定向航行实验主要用来测试小鼠的学习能力,空间探索实验主要测试小鼠的记忆能力.前7d的实验中,小鼠染毒4h后进行游泳训练.将小鼠分别从NE、SE、SW 3个象限中放入,同时开始记时.每天训练3次,每次时间为60s.若小鼠在60s内登上逃逸平台且停留3s,则训练结束,所花费的时间即为逃逸潜伏期;若小鼠在 60s内并未发现逃逸平台,则记录逃逸潜伏期为 60s.然后人工将小鼠放置于逃逸平台后并计时,持续30s后拿出,目的在于让小鼠观察四周,学习并定位平台所在位置,形成了一定的空间记忆.第 8d为小鼠记忆遗忘期,正常染毒但不进行实验.1d的遗忘期后,在第 9d进行空间探索实验,将平台拆除后按照之前方法进行实验,小鼠自由游泳60s.通过比较不同组小鼠在逃逸平台所在象限(NW象限)的停留时间以及游泳轨迹图进而分析得到小鼠的学习和记忆情况[14].
1.5 脑组织样品的制备
第10d将小鼠脱颈处死.取脑组织置于冰上,称量并记重.按10mL/g添加PBS(pH=7.5)并使用匀浆器配制成 10%的脑组织匀浆.脑组织匀浆在4℃、10000rpm的条件下离心15min,收集上清并进行分装后,置于-80℃冰箱内冷冻保存.
1.6 脑组织海马体病理学检测
将小鼠脑组织取出后,用 4%的多聚甲醛进行固定过夜.常规脱水,石蜡包埋,取小鼠脑组织中海马体进行H&E染色.显微镜观察、拍照.
1.7 8-OHdG和炎症因子TNF-α、IL-1β的检测
采用酶联免疫吸附测定法(ELISA) 检测脑组织匀浆中 8-OHdG含量以及炎症因子TNF-α、IL-1β的含量,按照说明书中具体步骤进行操作.
1.8 氧化应激水平的测定
ROS测定:采用DCF荧光法[15].用PBS缓冲液先将 10mmol/L的 DCFH-DA 荧光染料稀释1000倍,然后将脑组织匀浆液稀释25倍.取稀释后染料和组织匀浆各 100μL混匀,在 37℃下孵育10min后,测量其在480nm激发光,520nm发射光下的荧光强度.MDA含量测定:采用TBA法[16].取5mL试管,加入0.5mL待测脑组织匀浆.各管加入2mL0.6%TBA溶液,混匀后放置于沸水浴中15min,冷却.用离心机在 10000r/min条件下离心10min,取上清液.分别在450,532,600nm波长下测定吸光值,按照公式:浓度=[6.45(OD532-OD600)-0.56OD450]/prot计算样品中MDA的浓度.GSH含量测定:使用GSH试剂盒来检测脑组织中GSH的含量,具体步骤按照说明书进行操作.
1.9 统计学分析
使用Origin 6.0软件作图,SPSS 17.0软件分析数据.水迷宫定向航行实验数据采用重复测量的方差分析,随后采用Tukey test做两两比较.其他数据采用单因素方差分析,随后采用Tukey test做两两比较.将P<0.05定为显著水平.
2 结果
2.1 体重变化及脑组织脏体比
如图 2A所示,小鼠每天自由进食和饮水,体重逐渐增加.与对照组相比,DIDP暴露组小鼠体重并未显著增加(P>0.05).如图2B所示,DIDP暴露组小鼠脑组织脏体比随着染毒浓度的增加而减小,与对照组相比,无统计学意义(P>0.05).
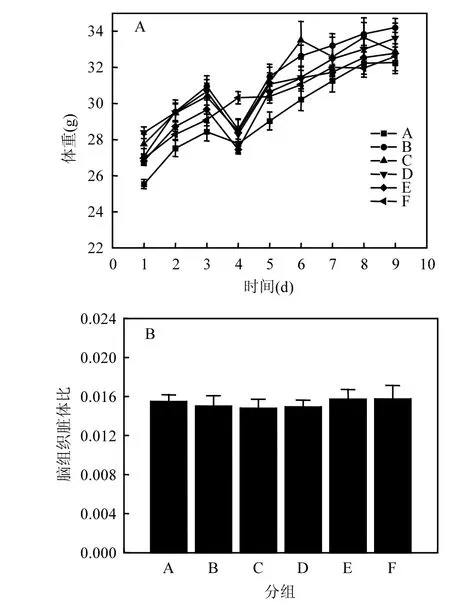
图2 各组小鼠体重变化及脑组织脏体比Fig.2 Weight changes and Brain organ-body ratios of mice in different groups
2.2 小鼠Morris水迷宫实验结果
如图 3A、3B所示,与对照组相比,150mg/(kg⋅d)DIDP组小鼠平均逃逸时间显著增加(P<0.05).与 150mg/(kg⋅d) DIDP 组相比,150mg/(kg⋅d) DIDP+Res组小鼠平均逃逸时间减少,有显著性差异(P<0.05).


图3 小鼠水迷宫实验结果Fig.3 The water maze test results of mice
图3C表示在第9d空间探索实验中,小鼠在原平台所在象限(即 NW 象限)停留时间.由图可知,与对照组相比,150mg/(kg⋅d) DIDP组小鼠的停留时间显著减少(P<0.05).与 150mg/(kg⋅d)DIDP组相比,150mg/(kg⋅d) DIDP+Res组小鼠停留时间增加,无统计学意义(P>0.05).
图3D表示小鼠在第9d空间探索实验中的游泳路径,显示出对照组小鼠游泳路径集中在原平台所在象限(即 NW 象限),具有方向性和目的性.而DIDP染毒组小鼠游泳路径没有目的性,且缺乏规律性.
2.3 小鼠脑组织中氧化应激指标的检测
2.3.1 ROS水平 如图4A所示,DIDP染毒组小鼠脑组织中ROS水平随染毒剂量的增加而升高.与对照组相比,15,150mg/(kg⋅d)DIDP组小鼠ROS水平显著升高(P<0.05);150mg/(kg⋅d) DIDP+ Res组小鼠与 150mg/(kg⋅d) DIDP组相比,ROS水平降低,且有显著性差异(P<0.05).
2.3.2 GSH含量 如图4B所示,DIDP染毒组小鼠脑组织中GSH浓度随染毒剂量的增加而降低.与对照组相比,15,150mg/(kg⋅d) DIDP组小鼠GSH 浓 度 显 著 降 低 (P<0.05);150mg/(kg⋅d)DIDP+ Res组小鼠与 150mg/(kg⋅d) DIDP组相比,GSH浓度升高,有显著性差异(P<0.05).
2.3.3 MDA含量 如图4C所示,DIDP染毒组小鼠脑组织中 MDA浓度随染毒剂量的增加而升高.与对照组相比,150mg/(kg⋅d) DIDP组小鼠MDA 浓度极显著升高(P<0.01);150mg/(kg⋅d)DIDP+Res组小鼠与 150mg/(kg⋅d) DIDP组相比,MDA浓度降低,有极显著性差异(P<0.01).
2.3.4 8-OHdG含量 如图4D所示,DIDP染毒组小鼠脑组织中8-OHdG浓度随染毒剂量的增加而升高.与对照组相比,150mg/(kg⋅d) DIDP组小鼠8-OHdG 浓度极显著升高(P<0.01); 150mg/(kg⋅d)DIDP+Res组小鼠与 150mg/(kg⋅d) DIDP组相比,8-OHdG浓度降低,有显著性差异(P<0.05).

图4 各组小鼠脑组织ROS、GSH、MDA和8-OHdG含量Fig.4 The ROS、GSH、MDA and 8-OHdG content in different groups
2.4 小鼠脑组织中炎症因子指标的检测
2.4.1 TNF-α含量 如图5A所示,DIDP染毒组小鼠脑组织中 TNF-α含量随染毒剂量的增加而升高.与对照组相比,15,150mg/(kg⋅d)DIDP组小鼠TNF-α含量极显著升高(P<0.01);150mg/(kg⋅d) DIDP+Res 组小鼠与 150mg/(kg⋅d)DIDP组相比,TNF-α含量降低,有极显著性差异(P<0.01).
2.4.2 IL-1β含量 如图5B所示,DIDP染毒组小鼠脑组织中 IL-1β含量随染毒剂量的增加而升高.与对照组相比,15mg/(kg⋅d)DIDP组小鼠IL-1β含量显著升高(P<0.05),150mg/(kg⋅d) DIDP组小鼠 IL-1β含量极显著升高(P<0.01);150mg/(kg⋅d) DIDP+Res组小鼠与150mg/(kg⋅d) DIDP组相比,IL-1β含量降低,有极显著性差异(P<0.01).

图5 各组小鼠TNF-α和IL-1β含量Fig.5 The TNF-α and IL-1β content in different Groups
2.5 小鼠大脑海马区H&E染色切片
如图6所示,对照组(图6A)结果显示小鼠海马 CA1区锥体细胞分布均匀,细胞整齐排列,细胞形态完整,多数呈多角形,锥体细胞顶状树突明显可见,轮廓清晰.而随着 DIDP暴露浓度的升高,15,150mg/(kg⋅d) DIDP 组(图 6C、图 6D)小鼠大脑可见损伤,表现为锥体细胞排列松散,混乱,细胞肿胀变圆,顶状树突消失.150mg/(kg⋅d)DIDP+Res组(图6F)小鼠海马CA1区存在受损细胞,与 150mg/(kg⋅d) DIDP组相比,正常细胞数量增多,细胞损伤情况得到一定的缓解.
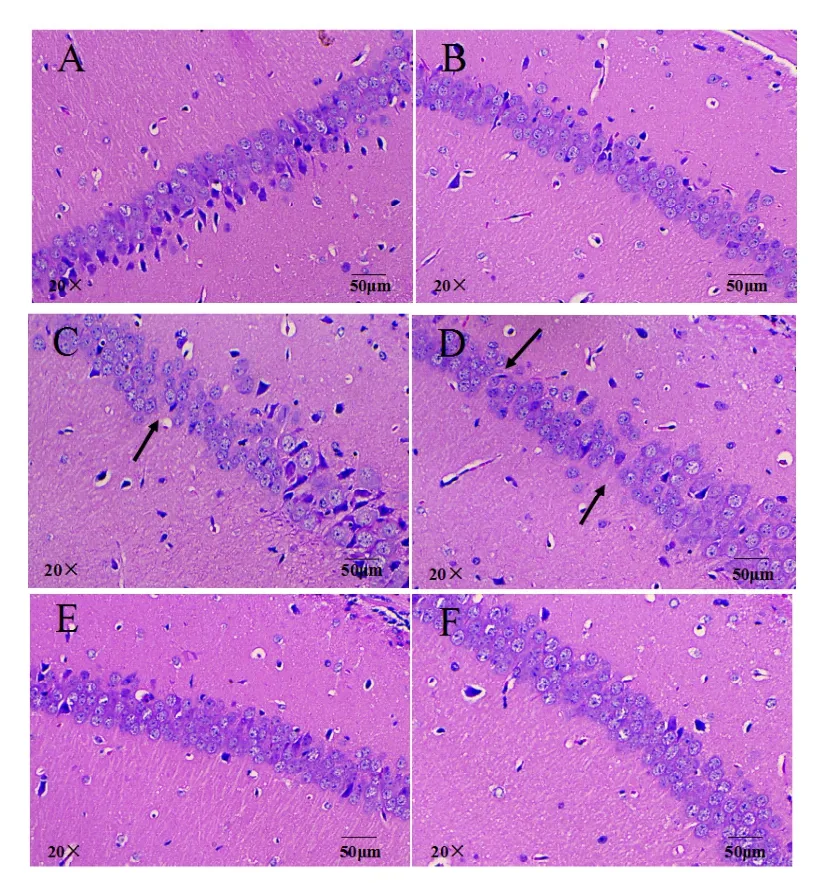
图6 各组小鼠脑组织海马体H&E染色Fig.6 H&E staining of hippocampus in brain tissue in different groups
3 讨论
3.1 DIDP的浓度设置
DIDP的日摄入耐受量(TDI)值为 0.25mg/kg/d[16].在这个限制的基础上,考虑到人与啮齿动物之间耐药性的差异,故设置小鼠每日灌胃浓度为:0,1.5,15,150mg/(kg⋅d) DIDP.
3.2 DIDP对小鼠学习记忆能力的影响
Morris水迷宫实验可以系统全面地考察实验动物空间认知加工的过程,通过定向航行和空间探索实验观察实验动物的学习与记忆能力,客观地反映其认知水平.海马是脑内同空间记忆密切相关的结构.刘锋明等研究表明BBP染毒的小鼠海马组织受到损伤,学习记忆能力明显下降[11].本研究表明,150mg/(kg⋅d) DIDP组小鼠在前 7d的定向航行实验中,平均逃逸时间显著增加,而在第9d的空间探索实验中,其在原平台所在象限停留时间缩短,游泳路径大多无目的性且不规则.病理学检测结果表明,15,150mg/(kg⋅d) DIDP组小鼠的海马组织受到损伤.这与Tang等研究结果是一致的[12].因此,DIDP暴露导致的小鼠学习记忆能力下降可能与其引起的海马组织受损有关.
3.3 DIDP的氧化损伤作用
生物细胞的新陈代谢能够产生ROS.正常情况下,细胞内的ROS会被胞内抗氧化酶等还原性物质清除,使体内自由基的产生与消除处于平衡状态.若机体受到刺激发生氧化损伤,细胞可能会产生过量的ROS,通过氧化应激进一步造成细胞和组织不同程度的损伤[17].过量的ROS会引发脂质过氧化作用,MDA是脂质过氧化作用最终的分解产物[19].ROS过量还会引发 DNA损伤,而8-OHdG是目前公认的 DNA损伤的生物标志物
[20].GSH是体内重要的氧自由基清除剂,过量的 ROS可以消耗机体内 GSH,导致机体抗氧化能力下降[18].本研究中,15,150mg/(kg⋅d) DIDP 可以使小鼠脑组织 ROS含量升高,而 MDA、8-OHdG含量的升高表明小鼠脑组织中脂质过氧化水平升高,DNA出现一定程度的损伤.同时,因DIDP暴露引起的小鼠脑组织中GSH含量的降低反映出机体抗氧化能力降低.以上生物指标含量的变化表明,DIDP对小鼠脑组织造成了一定程度的氧化应激.Tang等[12]研究表明,脑组织氧化应激水平升高可造成小鼠学习记忆能力的下降.氧化应激可以通过增加炎症因子TNF-α和IL-1β的表达量进一步激活炎症信号通路[21-22].本实验中, DIDP染毒组小鼠的脑组织中炎症因子TNF-α 和IL-1β的表达量升高,显示炎症反应被激活.而 Ma等研究表明学习记忆能力下降的小鼠,其大脑中炎症因子表达升高[23].以上结果表明,DIDP致小鼠学习和记忆能力下降可能与其在脑组织中造成的氧化应激和炎症反应损伤有关.机制可能是 DIDP及其主要代谢产物对大脑中海马组织的神经细胞膜造成了氧化损伤,使神经信号传导受到影响,进而影响学习和记忆力.
3.4 Res的抗氧化作用
Res是广泛存在于葡萄、黎芦、虎杖等植物中的一种多酚类化合物,其重要特点之一是具有良好的抗氧化性[24].Res含有3个酚羟基,在机体中可以竞争性结合自由基,从而减少自由基含量,缓解氧化应激造成的损伤,具有降低血脂、诱导肿瘤细胞凋亡、提高免疫功能、抗氧化等作用[25].杨迎暴等研究显示,Res对大鼠脊髓损伤脂质过氧化反应和活性氧水平有抑制作用[26].王娜等[27]研究显示,20mg/(kg⋅d) Res能明显改善大鼠高肠源性内毒素血症,提高肠黏膜的抗氧化作用.故本实验中,选用 20mg/(kg⋅d) Res 对 150mg/(kg⋅d)DIDP组小鼠进行保护.结果显示,其脑组织中的氧化损伤与 DNA损伤受到抑制,且学习记忆能力的下降也得到显著缓解,表明可能由于 Res降低了机体自由基含量,并提高了 GSH 的水平,因而降低了氧化应激对机体产生的损伤,从而能够对 DIDP暴露导致的小鼠脑损伤进行有效保护.也进一步证明,氧化应激在 DIDP致小鼠学习和记忆能力下降的过程中具有重要作用.
4 结论
4.1 15,150mg/(kg⋅d) DIDP暴露可对小鼠脑组织造成明显的氧化损伤,并促进炎症因子 TNF-α和IL-1β的表达.
4.2 Morris水迷宫结果显示,DIDP能够对小鼠学习与记忆能力产生一定程度影响,引起小鼠学习和记忆的障碍.其机制可能是 DIDP及其代谢产物通过对小鼠大脑中海马组织造成氧化损伤,进而影响小鼠的学习记忆能力.
4.3 Res可在一定程度上保护机体,减少由DIDP引起的氧化损伤.
[1]Swan S H. Environmental phthalate exposure in relation to reproductive outcomes and other health endpoints in humans [J].Environmental Research, 2008,108(2):177-184.
[2]Yang G T, Qiao Y K, Mao C X, et al. Effects of Di-(2-ethylhexyl)phthalate on Ovalbumin-Immunized Rat Asthma Model: A Histopathological Study [J]. Asian Journal of Ecotoxicology,2008,3(2):206-208.
[3]Park J D, Habeebu S S, Klaassen C D. Testicular toxicity of di-(2-ethylhexyl)phthalate in young Sprague-Dawley rats [J].Toxicology, 2002,171(2/3):105-115.
[4]Bang D Y, Kyung M, Min J K, et al. Human Risk Assessment of Endocrine-Disrupting Chemicals Derived from plastic Food Containers [J]. Comprehensive Reviews in Food Science & Food Safety, 2012,11(5):453-470.
[5]Liang D W, Zhang T, Fang H H, et al. Phthalates biodegradation in the environment [J]. Applied microbiology and Biotechnology,2008,80(2):183-198.
[6]Stringer R, Labunska I, Santillo D, et al. Concentrations of phthalate esters and identification of other additives in PVC children's toys [J]. Environmental Science and pollution Research,2000,7(1):27-36.
[7]Jaakkola J J K, Knight T L. The Role of Exposure to phthalates from polyvinyl Chloride products in the Development of Asthma and Allergies: A Systematic Review and Meta-Analysis [J].Environmental Health perspectives, 2008,116(7):845-853.
[8]Shen S, Li J, You H, et al. Oral exposure to diisodecyl phthalate aggravates allergic dermatitis by oxidative stress and enhancement of thymic stromal lymphopoietin [J]. Food &Chemical Toxicology, 2016,99:60-69.
[9]Parks L G, Ostby J S, Lambright C R, et al. The plasticizer Diethylhexyl phthalate Induces Malformations by Decreasing Fetal Testosterone Synthesis during Sexual Differentiation in the Male Rat [J]. Toxicological Sciences An Official Journal of the Society of Toxicology, 2000,58(2):339-349.
[10]Cho W S, Jeong J, Choi M, et al. 26-Week carcinogenicity study of di-isodecyl phthalate by dietary administration to CB6F1-rasH2transgenic mice [J]. Archives of Toxicology, 2011,85(1):59-66.
[11]刘锋明,刘旭东,闵安娜,等.邻苯二甲酸丁基苄酯对小鼠学习和记忆能力的影响 [J]. 中国环境科学, 2013,33(6):1106-1112.
[12]Tang J, Yuan Y, Wang D, et al. A study on the neurotoxicity of di(2-ethylhexyl) phthalate on Kun-Ming mice [EB/OL].Cpeimages.qut.edu.au, 2012.
[13]Morris R. Developments of a water-maze procedure for studying spatial learning in the rat [J]. Journal of Neuroscience Methods,1984,11(1):47-60.
[14]Abdel-Salam O M, Salem N A, El-Shamarka M E, et al. Studies on the effects of aspartame on memory and oxidative stress in brain of mice [J]. European Review for Medical &Pharmacological Sciences, 2012,16(15):2092-101.
[15]聂金雷,时庆德,张 勇,等.利用荧光探针直接测定线粒体活性氧的形成 [J]. 中国应用生理学杂志, 2002,18(2):196-198.
[16]Yen T H, Lin-Tan D T, Lin J L. Food safety involving ingestion of foods and beverages prepared with phthalate-plasticizercontaining clouding agents [J]. Journal of the Formosan Medical Association, 2011,110(11):671-684.
[17]Vishal T, Gupta R. Effect of Vitex negundo on oxidative stress [J].Indian Journal of pharmacology, 2005,37(1):2679-2685.
[18]Yang Z, Zhang Y, Yang Y, et al. Pharmacological and toxicolcogical target organelles and safe use of sing-walled carbon nanotubes as drug carriers in treating Alzheimer disease[J]. Nanomedicine, 2010,6(3):427-441.
[19]赵 飞,王 摆,张晓娜,等.久效磷农药对金鱼肝细胞DNA的损伤及其机制研究 [J]. 中国环境科学, 2015,35(5):1563-1569.
[20]陆 杰,代园园,罗 慧,等.邻苯二甲酸二异壬酯致小鼠肝组织氧化损伤的研究 [J]. 中国环境科学, 2015,35(1):285-290.
[21]Brown D M, Donaldson K, Borm P J, et al. Calcium and ROS-mediated activation of transcription factors and TNF-alpha cytokine gene expression in macrophages exposed to ultrafine particles [J]. American Journal of Physiology Lung Cellular &Molecular Physiology, 2004,286(2):344-353.
[22]Shankar E, Vykhovanets E V, Vykhovanets O V, et al. High-fat diet activates pro-inflammatory response in the prostate through association of Stat-3and NF-κB [J]. Prostate, 2012,72(3):233-243.
[23]Ma P, Liu X, Wu J, et al. Cognitive deficits and anxiety induced by diisononyl phthalate in mice and the neuroprotective effects of melatonin [J]. Scientific Reports, 2015,5:14676.
[24]Jang M, Pezzuto J M. Cancer chemopreventive activity of resveratrol [J]. Drugs Under Experimental & Clinical Research,1999,957(25):65-77.
[25]Creasy L L, Coffee M. Phytoalexin production potential of grape berries [J]. Journal of the American Society for Horticultural Science, 1988,113(2):230-234.
[26]杨迎暴,朴英杰.白藜芦醇对急性脊髓损伤早期脂质过氧化反应和活性氧水平的抑制作用 [J]. 中国临床药理学与治疗学,2002,7(3):193-196.
[27]王 娜,唐雪婵,马伟平,等.白藜芦醇对梗阻性黄疸大鼠肠黏膜氧化应激损伤的影响 [J]. 河北医科大学学报, 2015,36(6):621-624.
