南方稻田土壤有效态镉提取方法研究
2018-01-23熊婕朱奇宏黄道友朱捍华许超王帅王辉
熊婕,朱奇宏,黄道友*,朱捍华,许超,王帅,王辉
(1. 中国科学院亚热带农业生态研究所,亚热带农业生态过程重点实验室,湖南 长沙 410125;2. 中国科学院大学,北京 100049;3. 湖南农业大学资源环境学院,湖南 长沙 410128)
镉(Cd)是我国农田最为主要的重金属污染元素之一,其点位超标率高达7.0%[1],且农业部的调查结果显示,我国稻米镉的超标比例高达10.0%[2]。镉污染稻田多分布在我国南方地区[3-4],稻田镉污染已威胁到我国的粮食安全[5-6]。明确南方稻田土壤镉污染程度和风险,是指导南方镉污染稻田管理和修复治理的重要前提。我国的土壤环境质量标准[7]和食用农产品产地环境质量评价标准[8]中,均以土壤全镉含量作为土壤镉污染的评价指标。然而,相较于土壤全镉含量,采用单一提取剂测定的土壤有效态镉含量能够更好地反映土壤中镉的移动性和植物吸收积累镉的风险[9]。研究确定适用于我国南方稻田土壤的有效态镉提取方法,对于准确评价南方稻田镉污染风险以及指导镉污染农田修复具有重要意义。
目前,国际常用的土壤有效态镉提取剂有无机盐提取剂,如CaCl2、NaNO3、NH4OAc;酸类提取剂,如CH3COOH、HCl、Mehlich I;螯合试剂,如DTPA、EDTA、Mehlich III[10]。各国有效态镉的标准提取方法不一,法国采用DTPA-TEA法,英国采用EDTA法,瑞士采用NaNO3法,荷兰采用CaCl2法,意大利采用NH4OAc-EDTA法[10-11]。我国以DTPA法为土壤中有效态镉的标准提取方法[12],但DTPA法最初是针对中性和偏碱性旱作土壤提出的,而我国南方稻田土壤多呈酸性,且长期经历反复的干湿交替过程,导致该方法在表征我国南方稻田土壤镉有效性时效果不佳[13]。为此,本研究选取我国南方典型镉污染稻田土壤,对9种提取方法开展对比分析,采用提取态镉含量与稻米镉含量的相关关系为主要评价指标,以期确定适用于我国南方稻田土壤的有效态镉提取方法。
1 材料与方法
1.1 样品采集与预处理
湖南省位于我国中南部,全省的水稻种植面积和产量均位居全国首位,也是稻田镉污染问题最为突出的省份之一。为此,本研究以湖南省稻田为主要对象,样品采集自湖南省的37个县(市、区)。供试土壤样品为包括板页岩风化物(样本数n=11)、第四纪红色粘土(n=17)、河湖沉积物(n=22)、花岗岩风化物(n=7)、砂砾岩风化物(n=12)、石灰岩风化物(n=12)和紫色砂页岩风化物(n=9)在内的7种成土母质发育的水稻土,采集的早稻品种包括湘早籼32(n=10)、湘早籼45(n=14)、中嘉早 17(n=13)、中早 39(n=16)、株两优 189(n=11)和株两优 819(n=26),晚稻样品包括金优 59(n=18)、湘晚籼12号(n=22)和湘晚籼13号(n=31)等水稻品种。
2014年3月于早稻种植前在每个代表性田块选取5个分样点,采集每个分样点处0~20 cm的表层土壤,每个分样点0.2 kg,共1.0 kg,混匀后代表该样点的土壤样品,共采集90个土壤样品。土壤样品经自然风干,四分法缩至0.25 kg,研磨,分别过1 mm和0.15 mm的尼龙筛后密封保存待测。早稻和晚稻成熟时期在采集土壤的对应田块,以梅花5点法采集稻谷样品,每个稻谷分样点选取1株水稻,采集其全部稻谷,共采集5株水稻的稻谷,混匀后为该样点稻谷样品,共采集早晚稻稻谷样品各90个。稻谷样品经自来水和去离子水清洗,于烘箱60 ℃烘至恒重,分离出稻米,用不锈钢粉碎机粉碎后密封保存待测。
1.2 土壤提取态镉分析方法
本研究采用0.1 mol/L CaCl2(T1)、0.01 mol/L CaCl2(T2)、DTPA(T3)、NH4OAc(T4)、TCLP(T5)、HCl(T6)、Mehlich III(T7)、NaNO3(T8)和Mehlich I(T9)共9种提取方法分析土壤中提取态镉含量。详细提取方法见表1,提取溶液中的镉含量采用电感耦合等离子体发射光谱仪(ICP-OES,720ES)进行测定。
1.3 其他指标与分析方法
土壤粘粒含量采用0.5 mol/L Na6O18P6分散,激光粒度分析仪(Mastersizer 2000)测定[16];有机质采用重铬酸钾外加热法测定[17];阳离子交换量(CEC)采用乙酸铵交换法测定[17];pH值采用PHs-3C酸度计测定,2.5∶1水土比(V∶W)[17]。土壤全量镉采用HCl-HNO3-HClO4(VHCl∶VHNO3∶VHClO4=15∶5∶3)消化,稻米镉采用 HNO3-HClO4(VHNO3∶VHClO4=5 ∶1)消化[17],分别应用标准物质GSS-5和GSB-23对土壤和稻米进行质量控制,电感耦合等离子体发射光谱仪(ICP-OES,720ES)测定。土壤和稻米样品指标均设置3个重复进行测量分析,每批样品加测两个平行空白样。
1.4 数据处理
数据处理和图表制作采用Microsoft Excel 2016,各提取态镉含量与土壤全镉以及稻米镉含量的相关性分析采用IBM SPSS Statistics 21.0。
2 结果与分析
2.1 土壤基本性质和稻米镉含量
7种成土母质发育水稻土的理化性质如pH值、粘粒含量、有机质等均存在一定的差异。从总体来看,土壤pH的均值为5.82(表2),以酸性土壤为主。土壤有机质含量较高,平均含量为41.24 g/kg,粘粒含量的平均含量为11.56%,阳离子交换量的均值为14.29 cmol/kg。

表1 土壤提取态镉分析方法Table 1 Methods of extractable Cd in soils
土壤全镉的含量范围为0.18~2.36 mg/kg,平均含量为0.44 mg/kg,为国家土壤环境质量标准II级限值(0.30 mg/kg)[7]的1.47倍,整体超标率高达63.3%(57/90)。早稻米镉含量范围为0.01~0.63 mg/kg,平均值为0.11 mg/kg,低于国家食品安全标准限值(0.20 mg/kg)[7],9个稻米样品镉含量高于标准值,超标率为10.0%。晚稻米镉平均含量为0.21 mg/kg,略超出标准值,分布区间为0.01~2.54 mg/kg,27个稻米样品镉含量高于标准值,超标率为30.0%。

表2 供试土壤基本性质和稻米镉含量Table 2 Properties of the tested soils and Cd contents in rice

图1 不同提取方法的提取能力Fig. 1 Extraction capacity of different extraction methods
2.2 各提取方法的提取能力
提取剂对土壤中镉的提取能力是选择适宜提取方法的重要衡量指标之一,提取能力较弱将对实验结果重现性造成不利影响,提取能力太强可能导致对土壤有效态镉的高估。将王水-高氯酸消解的土壤全镉含量视为100%,以此作为参照分析9种提取方法的提取能力(图1)。其提取态镉占全镉含量的比例(提取率)依次为T7>T6>T9>T3>T1>T5>T4>T2>T8, 提 取 率 的 变 化 范 围 为4.7%~74.4%。9种方法的提取能力存在较大差异,T7和T6的提取能力较强,其提取态镉含量分别占土壤全镉含量的74.4%和69.8%;T9和T3的提取能力次之,T1和T5的提取能力居中;T8的提取能力最弱,其提取态镉含量仅为土壤全镉含量的4.7%。
9种提取方法的提取态镉与土壤全镉的相关关系存在较大差异。对于总体样品,提取能力弱的T2和T8的提取态镉与土壤全镉含量的相关性没有达到显著水平(P>0.05)。提取能力中等的T1和T9的提取态镉与土壤全镉呈显著正相关(P<0.05),相关系数(r)较小,分别为0.209和0.237(表3)。其余5种提取剂的提取态镉与土壤全镉的相关性均达到极显著水平(P<0.01),提取能力最强的T7的提取态镉与土壤全镉的相关性最好,相关系数达0.898。由于样品数相对较少,各提取态镉与不同成土母质发育土壤的全镉含量的相关分析和总体分析的结果有所不同。除了花岗岩风化物外,T2和T8的提取态镉与其余成土母质发育土壤的全镉含量相关性不显著(P>0.05)。提取能力较强的无机盐提取剂(T1和T4)和酸类提取剂(T5、T6和T9)仅与部分成土母质发育土壤的全镉含量呈显著正相关(P<0.05),酸类提取剂的提取态镉与土壤全镉之间的相关系数(r)较大。螯合提取剂(T3和T7)的提取态镉与土壤全镉的相关性较好,T3的提取态镉与7种成土母质发育土壤的全镉含量均达到显著相关水平(P<0.05)。
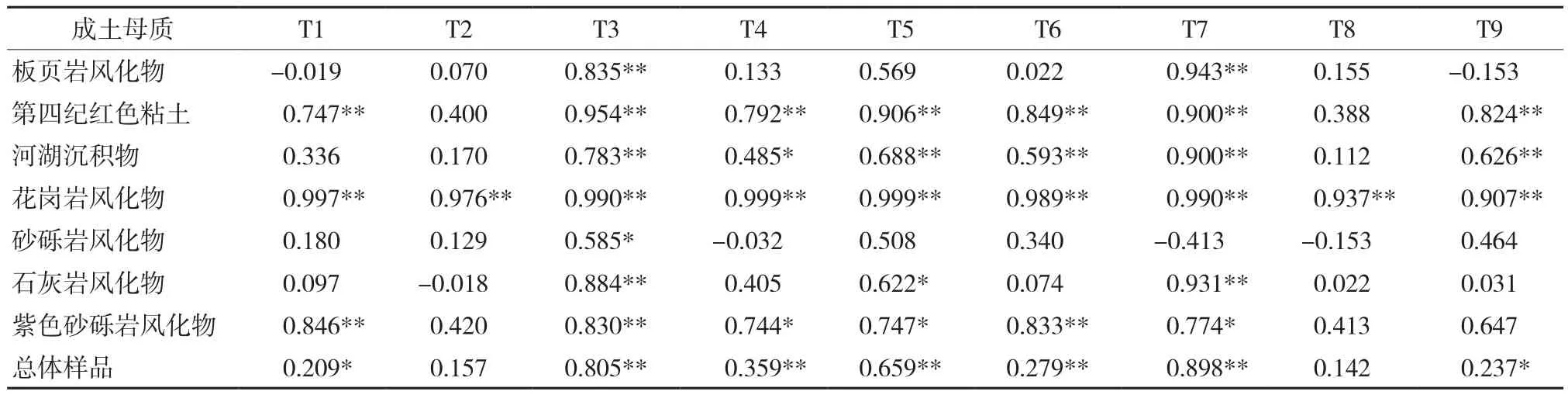
表3 不同成土母质水稻土提取态镉含量与土壤全镉含量的相关关系(r)Table 3 Correlations between extractable Cd in different soil parent materials and total Cd contents in soils (r)
2.3 稻米镉与土壤镉的相关关系
土壤全镉含量与早稻、晚稻以及两季稻米镉含量相关性均不显著(P>0.05),可见土壤全镉含量虽能直观地表示土壤受镉污染的程度,但其并不能较好地反映土壤中镉的植物有效性和吸收积累的风险(表4)。从相关系数来看,9种提取态镉含量与稻米镉含量的相关关系多优于土壤全镉与稻米镉的关系。土壤提取态镉含量与稻米镉含量的相关关系受到水稻季别的影响,8种提取态镉含量与早稻(当季)米镉含量的相关关系达到极显著水平(P<0.01),仅T7的提取态镉含量与稻米镉含量的相关关系为显著水平(P<0.05)。提取态镉含量与晚稻(后茬)米镉含量的相关关系明显弱于与早稻米镉含量的关系,其中达到极显著相关水平(P<0.01)的有T1、T2、T4、T8和T9五种方法,达到显著水平(P<0.05)的为T5和T6两种提取方法,而T3和T7的提取态镉含量与晚稻米镉含量的相关关系尚未达到显著水平(P>0.05)。早晚稻稻米综合分析结果显示,除T3和T7两种方法提取态镉含量与稻米镉含量未达到显著水平外,其他7种方法的提取态镉含量与稻米镉含量的相关关系均达到了极显著水平(P<0.01)。
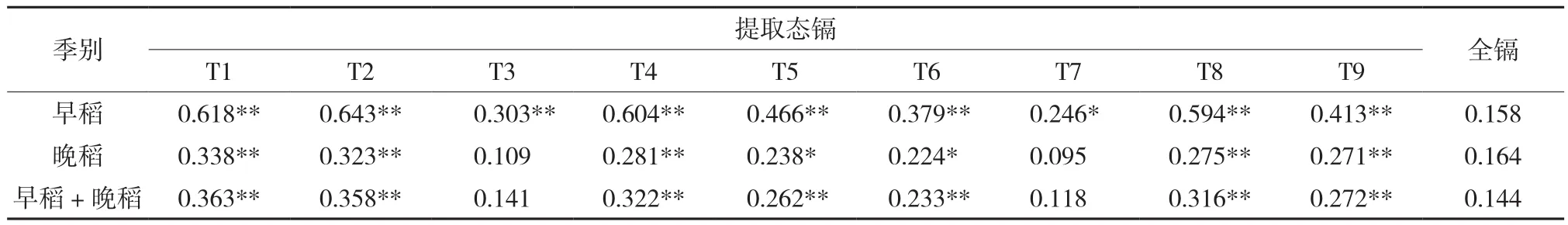
表4 稻米镉含量与土壤提取态镉及全镉含量的相关关系(r)Table 4 Correlations between Cd contents in rice and extractable Cd and total Cd contents in soils (r)
将土壤样品按照不同成土母质进行统计,分析稻米镉与土壤提取态镉含量的相关关系(表5),可见不同成土母质土壤的分析结果与总体土壤样品的分析结果较为一致。对于大部分成土母质发育的土壤,无机盐提取剂(T1、T2、T4和T8)的提取态镉含量与稻米镉含量的相关关系优于酸类提取剂(T5、T6和T9)和螯合提取剂(T3和T7)。不同成土母质发育土壤的提取态镉含量与稻米镉含量的相关关系同样受到水稻季别的影响。无机盐提取剂提取的板页岩风化物、第四纪红色粘土、河湖沉积物以及花岗岩风化物发育土壤的提取态镉含量与早稻(当季)米镉含量呈显著(P<0.05)和极显著正相关(P<0.01)。不同成土母质土壤提取态镉含量与晚稻(后茬)米镉含量的相关关系较弱,除T8外,3种无机盐提取剂提取的河湖沉积物发育土壤的提取态镉含量与晚稻米镉含量呈显著(P<0.05)和极显著正相关(P<0.01),4种无机盐提取剂提取的板页岩风化物发育土壤的提取态镉含量与晚稻米镉含量均达到极显著相关水平(P<0.01)。将早晚稻稻米综合分析,结果显示,4种无机盐提取剂提取的板页岩风化物、河湖沉积物和砂砾岩风化物发育土壤的提取态镉含量与早晚稻米镉含量达到显著(P<0.05)和极显著相关水平(P<0.01)。

表5 稻米镉含量与不同成土母质土壤提取态镉含量的相关关系(r)Table 5 Correlations between extractable Cd in different soil parent materials and Cd contents in rice (r)
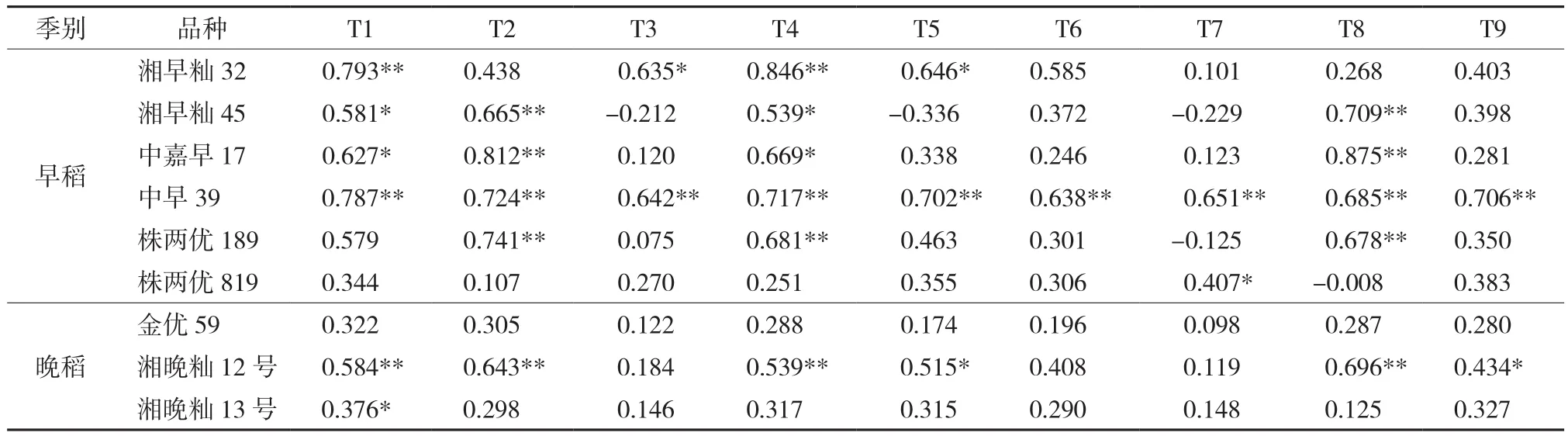
表6 不同品种水稻米镉含量与提取态镉含量的相关关系(r)Table 6 Correlations between soil extractable Cd and Cd in rice of different rice varieties (r)
考虑到不同品种水稻对镉的累积能力差异,将不同水稻品种的米镉含量与提取态镉含量分别进行了相关分析(表6)。由于样本数相对较少,其相关性的显著性检验结果与总体分析结果存在一定的差异。与酸类和螯合提取剂相比,无机盐提取剂的提取态镉含量与稻米镉含量的相关性较好,其提取态镉含量与大多数水稻品种的米镉含量呈显著和极显著正相关,与总体分析结果基本一致。对于早稻而言,除了T7,其余8种提取剂的提取态镉含量和株两优819的稻米镉含量相关性都不显著(P>0.05)。而9种提取态镉含量与中早39的稻米镉含量均达到极显著相关水平(P<0.01)。晚稻中3个主要品种水稻的相关性分析结果差异较大。金优59的稻米镉含量与采用的9种方法提取的提取态镉含量相关性均不显著(P>0.05),湘晚籼13号稻米镉也仅与T1的提取态镉含量呈显著正相关(P<0.05)。湘晚籼12号的稻米镉与无机盐提取剂的提取态镉含量均达到极显著相关水平(P<0.01),相关系数(r)为 0.539~0.696。
3 讨论
3.1 不同提取方法的提取能力差异
在不同土壤条件下,供试的9种方法提取的土壤镉形态不同,因而其提取能力存在差异。9种提取方法的提取能力为 T7>T6>T9>T3>T1>T5>T4>T2>T8。Mehlich III和 Mehlich I方法能提取水溶态、交换态、络合态以及部分酸溶态镉[18]。DTPA方法适用于偏中性或石灰性土壤,在应用于酸性土壤时,除了水溶态和交换态镉外,碳酸盐结合态和部分有机结合态、铁锰氧化物结合态的镉亦可被提取出来[19]。酸类提取剂如HCl和TCLP,pH值较低,溶解能力较强,除了可交换态镉,还能提取出土壤中的碳酸盐结合态、铁锰氧化态及有机结合态镉[20]。无机盐提取剂提取的镉形态一般为水溶态与可交换态,所以对土壤镉的提取能力较弱。
本研究采用了四种无机盐提取剂对供试土壤中的镉进行提取分析。NH4OAc与土壤镉发生络合反应形成稳定化合物,自身的缓冲能力可使土壤溶液pH值降低,从而提取出部分碳酸盐结合态镉,所以NH4OAc对酸性土壤中镉的提取能力较强[21]。Na+等单价阳离子对土壤表面吸附位点的竞争能力较弱[13],因此NaNO3呈现出较低提取能力,与Feng等[22]研究结果一致。Ca2+作为土壤中主要阳离子,在土壤悬浮液中凝聚能力比单价阳离子(Na+和NH4+)强[11,23],而氯化物提取剂与镉的螯合作用主要取决于提取剂浓度[24],高离子强度可增强Cd2+从带负电荷的土壤表面的解吸[25],所以0.1 mol/L CaC12对土壤中镉的提取能力强于其余无机盐提取方法。
3.2 不同提取方法的适用性差异
土壤有效态镉含量主要用来反映土壤中镉的植物可利用性和移动性,因而在农田土壤中其与植物吸收积累镉的相关关系是评价有效态镉提取方法适用性的重要指标。本研究结果表明,无机盐试剂的提取态镉含量与稻米镉的相关关系优于酸类提取剂和螯合试剂,其中0.1 mol/L CaCl2的提取态镉含量与稻米镉含量的关系最为紧密。
前期在旱作土壤上的大量研究结果证实,无机盐试剂的提取态镉含量能够较好地反映土壤中镉的植物可利用性,其中CaCl2法大多表现良好[26-28]。章明奎等[29]研究表明早熟禾吸收镉量与CaCl2和NH4OAc的提取态镉含量显著相关,但与提取能力较强的Mehlich I和Mehlich III的提取态镉含量相关性不显著。Gleyzes等[21]也发现硝酸盐或钙盐提取的污染土壤中的痕量金属元素与植物具有良好的相关性。Houba等[27]认为0.01 mol/L CaC12溶液的pH、浓度和组成与土壤溶液相似,其提取态镉含量可以较好地表明土壤镉的生物有效性。Meers等[28]研究禾本科植物对镉的吸收情况发现,较弱的提取剂反而具有较高的相关性,而且比较分析了12种提取方法,表明0.01 mol/L CaCl2能很好地评估镉的植物利用度。造成这种差异的原因可能是无机盐提取剂能较好地保持土壤原有性质,而螯合提取剂和酸类提取剂在提取过程中可能导致土壤理化性质和镉形态的变化,进而影响其表征土壤中镉植物有效性的效果[29]。然而,刘玉荣等[30]认为低浓度的无机盐试剂提取的提取态镉含量较低,重金属元素的背景值相对较大,可能对实验结果的测定造成干扰。本研究采用的0.1 mol/L CaCl2较目前旱地常用的0.01 mol/L CaCl2盐浓度更高,其提取率相应地由16.3%提升至41.9%,而且其提取态镉含量与不同季别的稻米镉含量均达到极显著相关水平(P<0.01),能够较好地反映土壤中镉的植物有效性,可推荐为我国南方稻田土壤有效态镉的提取方法。
3.3 提取方法适用的限制
值得注意的是,虽然0.1 mol/L CaCl2可用作我国南方稻田土壤有效态镉的提取方法,但其仅能在一定程度上反映稻田土壤中镉的植物可利用风险。从0.1 mol/L CaCl2提取态镉与早稻、晚稻、早晚稻米镉含量的相关系数(r分别为0.618、0.338和0.363)来看,该方法能够相对较好地预测当季水稻对镉的吸收与积累,但在评估后茬水稻的镉积累风险时适用性有限。造成这种现象的原因是多方面的,水稻对镉的吸收积累除受土壤镉影响外,也与水稻品种、土壤环境、稻田管理等因素有关。
Herath等[31]发现是水稻品种的形态或生理特征导致了其对重金属镉的耐受性与吸收积累能力的差异。水稻的种植环境,如土壤pH值、阳离子交换量及有机质含量等都将影响稻米中镉的累积水平[32]。以0.1 mol/L CaCl2的提取态镉含量和土壤pH为变量与早稻米镉的含量结合起来预测早稻对镉的吸收累积水平,得到回归方程:

其中:Cdrice和CdCaCl2分别表示早稻米镉的含量和0.1 mol/L CaCl2的提取态镉含量。方程中加入土壤pH后,R2提升较小,可能是因为0.1 mol/L CaCl2提取的有效态镉与土壤pH存在自相关,所以建立的回归方程中pH的影响较小。甘国娟等[33]的研究表明不同类型的土壤由于pH值、有机质和粘粒含量等理化性质的差异导致土壤镉含量不同,影响土壤中镉的生物有效性,从而导致稻米镉累积程度的差异。Rizwan等[34]认为除了土壤因素,水稻的种植模式,水分管理和肥料施用也将造成这一差异。因而,在实际应用中,该方法最好用于当季水稻的吸收积累风险评估,如果能够结合水稻品种、土壤条件和管理因子则更佳。
4 结论
为确定适用于我国南方稻田土壤的有效态镉提取方法,对比分析了螯合类、酸类和无机盐类共9种提取方法的提取能力及其提取态镉与稻米镉的相关关系。研究发现,供试9种方法的提取态镉含量占土壤全镉的4.7%~74.4%,但不同方法的提取能力存在较大差异,基本呈现螯合提取剂和酸类提取剂提取能力较强,无机盐提取剂提取能力最弱的变化规律。
供试9种方法的提取态镉与稻米镉含量的相关关系整体上优于土壤全镉含量,而无机盐试剂提取态镉与稻米镉含量的相关关系最好;其中0.1 mol/L CaCl2提取法具有较为适中的提取能力,且能够较好反映水稻对稻田土壤中镉的吸收累积风险,可推荐为我国南方稻田土壤有效态镉提取方法,而该方法在稻田土壤镉的当季有效性评价上的适用性更佳。
[1] 中华人民共和国环境保护部. 全国土壤污染状况调查公报[EB/OL]. (2014-04-17). http://www.zhb.gov.cn/gkml/hbb/qt/201404/t20140417_270670.htm.Ministry of Environmental Protection of the People’s Republic of China. Report on the national general survey of soil contamination[EB/OL]. (2014-04-17). http://www.zhb.gov.cn/gkml/hbb/qt/201404/t20140417_270670.htm.
[2] Li J R, Xu Y M. Immobilization of Cd in paddy soil using moisture management and amendment[J]. Environmental Science and Pollution Research, 2015, 22(7): 5580-5586.
[3] 黄道友, 陈惠萍, 龚高堂, 等. 湖南省主要类型水稻土镉污染改良利用研究[J]. 农业现代化研究, 2000, 21(6): 364-370.Huang D Y, Chen H P, Gong G T, et al. Research report on improvement and utilization of main type paddy soil polluted by cadmium in Hunan Province[J]. Research of Agricultural Modernization, 2000, 21(6): 364-370.
[4] 宋伟, 陈百明, 刘琳. 中国耕地土壤重金属污染概况[J]. 水土保持研究, 2013, 20(2): 293-298.Song W, Chen B M, Liu L. Soil heavy metal pollution of cultivated land in China[J]. Research of Soil and Water Conservation, 2013,20(2): 293-298.
[5] Hu Y A, Cheng H F, Tao S, et al. The challenges and solutions for cadmium-contaminated rice in China: A critical review[J].Environment International, 2016, 92-93: 515-532.
[6] 谢运河, 纪雄辉, 彭华, 等. 镉污染稻田改制玉米的农产品质量安全研究[J]. 农业现代化研究, 2014, 35(5): 658-662.Xie Y H, Ji X H, Peng H, et al. Agricultural product quality safety of conversion from double rice to rice/maize in a Cd polluted paddy field[J]. Research of Agricultural Modernization, 2014,35(5): 658-662.
[7] 杨阳, 李艳玲, 王美娥, 等. 湖南攸县稻米镉(Cd)富集特征及原因解析[J]. 环境科学学报, 2017, 37(4): 1502-1507.Yang Y, Li Y L, Wang M E, et al. Environmental characteristics of cadmium in rice and its influence factor in the Youxian prefecture,Hunan Province[J]. Acta Scientiae Circumstantiae, 2017, 37(4):1502-1507.
[8] 赵晓军, 陆泗进, 许人骥, 等. 土壤重金属镉标准值差异比较研究与建议[J]. 环境科学, 2014, 35(4): 1491-1497.Zhao X J, Lu S J, Xu R J, et al. Soil heavy metal cadmium standard limit and range of background value research[J],Environmental Science, 2014, 35(4): 1491-1497.
[9] Chavez E, He Z L, Stoffella P J, et al. Chemical speciation of cadmium: An approach to evaluate plant available cadmium in Ecuadorian soils under cacao production[J]. Chemosphere, 2016,150: 57-62.
[10] Rauret G. Extraction procedures for the determination of heavy metals in contaminated soil and sediment[J]. Talanta, 1998, 46(3):449-455.
[11] Pueyo M, Lopez-Sanchez J F, Rauret G. Assessment of CaCl2,NaNO3and NH4NO3extraction procedures for the study of Cd,Cu, Pb and Zn extractability in contaminated soils[J]. Analytica Chimica Acta, 2004, 504(2): 217-226.
[12] 农云军, 谢继丹, 黄名湖, 等. 超声提取法-ICP-MS测定土壤中有效态铅和镉[J]. 质谱学报, 2016, 37(1): 68-74.Nong Y J, Xie J D, Huang M H, et al. Measurement of available lead and cadmium in soil by ICP-MS with ultrasonic extraction[J].Journal of Chinese Mass Spectrometry Society, 2016, 37(1): 68-74.
[13] Zhu Q H, Huang D Y, Liu S L, et al. Assessment of single extraction methods for evaluating the immobilization effect of amendments on cadmium in contaminated acidic paddy soil[J].Plant, Soil and Environment, 2012, 58(2): 98-103.
[14] 岳聪, 汪群慧, 袁丽, 等. TCLP法评价铅锌尾矿库土壤重金属污染: 浸提剂的选择及其重金属形态的关系[J]. 北京大学学报(自然科学版), 2015, 51(1): 109-115.Yue C, Wang Q H, Yuan L, et al. Assessment of heavy metal contaminated soils from the lead-zinc mine by toxicity characteristic leaching procedure[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2015, 51(1): 109-115.
[15] Guerra F, Trevizam A R, Fior R C, et al. Cadmium phytoavailability in soils and evaluation of extractant effectiveness using an isotope technique[J]. Scientia Agricola, 2014, 71(5): 345.
[16] 蔡文涛, 李贺祎, 来利明, 等. 鄂尔多斯高原弃耕农田恢复过程中土壤物理性质和生物结皮的变化[J]. 应用生态学报,2017, 28(3): 829-837.Cai W T, Li H Y, Lai L M, et al. Dynamics of soil physical properties and biological soil crust during the vegetation restoration process of abandoned croplands in the Ordos Plateau,China[J]. Chinese Journal of Applied Ecology, 2017, 28(3): 829-837.
[17] 鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000.Bao S D. Agricultural Chemistry Analysis[M]. Beijing: China Agriculture Press, 2000.
[18] 顾国平, 章明奎. 蔬菜地土壤有效态重金属提取方法的比较[J].生态与农村环境学报, 2006, 22(4): 67-70.Gu G P, Zhang M K. Methods for extraction of available heavy metals in soils of vegetable fields[J]. Journal of Ecology and Rural Environment, 2006, 22(4): 67-70.
[19] Feng M H, Shan X Q, Zhang S Z, et al. A comparison of the rhizosphere-based method with DTPA, EDTA, CaCl2, and NaNO3extraction methods for prediction of bioavailability of metals in soil to barley[J]. Environmental Pollution, 2005, 137(2): 231-240.
[20] 颜世红, 吴春发, 胡友彪, 等. 典型土壤中有效态镉CaCl2提取条件优化研究[J]. 中国农学通报, 2013, 29(9): 99-104.Yan S H, Wu C F, Hu Y B, et al. Optimization of CaCl2extraction of available cadmium in typical soils[J], Chinese Agricultural Science Bulletin, 2013, 29(9): 99-104.
[21] Gleyzes C, Tellier S, Astruc M. Fractionation studies of trace elements in contaminated soils and sediments: A review of sequential extraction procedures[J]. Trends in Analytical Chemistry, 2002, 21(6): 451-467.
[22] Feng M H, Shan X Q, Zhang S Z, et al. Comparison of a rhizosphere-based method with other one-step extraction methods for assessing the bioavailability of soil metals to wheat[J].Chemosphere, 2005, 59(7): 939-949.
[23] Gommy C, Perdrix E, Galloo J C, et al. Metal speciation in soil: Extraction of exchangeable cations from a calcareous soil with a magnesium nitrate solution[J]. International Journal of Environmental Analytical Chemistry, 1998, 72(1): 27-45.
[24] Meers E, Du Laing G, Unamuno V, et al. Comparison of cadmium extractability from soils by commonly used single extraction protocols[J]. Geoderma, 2007, 141(3): 247-259.
[25] Gryschko R, Kuhnle R, Terytze K, et al. Soil extraction of readily soluble heavy metals and as with 1 M NH4NO3-solutionevaluation of DIN 19730[J]. Journal of Soils and Sediments, 2005,5(2): 101-106.
[26] Smilde K W, Luit B V, Driel W V. The extraction by soil and absorption by plants of applied zinc and cadmium[J]. Plant and Soil, 1992, 143(2): 233-238.
[27] Houba V J G, Lexmond T M, Novozamsky I, et al. State of the art and future developments in soil analysis for bioavailability assessment[J]. The Science of the Total Environment, 1996,178(1/2/3): 21-28.
[28] Meers E, Samson R, Tack F M G, et al. Phytoavailability assessment of heavy metals in soils by single extractions and accumulation by phaseolus vulgaris[J]. Environmental and Experimental Botany, 2007, 60(3): 385-396.
[29] 章明奎, 方利平, 周翠. 污染土壤重金属的生物有效性和移动性评价: 四种方法比较[J]. 应用生态学报, 2006, 17(8): 1501-1504.Zhang M K, Fang L P, Zhou C. Evaluation of heavy metals bioavailability and mobility in polluted soils: A comparison of four methods[J]. Chinese Journal of Applied Ecology, 2006, 17(8):1501-1504.
[30] 刘玉荣, 党志, 尚爱安, 等. 几种萃取剂对土壤中重金属生物有效部分的萃取效果[J]. 土壤与环境, 2002, 11(3): 245-247.Liu Y R, Dang Z, Shang A A, et al. Comparison several extractants for extracting bioavailable part of heavy metals in soils[J]. Soil and Environmental Sciences, 2002, 11(3): 245-247.
[31] Herath H M D A K, Bandara D C, Weerasinghe P A, et al. Effect of cadmium on growth parameters and plant accumulation in different rice (Oryzasativa L.) varieties in Sri Lanka[J]. Tropical Agricultural Research, 2015, 25(4): 432-442.
[32] Ding C F, Zhang T L, Wang X X, et al. Prediction model for cadmium transfer from soil to carrot (Daucus carota L.) and its application to derive soil thresholds for food safety[J]. Journal of Agricultural and Food Chemistry, 2013, 61(43): 10273-10282.
[33] 甘国娟, 刘妍, 朱晓龙, 等. 3种提取剂对不同类型土壤重金属的提取效果[J]. 中国农学通报, 2013, 29(2): 148-153.Gan G J, Liu Y, Zhu X L, et al. The extraction efficiency of three extracting agents for heavy metals in different types of soil[J].Chinese Agricultural Science Bulletin, 2013, 29(2): 148-153.
[34] Rizwan M, Ali S, Adrees M, et al. Cadmium stress in rice: toxic effects, tolerance mechanisms, and management: A critical review[J]. Environmental Sciences and Pollution Research, 2016,23(18): 1-21.
