小麦秸秆生物质炭添加对第四纪红壤CO2和N2O排放的影响
2018-01-23刘杰云邱虎森王聪汤宏沈健林付金沐吴金水
刘杰云,邱虎森,王聪,汤宏,,沈健林*,付金沐,吴金水
(1. 宿州学院环境与测绘工程学院,安徽 宿州 234000;2. 中国科学院亚热带农业生态研究所亚热带农业生态过程重点实验室,湖南 长沙 410125;3. 凯里学院环境与生命科学学院,贵州 凯里 556011)
生物质炭是指生物质在部分或者完全缺氧的条件下经热解炭化产生的一类难溶性芳香族化合物[1-2]。研究发现,生物质炭具有发达的孔隙结构、巨大的比表面积、高度的稳定性、较强的吸附性、碱性等性质,因此,可在增加土壤有机碳储量、提高作物产量、改善土壤理化性状、增加土壤肥力等方面发挥重要的作用[3]。生物质炭稳定性较强,可长期储存于土壤中,并通过在土壤有机碳库中的缓慢循环,在减缓全球碳循环及气候变化中发挥重要作用[4-5]。此外,生物质炭添加到土壤后,能明显改变土壤的理化性状及微生物学性质,进而影响温室气体(GHG)的排放[4]。因此,随着研究的深入,生物质炭在农田温室气体减排中的研究受到了土壤学家、环境学家等的广泛关注。
目前,已有大量有关生物质炭对农田温室气体排放影响的研究,但研究结果却不甚相同[4,6]。如在亚热带典型的双季稻田(麻沙泥水稻土)中添加小麦秸秆生物质炭(24和48 t/hm2),由于土壤pH的增加,与对照相比,生物质炭添加当年,稻田CH4排放降低了约40%,但增加了土壤异养呼吸和N2O排放[7]。而刘玉学等[8]在浙江省海宁市水稻田(黄松田水稻土)中添加水稻秸秆生物质炭和生活垃圾生物质炭(3.75 t/hm2),结果发现,两种生物质炭对土壤CO2、CH4和N2O排放均有降低作用。除水稻田外,旱作和水旱轮作生态系统也是CO2和N2O的重要排放源。Zhang 等[9]的研究表明,小麦秸秆生物质炭(20和40 t/hm2)添加到玉米地(潮土)中,N2O排放较对照降低了21%~51%,此降低作用归因于生物质炭的添加,增加了土壤孔隙结构[10],从而抑制了反硝化细菌的活性,增加了N2O还原酶的活性。李露等[11]对江苏省南京市由第四纪黄土母质发育的黄棕壤水旱轮作体系中添加小麦秸秆生物质炭,20 t/hm2的施用量对稻季和麦季的GHG排放均未产生显著影响,但施用40 t/hm2的生物质炭时降低了稻季8.6%的CH4排放,麦季20.9%和11.3%的N2O和CH4排放。生物质炭对GHG的不同影响可能与土壤性质、生物质炭性质等有关[12]。
目前,国内有关生物质炭添加对农田温室气体排放影响的研究大多集中在南方稻田土壤和北方的旱地土壤上,对南方红壤旱地土壤的研究却相对较少。为此,本研究选取我国南方地区比较典型的第四纪红色粘土母质发育的红壤为供试土壤,以小麦秸秆生物质炭为供试材料进行培养,通过测定培养期间CO2和N2O的排放量及土壤理化性质,分析其变化动态,拟探明生物质炭添加对土壤温室气体排放的影响及其影响因素,为红壤旱地温室气体减排提供科学依据。
1 材料与方法
1.1 供试土壤与生物质炭
供试土壤为第四纪红色粘土母质发育的旱地红壤,取自中国科学院桃源农业生态研究试验站(111°27′E,28°55′N),主要农作物为玉米。土壤样品采用多点采样的方法,将土壤表层的枯枝落叶清除,用铁锹取耕层(0~15 cm)土壤。将土壤风干,捡出可见石头、动植物残体等,过2 mm筛,混合均匀。培养前,将土壤湿度调至40%的田间持水量(40%WHC,此土壤湿度为生物最适宜生长水分条件),在25 ℃条件下预培养一周。
生物质炭选用由小麦秸秆制成的生物质炭,产自河南三利新能源有限公司,其热解温度约为500 ℃。培养前将其粉碎,过2 mm筛。供试土壤和生物质炭的基本性质见表1。
1.2 试验设计与方法
根据生物质炭不同施用量,设5个处理:1)空白对照(CK),不添加生物质炭;2)添加土重0.5%(w/w,下同)的生物质炭(BC0.5);3)添加1%的生物质炭(BC1);4)添加2%的生物质炭(BC2);5)添加2.5%的生物质炭(BC2.5)。这些添加量在田间条件下分别相当于0、12、24、48和60 t/hm2。每个处理24个重复,其中4个重复用于气样采样,其余20个重复用于培养后2、5、10、30和60 d破坏性采集土壤样品(每次4个重复)。
取200 g土(烘干基),根据不同处理生物质炭添加量,分别加入土壤中,充分混匀,置于1 L的培养瓶中,塞上橡胶塞,保持密闭状态,于25 ℃条件下培养,共培养60 d。采气和采土分开进行,采气装置另设4个空瓶,每次采样都与气体采集同步进行,以扣除大气背景值。采气培养瓶橡胶塞打孔,放入三通阀并用胶水进行密封,用橡胶管连接三通阀,用于连接注射器采气。培养装置整个培养过程中用称重法来补充水分,保持土壤含水量不变(40%WHC)。
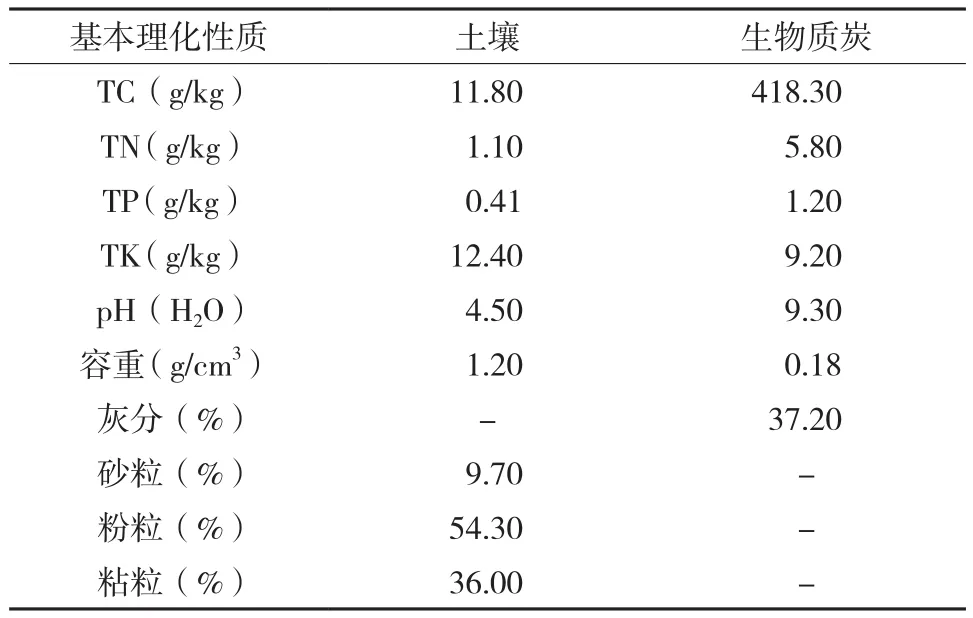
表1 供试土壤和生物质炭的基本理化性质Table 1 The basic properties of soil and biochar for the incubation experiment
1.3 样品采集与测定方法
气体采集与测定:在培养的第1、2、3、4、5、7和10 d采样,之后每隔5 d采一次气样。采样时,用30 mL的注射器从密闭的培养瓶中抽出30 mL 气体,注入12 mL的真空瓶中。每次采完样品后,敞口半小时,使瓶内空气与外界充分交换。气体用气相色谱仪(Agilent 7890A,Agilent Technologies,美国)测定。
土壤样品采集与测定:在培养的第2、5、10、30和60 d分别进行破坏性采集土壤样品。采集样品放入4 ℃冰箱内,并在一周之内完成分析测试。取80 mL 0.5 M K2SO4加到30 g土中,震荡1 h后过滤。滤液用连续流动测定仪(Tecator FIA Star 5000 Analyzer,Foss Tecator,瑞典)测定土壤中的铵态氮(NH4+-N)和硝态氮(NO3--N)含量;取滤液用TOC仪(TOC-VWP,Shimadzu Corporation,日本)测定土壤中的可溶性有机碳(DOC)的含量。土壤pH值采用蒸馏水(土水比1∶2.5)浸提30 min,用Mettler-toledo320 pH 计(中国)测定。土壤含水量采用铝盒法测定。
1.4 数据计算与统计分析
气体排放通量计算方法为:
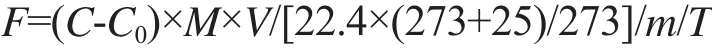
式中:F为CO2或N2O的排放通量(mg/(kg.d)或μg/(kg.d));C为气相色谱仪测得的浓度值(mg/kg或μg/kg);C0为空白瓶测得的浓度值(mg/kg或μg/kg);M为CO2或N2O的分子质量(g/mol);V为培养瓶中气体体积(L);22.4×(273+25)/273为25 ℃条件下的摩尔体积(L/mol);m为烘干土重(g);T为采样时间间隔(d)。
培养期间气体的累积排放量计算方法为:
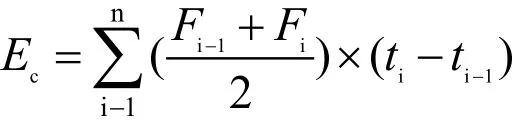
式中:Ec为CO2或N2O的累积排放量(mg/kg或μg/kg);F为CO2或N2O的排放通量;ti为第i次采样时间。
数据统计分析采用SPSS20(SPSS Inc. Chicago,IL)进行单因素方差分析和相关性分析,统计显著水平为P<0.05或P<0.01。
2 结果与分析
2.1 培养试验下土壤氮素形态、DOC含量及pH的动态变化
生物质炭添加降低了土壤NH4+-N和NO3--N含量(图1)。在培养初期(前10 d),与CK处理相比,小麦秸秆生物质炭的添加增加了土壤NH4+-N含量,且随着生物质炭添加量的增加而增加,之后,生物质炭处理的NH4+-N含量缓慢降低,并保持相对稳定,而CK处理则逐渐增加,30 d时,CK处理的NH4+-N含量为23.3 mg/kg,开始高于生物质炭处理,至培养结束时,已明显高于生物质炭处理。培养期的前30 d,各处理的土壤NO3--N 含量较低,之后增加,培养结束时为最高。与CK处理相比,生物质炭添加降低了土壤NO3--N 浓度(60 d时的BC0.5和BC1处理除外)。
生物质炭添加降低了土壤DOC含量,但增加了土壤pH值(图1)。DOC含量在培养初期最高,随后逐渐降低,但30 d时又出现峰值,之后持续降低。与CK处理相比,生物质炭添加降低了土壤DOC含量,且随着生物质炭添加量的增加而降低。生物质炭添加增加了土壤pH,且随着生物质炭添加量的增加而增加,在整个培养期间,CK处理的pH变化不大,而培养10 d 之后,生物质炭处理逐渐降低,但仍高于CK处理。
2.2 生物质炭对CO2和N2O排放的影响
与CK处理相比,生物质炭处理的CO2排放先增后减。培养的前一周,尤其是前2 d,CO2排放通量最高,且BC0.5、BC1、BC2和BC2.5处理的CO2排放通量分别比CK处理高52%、97%、100%和155%(图2)。之后,逐渐降低,且生物质炭处理较CK处理降幅更大,15 d时,部分生物质炭处理开始低于CK处理,30 d时,所有的生物质炭处理均低于CK处理,但各生物质炭处理之间仍呈现出随着添加量的增加而增加的趋势。
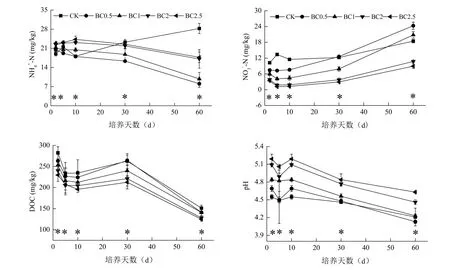
图1 培养期间各处理土壤、、DOC含量和pH的动态变化Fig. 1 Dynamics of soil N,, DOC contents and pH during the 60 d incubation
CK、BC0.5、BC1、BC2和BC2.5处理的CO2累积排放量分别为426、399、427、443和505.1 mg/kg(图3)。与CK处理相比,BC2和 BC2.5处理的 CO2累积排放量分别增加了4%和18%(P<0.05),而 BC0.5处理却显著降低 6%(P<0.05)。BC1和CK处理之间无显著差异。只考虑培养期的后45 d(图4),各生物质炭处理CO2累积排放量均显著低于CK处理(P<0.05),而BC2.5处理又显著高于BC0.5、BC1和BC2处理(P<0.05)。但BC0.5、BC1和BC2处理之间无显著差异。
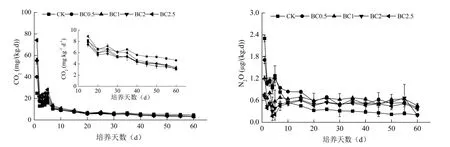
图2 培养期间各处理土壤CO2和N2O排放通量的动态变化Fig. 2 Dynamics of soil CO2 and N2O fluxes during the 60 d incubation
生物质炭处理较CK处理在初期降低、后期增加了N2O排放(图2)。N2O的排放高峰出现在培养期的前2 d,但生物质炭处理的N2O排放通量低于CK处理,且随着生物质炭添加量的增加而降低。之后,各处理的N2O排放通量逐渐降低,而生物质炭处理在第5 d之后又有所回升。至10 d时,各生物质炭处理的N2O排放通量均高于CK处理,之后一直保持相对稳定的状态,而CK处理仍在缓慢降低,40 d后基本保持稳定。
各处理培养期间N2O累积排放量分别为24.8、39.3、37.4、30.1 和 29.0 μg/kg(图 3),生物质炭添加显著增加了N2O的排放(P<0.05),但随着生物质炭添加量的增加而降低。其中,除BC0.5与BC1处理之间及BC2和BC2.5处理之间差异不显著(P>0.05),其他各处理之间均表现出显著的差异性(P<0.05)。
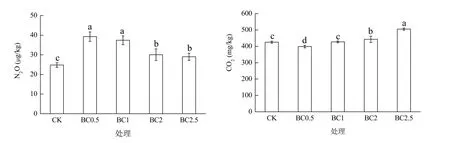
图3 培养期间各处理土壤CO2、N2O的累积排放量Fig. 3 Cumulative emissions of soil CO2 and N2O during the 60 d incubation
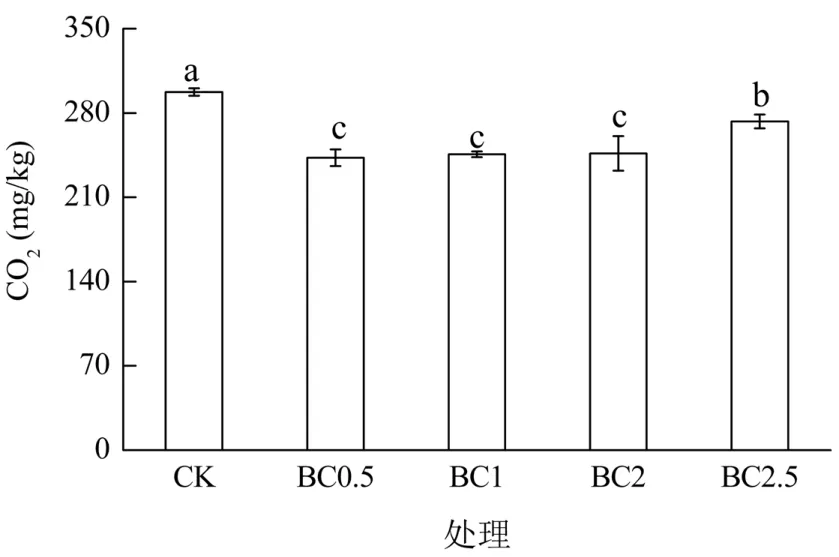
图4 培养15~60 d各处理土壤CO2的累积排放量Fig. 4 Cumulative emissions of soil CO2 during 15-60 d of the incubation
2.3 CO2和N2O排放与土壤因子及生物质炭添加量之间的关系分析
不同培养时期,各土壤因子与CO2和N2O排放通量的相关性有较大差异(表2)。在培养的前10 d,CO2排放通量与土壤NH4+-N和pH均呈极显著的正相关关系(P<0.01),与土壤NO3--N和DOC呈极显著的负相关(P<0.01)。培养10~60 d,CO2排放通量仅与土壤NH4+-N表现出极显著的正相关(P<0.01)。在培养 0~10 d,N2O 排放通量与土壤NH4+-N和pH呈极显著负相关(P<0.01),与土壤和DOC呈极显著的正相关(P<0.01)。培养10~60 d,N2O排放通量仅与土壤表现出极显著的负相关(P<0.01)。
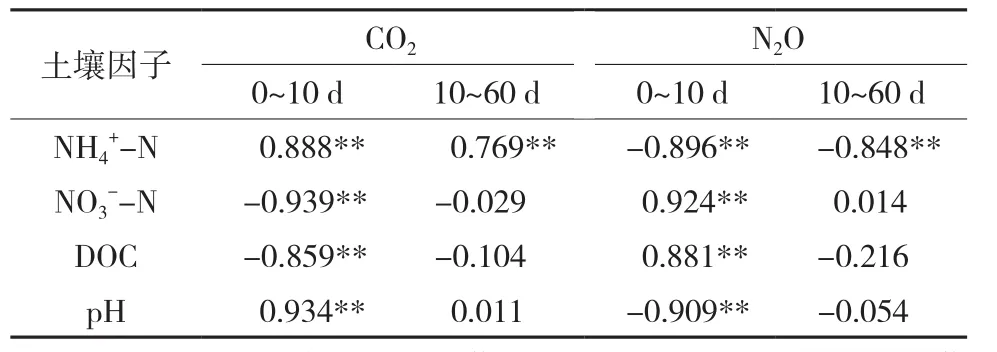
表2 土壤CO2和N2O排放通量与土壤因子之间的相关性分析(n=20)Table 2 The correlations of soil CO2 and N2O fluxes and soil properties in two incubation periods (n=20)
生物质炭处理的CO2和N2O累积排放量与添加量均呈线性相关(图5)。除去CK处理,CO2累积排放量(y)随生物质炭添加量(x,x>0)的增加而增加,二者之间呈较好的线性关系,满足方程:y=47.72x+374.8(R2=0.81,P<0.01,n=16)。生物质炭添加增加了土壤N2O的累积排放量,但随着添加量的增加而降低,因此,除去CK处理,N2O的累积排放量(y)与生物质炭添加量(x,x>0)之间呈较好的线性关系,满足方程:y=-5.572x+42.29(R2=0.7849,P<0.01,n=16)。
3 讨论
3.1 生物质炭添加对红壤CO2排放的促进作用
目前,已有不少的研究表明,生物质炭添加可影响土壤CO2的排放[13-14]。在本研究中,小麦秸秆生物质炭添加促进了土壤CO2排放,且随着生物质炭添加量的增加,促进作用越明显。但该促进作用主要表现在培养初期,这与Jones等[15]和Luo等[16]的研究结果一致。这可能是由于生物质炭本身含有的可溶性有机碳分解造成的。生物质炭添加到土壤中,CO2的排放来源主要有两个部分,一部分来自土壤原有机质的分解,另一部分则来自生物质炭本身的分解。虽然,生物质炭具有吸附性,可吸附土壤DOC,降低了土壤DOC含量,但生物质炭本身含有部分可溶性有机碳,添加到土壤后会迅速被土壤微生物分解[15],且这些可溶性有机碳分解很快,一般在培养的1~2 d内被大部分分解[15]。此外,增加的CO2排放可能部分来源于生物质炭本身无机碳的释放。生物质炭具有较强的碱性(本研究生物质炭pH=9.3),当添加到土壤后,增加土壤pH的同时,会迅速吸附土壤中的酸性物质[15]。本研究的土壤为强酸性(pH=4.5),生物质炭施入后,吸附土壤中的酸性物质,而将其表面的无机碳中和,释放出CO2。因此在本研究小麦秸秆生物质炭添加初期,CO2排放的增加可能主要来源于生物质炭本身可溶性有机碳的分解和无机碳的释放。

图5 土壤CO2和N2O累积排放量与生物质炭添加量之间的关系Fig. 5 Correlations of soil CO2 and N2O cumulativeemissions and biochar application rates
培养10 d 之后,可能由于生物质炭的吸附作用,降低了土壤CO2排放。生物质炭具有较强的吸附作用,可吸附土壤中的有机质及生物质炭添加后本身释放的有机碳,隔绝了土壤C与微生物的接触,从而降低CO2的排放[17-18]。但随着生物质炭添加量的增加,CO2排放也逐渐增加。这可能是由于随着生物质炭添加量的增加,其本身的有机碳投入也随之增加,因此,高添加量的生物质炭处理本身含有的可溶性有机碳可能在初期并没有完全分解,在培养后期,仍会有部分本身有机碳的分解,故而在本研究中,CO2的排放量表现出随着生物质炭添加量的增加而增加。但有关此方面的研究还较少,有待于进一步的研究证明。
3.2 生物质炭添加对红壤N2O排放的影响因素
国内外的研究已表明生物质炭添加对土壤N2O排放的影响可能是促进,也可能是降低,并不一致[1,10]。在本研究中,生物质炭添加促进了土壤N2O的排放,这与Mukherjee等[19]的研究不同。生物质炭的C/N是影响N2O排放的一个重要因子[20],高C/N的生物质炭(C/N>140)添加可降低土壤N2O排放,而低C/N的生物质炭(C/N<100)由于本身含有的N释放进入土壤,则可增加N2O排放[21]。本研究的生物质炭C/N较低(小于80),N含量较高(TN含量为5.8 g/kg),尤其是无机氮(NH4+-N含量为109.9 mg/kg,NO3--N含量为3.6 mg/kg),可为土壤硝化和反硝化作用提供底物,故促进了土壤N2O排放。此外,有研究表明,具有较高灰分含量的生物质炭可促进土壤N2O的排放[19],而本研究的生物质炭灰分含量高达37.2%,因此促进了N2O排放。
培养初期,对照处理的N2O排放较高(高于生物质炭处理),可能是在培养初期,土壤中有机质和含N化合物含量较高,为土壤的硝化和反硝化作用提供了良好的环境[22],因此N2O排放也较高。而生物质炭处理中,由于其吸附性,可能吸附了土壤中的有机质和含N化合物[23],则参与硝化和反硝化作用的底物减少。在培养前10 d,土壤N2O排放与土壤NH4+-N呈显著负相关,与NO3--N呈显著正相关。由于生物质炭本身含有部分NH4+-N,添加后增加了土壤NH4+-N浓度,但降低了土壤NO3--N含量,可能是由于生物质炭的吸附作用,使得土壤中微生物所需底物减少,则土壤硝化作用和反硝化作用均降低。因此,在培养初期,生物质炭处理的N2O排放低于对照处理,且随着生物质炭添加量的增加,吸附作用越强,则N2O排放的降低作用也越明显。此外,生物质炭添加增加了土壤pH,土壤pH的增加,可增加土壤氧化亚氮还原酶的活性[4],从而促进反硝化过程中N2O向N2的转化[7],故土壤pH增加也可能是生物质炭降低N2O排放的一个原因。
培养10 d之后,可能由于有机质的消耗,对照处理的N2O排放逐渐降低,而生物质炭处理却变化较小。因为生物质炭吸附的C、N化合物可以被不断的释放,供微生物利用,为N2O排放的生物过程提供能量和底物。因此,在培养后期,与对照相比,生物质炭处理促进了N2O排放。此外,生物质炭可通过改善土壤通气性而影响N2O的排放[11]。Bateman和Baggs[24]的研究发现当土壤孔隙含水量(WFPS)在35%~60%时,N2O的产生主要来自于硝化作用,当WFPS高于70%时,N2O的产生主要来自于反硝化作用。本研究中的土壤含水量控制在40%WHC左右,因此N2O的排放主要来源于硝化作用。生物质炭本身具有发达的孔隙结构,施入旱地土壤中,可增加土壤的通气性,有利于土壤硝化作用的进行。培养后期生物质炭处理NH4+-N浓度低于对照,可能是硝化作用消耗了土壤中的NH4+-N(包括土壤原NH4+-N和生物质炭本身含有的NH4+-N),因而可增加N2O的排放。在整个培养期间,N2O排放随着生物质炭添加量的增加而降低,二者呈现较好的线性负相关关系,这可能是由于初期生物质炭添加量越大,其吸附作用越强,故而高生物质炭添加的N2O减排效果优于低生物质炭添加量所致。
4 结论
研究表明,与对照相比,生物质炭增加了第四纪红壤pH值,但降低了NH4+-N、NO3--N 和DOC含量。经过60 d培养,各处理的土壤CO2累积排放量为425~505 mg/kg。生物质炭呈碱性,且本身含有部分可溶性碳,施入土壤后,此部分有机碳及无机碳迅速被分解和释放,因此与对照相比,生物质炭添加促进了土壤CO2排放(0.5%生物质炭处理显著降低土壤CO2排放),但这种促进作用主要表现在培养的前15 d。同时,由于生物质炭孔隙结构发达,可增加土壤孔隙度,因而促进了土壤硝化作用,导致NH4+-N向N2O转化增加,与对照相比,生物质炭促进了土壤N2O排放16.9%~58.5%。鉴于生物质炭施用到土壤后其本身降解缓慢,有关其施用后对土壤温室气体排放的长期影响还有待进一步研究。
[1] Liu J Y, Shen J L, Li Y, et al. Effects of biochar amendment on the net greenhouse gas emission and greenhouse gas intensity in a Chinese double rice cropping system[J]. European Journal of Soil Biology, 2014, 65: 30-39.
[2] 刘杰云, 沈健林, 邱虎森, 等. 生物质炭添加对农田温室气体净排放的影响综述[J]. 农业环境科学学报, 2015, 34(2): 205-212.Liu J Y, Shen J L, Qiu H S, et al. Effects of biochar amendments on net emissions of greenhouse gases from croplands: A review[J].Journal of Agro-Environment Science, 2015, 34(2): 205-212.
[3] 陈温福, 张伟明, 孟军. 生物炭与农业环境研究回顾与展望[J].农业环境科学学报, 2014, 33(5): 821-828.Chen W F, Zhang W M, Meng J. Biochar and agro-ecological environment: review and prospect[J]. Journal of Agro-Environment Science, 2014, 33(5): 821-828.
[4] Zwieten V L, Singh B, Joseph S, et al. Biochar reduces emissions of non-CO2GHG from soil[A]//Lehmann J, Joseph S. Biochar for Environmental Management[M]. London: Earthscan Publications.2009: 227-249.
[5] 潘根兴, 李恋卿, 刘晓雨, 等. 热裂解生物质炭产业化:秸秆焚烧与绿色农业新途径[J]. 科技导报, 2015, 33(13): 92-101.Pan G X, Li L Q, Liu X Y, et al. Industrialization of biochar from biomass pyrolysis: A new option for straw burning ban and green agriculture of China[J]. Science and Technology Review, 2015,33(13): 92-101.
[6] 邱虎森, 王翠红, 盛浩. 生物质炭对土壤温室气体排放影响机制探讨[J]. 湖南农业科学, 2012(11): 49-52.Qiu H S, Wang C H, Sheng H. Influencing mechanisms of biochar on emissions of greenhouse gas from soils[J]. Hunan Agricultural Sciences, 2012(11): 49-52.
[7] Shen J L, Tong H, Liu J Y, et al. Contrasting effects of straw and straw-derived biochar amendments on greenhouse gas emissions within double rice cropping systems[J]. Agriculture, Ecosystems and Environment, 2014, 188: 264-274.
[8] 刘玉学, 王耀锋, 吕豪豪, 等. 生物质炭化还田对稻田温室气体排放及土壤理化性质的影响[J]. 应用生态学报, 2013, 24(8):2166-2172.Liu Y X, Wang Y F, Lü H H, et al. Effects of biochar application on greenhouse gas emission from paddy soil and its physical and chemical properties[J]. Chinese Journal of Applied Ecology, 2013,24(8): 2166-2172.
[9] Zhang A F, Cui L Q, Pan G X, et al. Effect of biochar amendment on yield and methane and nitrous oxide emissions from a rice paddy from Tai Lake plain, China[J]. Agriculture, Ecosystems and Environment, 2010, 139: 469-475.
[10] Yanai Y, Toyota K, Okazaki M. Effects of charcoal addition on N2O emissions from soil resulting from rewetting air-dried soil in short-term laboratory experiments[J]. Soil Science and Plant Nutrition, 2007, 53: 181-188.
[11] 李露, 周自强, 潘晓健, 等. 不同时期施用生物质炭对稻田N2O和CH4排放的影响[J]. 土壤学报, 2015, 52(4): 839-848.Li L, Zhou Z Q, Pan X J, et al. Effects of biochar on N2O and CH4emissions from paddy field under rice-wheat rotation during rice and wheat growing seasons relative to timing of amendment[J].Acta Pedologica Sinica, 2015, 52(4): 839-848.
[12] He Y H, Zhou X H, Jiang L L, et al. Effects of biochar application on soil greenhouse gas fluxes: A meta-analysis[J]. Global Change Biology Bioenergy, 2017, 9: 743-755.
[13] Lu W W, Ding W X, Zhang J H, et al. Biochar suppressed the decomposition of organic carbon in a cultivated sandy loam soil:A negative priming effect[J]. Soil Biology & Biochemistry, 2014,76: 12-21.
[14] Malghani S, Gleixner G, Trumbore S E. Chars produced by slow pyrolysis and hydrothermal carbonization vary in carbon sequestration potential and greenhouse gases emissions[J]. Soil Biology & Biochemistry, 2013, 62: 137-146.
[15] Jones D L, Murphy D V, Khalid M, et al. Short-term biocharinduced increase in soil CO2release is both biotically and abiotically mediated[J]. Soil Biology & Biochemistry, 2011, 43:1723-1731.
[16] Luo Y, Durenkamp M, De Nobili M, et al. Short term soil priming effects and the mineralisation of biochar following its incorporation to soils of different pH[J]. Soil Biology &Biochemistry, 2011, 43: 2304-2314.
[17] 章明奎, Walelign D Bayou, 唐红娟. 生物质炭对土壤有机质活性的影响[J]. 水土保持学报, 2012, 26(2): 127-131, 137.Zhang M K, Bayou W D, Tang H J. Effects of biochar’s application on active organic carbon fractions in soil[J]. Journal of Soil and Water Conservation, 2012, 26(2): 127-131, 137.
[18] 徐云蕾, 卢凌霄, 曾馥平, 等. 喀斯特峰丛洼地不同森林土壤微生物量碳在团聚体中的分布[J]. 农业现代化研究, 2012,33(5): 636-640.Xu Y L, Lu L X, Zeng F P, et al. Carbon distribution of microbial biomass of soil aggregation under different forest types in depressions between karst hills[J]. Research of Agricultural Modernization, 2012, 33(5): 636-640.
[19] Mukherjee A, Lal R, Zimmerman A R. Effects of biochar and other amendments on the physical properties and greenhouse gas emissions of an arti fi cially degraded soil[J]. Science of the Total Environment, 2014, 487: 26-36.
[20] Brassard P, Godbout S, Raghavan V. Soil biochar amendment as a climate change mitigation tool: Key parameters and mechanisms involved[J]. Journal of Environmental Management, 2016, 181:484-497.
[21] Cayuela M L, Zwienten L V, Singh B P, et al. Biochar’s role in mitigating soil nitrous oxide emissions: A review and metaanalysis[J]. Agriculture, Ecosystems and Environment, 2014, 191:5-16.
[22] 李卉, 李宝珍, 邹冬升, 等. 水稻秸秆不同处理方式对亚热带农田土壤微生物生物量碳、氮及氮素矿化的影响[J]. 农业现代化研究, 2015, 36(2): 303-308.Li H, Li B Z, Zou D S, et al. Impacts of rice straw and its biochar product on the amounts of soil microbial biomass carbon and nitrogen and the mineralization of soil organic nitrogen in subtropical croplands[J]. Research of Agricultural Modernization,2015, 36(2): 303-308.
[23] 肖和友, 黎蕾, 陈香碧, 等. 广西蔗渣炭和玉米秸秆炭对水体中铵氮的吸附性能与比较[J]. 农业现代化研究, 2016, 37(2):381-386.Xiao H Y, Li L, Chen X B, et al. Characteristics of the ammonium nitrogen adsorbed by biochars: Bagasse and maize straw[J].Research of Agricultural Modernization, 2016, 37(2): 381-386.
[24] Bateman E J, Baggs E M. Contributions of nitrification and denitrification to N2O emissions from soils at different water-filled pore space[J]. Biology and Fertility of Soils, 2005, 41: 379-388.
