酯化法合成丙酸甲酯的动力学研究
2018-01-22李柏春张静雅王凤竹张文林李春利
李柏春 ,张静雅 ,王凤竹 ,张文林 ,李春利
丙酸甲酯是一种高品位溶剂和防腐添加剂,可用于生产食品和化妆品,并可作为有机合成工业基本原料,还可通过酯交换法合成丙酸乙酯、丙酸苯甲酸酯等用于制酒工业和香精工业的生产[1-3]。目前丙酸甲酯的工业生产主要以浓硫酸为催化剂,强酸作催化剂可催化合成丙酸甲酯,但浓硫酸的氧化性和脱水性易导致副产物产生,腐蚀设备,后续处理工作困难[4]。针对合成丙酸甲酯,国内外学者开发了一系列新型催化剂,包括无机酸[5]、对甲苯磺酸[6]、离子液体[7-8]和贵金属[9],但上述催化剂在催化性能、热稳定性和制备工艺方面均有不足。阳离子交换树脂具有稳定性好、高效、环境友好的特点[10-11]。
本工作以阳离子交换树脂为催化剂,以丙酸和甲醇为原料在间歇搅拌釜中酯化合成丙酸甲酯。研究了催化剂种类、搅拌转速、催化剂用量、反应温度、酸醇摩尔比对合成丙酸甲酯反应的影响,确定了较适宜的反应条件,并在此条件下,测得333.15~348.15 K范围内的反应动力学数据,得到动力学方程,为直接酯化生产丙酸甲酯提供了基础研究数据。
1 实验部分
1.1 试剂
丙酸:分析纯,风船化学试剂科技有限公司;甲醇、丙酸甲酯:分析纯,福晨化学试剂厂;N,N-二甲基甲酰胺(DMF):分析纯,光复精细化工研究所;阳离子交换树脂(6100、6101、SST104H、C100FLH、C100EFLH、NKC-9):南开大学树脂厂。
1.2 实验方法
酯化反应动力学实验在间歇搅拌釜中进行:在装有温度计的四口烧瓶中放入催化剂和甲醇,将烧瓶和冷凝管连接并密封。在锥形瓶中放入丙酸并密封。打开冷凝水,设定水浴锅温度。预热烧瓶和锥形瓶中的药品,当水浴锅温度达到设定温度后,稳定一段时间使药品达到指定温度。开启搅拌,将锥形瓶中的丙酸倒入四口烧瓶中反应并开始计时,控制温度恒温(温度波动±0.1 ℃)。根据分析结果调整取样间隔,取样分析,待相邻两次试样的组分浓度变化趋于稳定时,认为反应达到平衡,停止实验。
1.3 分析方法
采用北京分析仪器厂SP-3420A型气相色谱仪,FID检测,KB-5型毛细柱,C-2000型色谱工作站,分析条件如下:柱温80 ℃、进样温度160 ℃、检测器温度170 ℃,每个试样进行多次进样检测,进样量0.3 μL,选择结果相近的3次数值的平均值作为实验值。
定量方法:内标法(以DMF为内标物),分别配制10组不同质量浓度梯度的甲醇、丙酸甲酯、丙酸与DMF的混合标样,对标样进行色谱分析并记录,分别计算甲醇、丙酸、丙酸甲酯与DMF的峰面积比值,见式(1)。

式中,A为峰面积,A1,A2,A3,As分别为甲醇、丙酸、丙酸甲酯、DMF对应的峰面积;m为质量,g,m1,m2,m3,ms分别为甲醇、丙酸、丙酸甲酯、DMF的质量。
由式(1)经线性拟合得3组标准曲线方程。甲醇与DMF、丙酸与DMF、丙酸甲酯与DMF的标准曲线方程分别见式(2)~(4),由分析结果结合式(1)~(4)可准确计算每次取样各组分的含量。

2 结果与讨论
2.1 适宜操作条件的选择
2.1.1 催化剂的选择
本工作选取了6100、6101、SST104H、C100FLH、C100EFLH、NKC-9六种阳离子交换树脂为催化剂,考察了催化剂种类对甲醇转化率的影响,结果见图1。由图1可看出,随反应时间的延长,6种强酸型阳离子交换树脂中,C100FLH的催化活性最高,甲醇转化率最高,故选用C100FLH作为后续反应的催化剂。
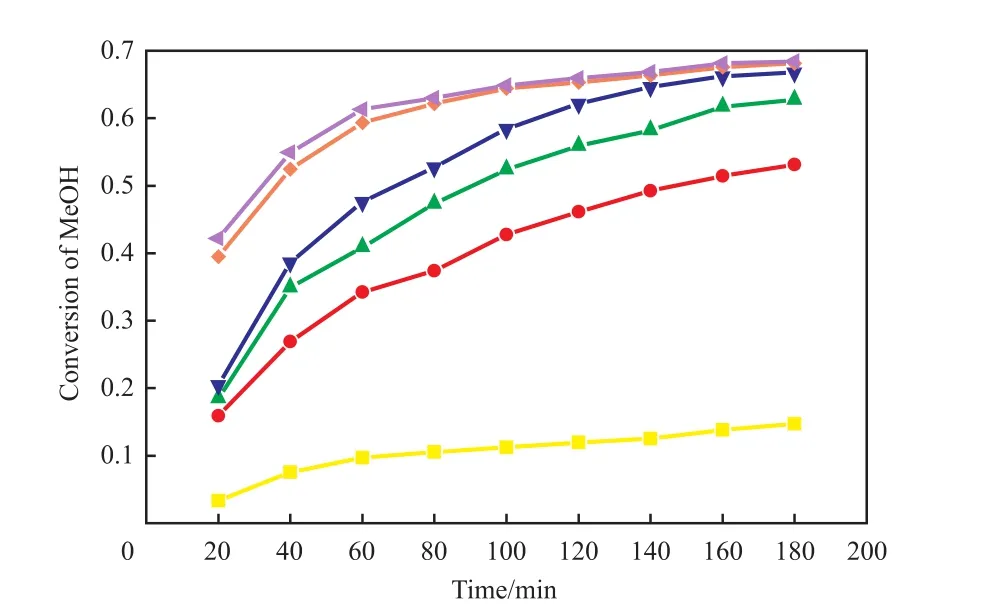
图1 催化剂种类对甲醇转化率的影响Fig.1 Effect of different catalyst on the methanol conversion.Reaction conditions:stirring speed 400 r/min,n(propionic acid)∶n(methanol)=1∶1,343.15 K,catalyst dosage 10%(w)(based on the propionic acid),3 h.Catalyst:■ SST104H;● 6101;▲ NKC-9;▼ 6100;◆ C100EFLH;◄ C100FLH
2.1.2 外扩散的消除
扩散速率会影响反应速率,可以通过改变转速以消除外扩散影响。转速对甲醇转化率的影响见图2。由图2可看出,甲醇转化率随转速的增加而增大,当转速超过200 r/min后,转速的增大并不能使甲醇转化率有效增大,证明外扩散的影响已消除,且转速过大会对催化剂造成磨损,影响使用效果和使用寿命,故转速选择200 r/min较适宜。
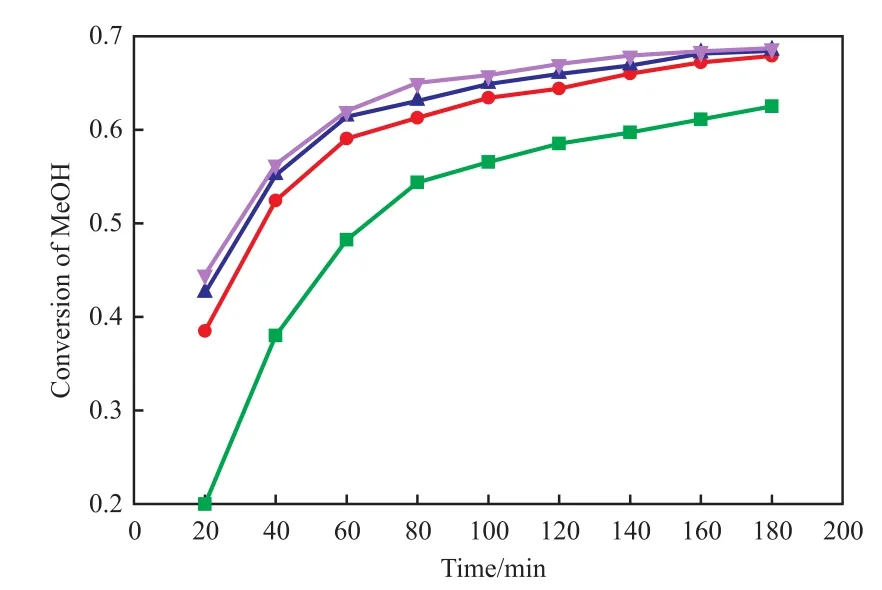
图2 转速对甲醇转化率的影响Fig.2 Effect of stirring speed on the methanol conversion.Reaction conditions:C100FLH catalyst,n(propionic acid)∶n(methanol) = 1∶1,343.15 K,catalyst dosage 10%(w),3 h.Stirring speed/(r·min-1):■ 100;● 200;▲ 300;▼ 400
2.1.3 催化剂用量对反应的影响
催化剂用量对甲醇转化率的影响见图3。由图3可看出,随催化剂用量的增加,提供的活性酸基数量也随之增加,反应速率加快,甲醇的转化率也随之增大。当催化剂用量增加至丙酸质量的10%时,继续增加催化剂用量,甲醇转化率的增幅不大,综合考虑催化效果和成本,催化剂用量为丙酸质量的10%较适宜。

图3 催化剂用量对甲醇转化率的影响Fig.3 Effect of catalyst dosage on the methanol conversion.Reaction conditions:C100FLH catalyst,stirring speed 200 r/min,n(propionic acid)∶n(methanol) = 1∶1,343.15 K,3 h.Catalyst dosage(w)/%:■ 5;● 10;▲ 15;▼ 20
2.1.4 酸醇摩尔比对反应的影响
丙酸和甲醇的摩尔比对甲醇转化率的影响见图4。由图4可知,随酸醇摩尔比的增大,甲醇的转化率增大,这是由于该反应为可逆反应,依据勒夏特列原理,增加一种反应物的浓度可提高另一种反应物的转化率。为提高甲醇的转化率,方便后续反应精馏原料与产品的分离,选择酸醇摩尔比为1.4∶1。
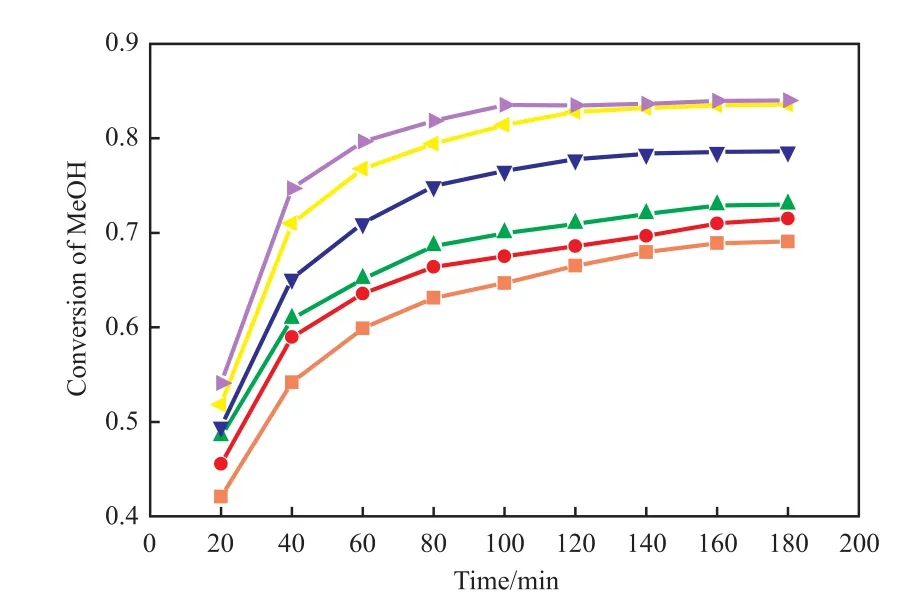
图4 酸醇摩尔比对甲醇转化率的影响Fig.4 Effect of n(propionic acid)∶n(methanol)on the methanol conversion.Reaction conditions:C100FLH catalyst,stirring speed 200 r/min,343.15 K,catalyst dosage 10%(w),3 h.n(propionic acid)∶n(methanol):■ 1∶1;● 1.1∶1;▲ 1.2∶1;▼ 1.3∶1;◄ 1.4∶1;► 1.5∶1
2.1.5 反应温度对转化率的影响
反应温度对甲醇转化率的影响如图5。由图5可看出,甲醇转化率随反应温度的升高而增大,当温度超过343.15 K以后,继续升高温度并不能使甲醇转化率大幅提高,反而增加能耗,因此反应温度为343.15 K较适宜。
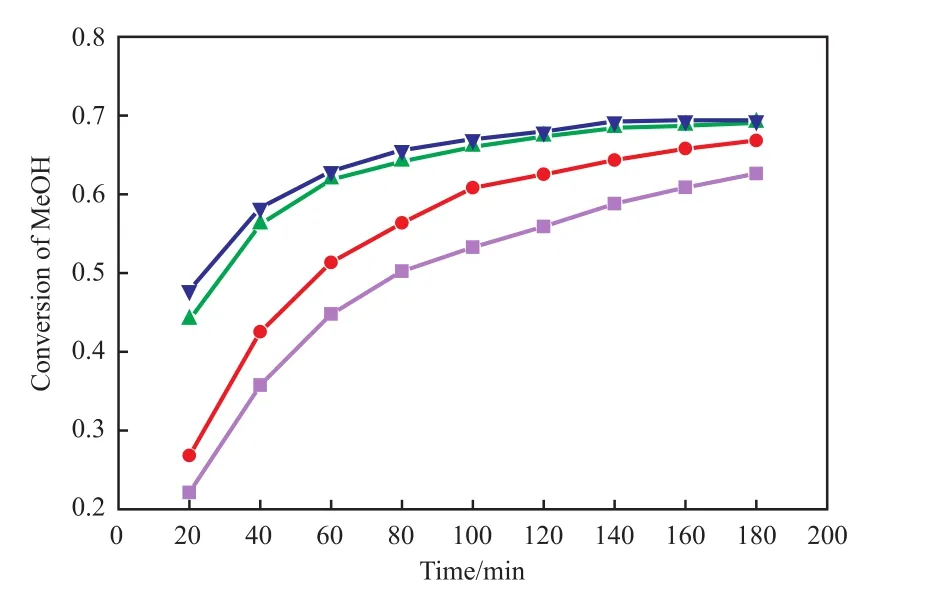
图5 反应温度对甲醇转化率的影响Fig.5 Effect of reaction temperature on the methanol conversion.Reaction conditions:C100FLH catalyst,stirring speed 200 r/min,n(propionic acid)∶n(methanol) = 1∶1,catalyst dosage 10%(w),3 h.Reaction temperature/K:■ 333.15;● 338.15;▲ 343.15;▼ 348.15
2.2 动力学模型的建立
丙酸与甲醇催化酯化生成丙酸甲酯的反应见式(5):

Erdem 等[12-14]对阳离子交换树脂催化合成丙酸酯的反应动力学进行了研究,在消除外扩散的情况下,实验数据采用拟均相模型进行拟合。Anad等[15-16]研究发现,直接酯化合成丙酸甲酯为二阶双分子可逆反应,反应速率计算见式(6):

式中,r为以甲醇消耗速率计的反应速率,mol/(L·s);k+为正反应速率常数、k-为逆反应速率常数,L/(mol·s);cA,cB分别为反应物甲醇和丙酸的瞬时浓度,mol/L;cC,cD分别为生成物丙酸甲酯和水的瞬时浓度,mol/L;cA0为甲醇的初始浓度,mol/L;x为甲醇的瞬时转化率,%。
2.3 实验数据的拟合
由于

式中,K为平衡常数;t为反应时间,min;Y为给定的k+与t的乘积。
对式(6)进行化简,得:

对式(10)进行积分,得:
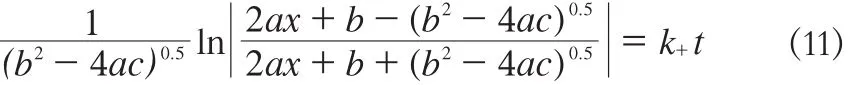
式中,a = cA0(1 - 1 /K),b = 2 .4cA0,c = 1 .4cA0。
在适宜的反应条件下分别测定333.15,338.15,343.15,348.15 K下的动力学数据。由测得数据结合式(1)~(11)可得各个温度下的Y~t关系,见图6。
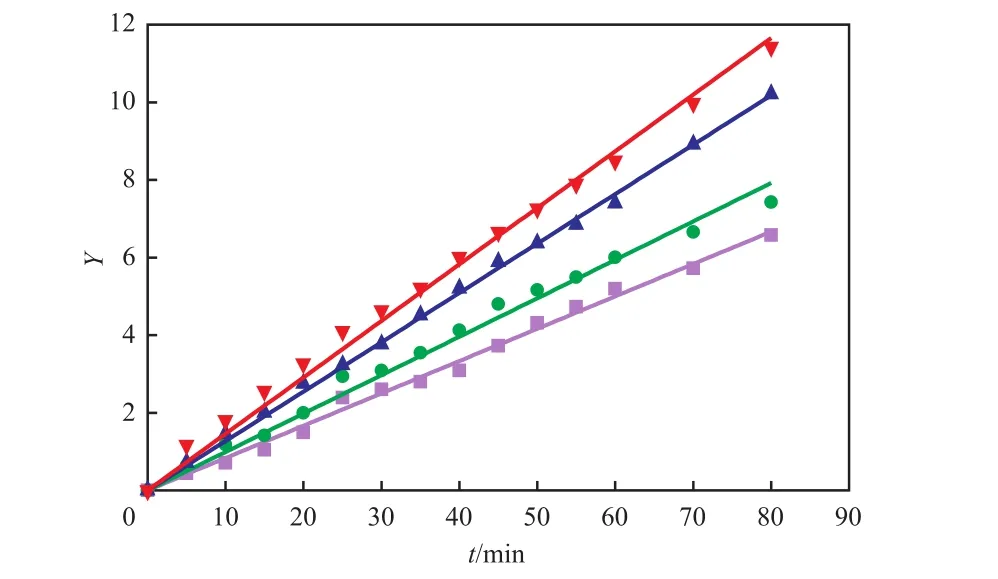
图6 不同反应温度下Y与t的关系Fig.6 Relationship of Y and t at different temperatures.Y:the product of k+ and t,k+:positive reaction rate constant;t:reaction time.Temperature/K:■ 333.15;● 338.15;▲ 343.15;▼ 348.15;— Fitting lines
从图6可看出,各温度下的Y与t的线性关系显著,验证了动力学模型的准确性[17],确定了催化剂C100FLH催化酯化合成丙酸甲酯为二级可逆反应。由图6中各直线斜率可得不同温度下正反应速率常数,见表1。
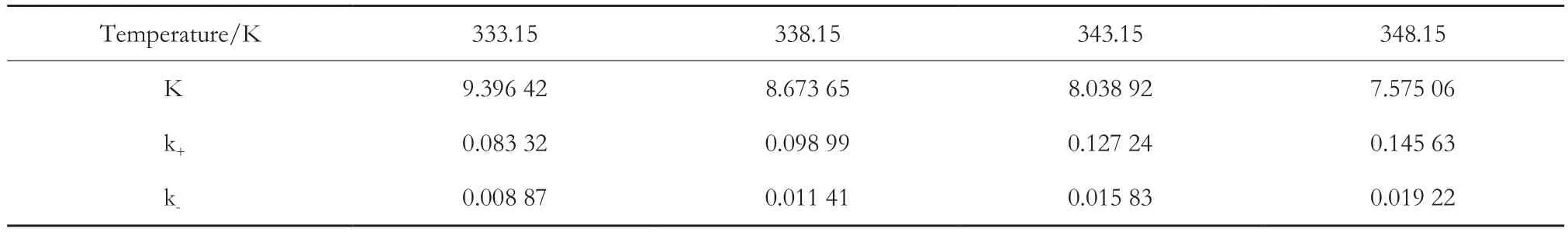
表1 K、k+和k-的值Table 1 Values of K、k+ and k-
由Arrhenius方程可知:

式中,E为活化能,J/mol;R为理想气体常数,J/(mol·K);T为反应温度,K。
将lnk+、lnk-分别对1/T做图,如图7所示。根据Arrhenius 方程可以求得活化能E和指数前因子k0,结果见表2。从表2可看出,正、逆反应速率常数的指数前因子分别为55 792.236,914 415.19 L/(mol·min),正、逆反应活化能分别为37 164.789,51 106.882 J/mol。
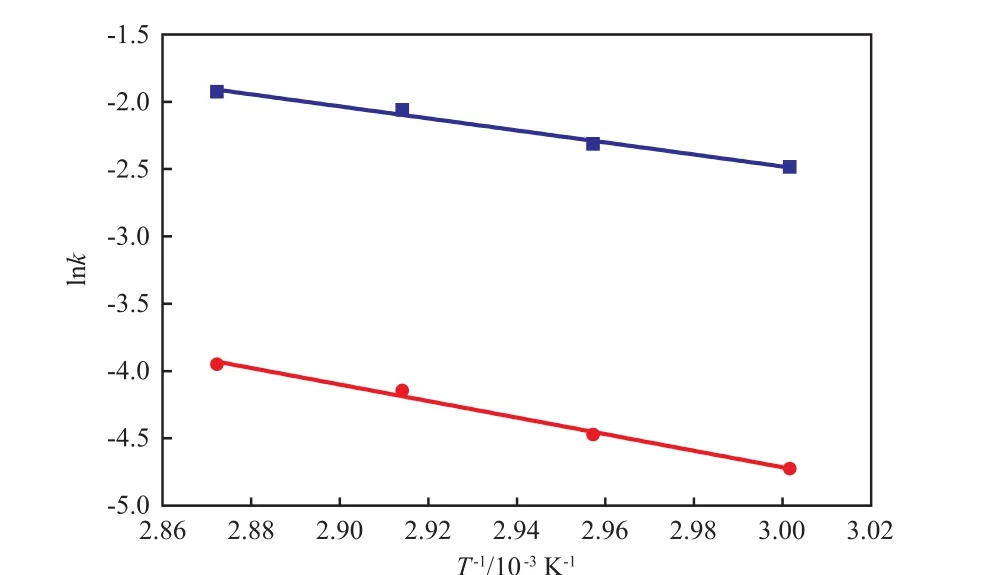
图7 反应速率常数和温度的关系Fig.7 Relationship of reaction rate constant and temperature■ lnk+;● lnk-;— Fitting lines

表2 指数前因子k0和活化能E的值Table 2 Values of k0 and E
综上所述,以C100FLH阳离子交换树脂为催化剂,酯化合成丙酸甲酯的动力学方程为:
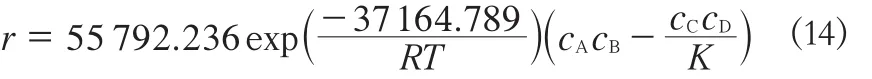
式中,K=exp(1676.9 4/ T - 2 .7966)。
3 结论
1)以丙酸和甲醇为原料酯化合成丙酸甲酯的适宜的反应条件为:C100FLH阳离子交换树脂为催化剂、搅拌转速200 r/min、催化剂用量为丙酸质量的10%,反应温度343.15 K,酸醇摩尔比1.4∶1。
2)建立拟均相反应模型,在333.15~348.15 K的条件下,得到酯化生成丙酸甲酯动力学方程为r = 55 792.236exp(-37 164.789/RT)(cAcB-cCcD/K), 式中,K=exp(1676.9 4/ T - 2 .7966)。
[1] 徐魁,崔英德,黄仲涛,等. 乙烯均相羰基合成丙酸甲酯的催化研究[J].精细石油化工,1999(1):31-33.
[2] 旭阳化学技术研究院有限公司. 一种催化剂组合物、其制备方法以及使用该催化剂组合物制备丙酸甲酯的方法:104383918 A[P]. 2015-03-04.
[3] 程能林. 溶剂手册(第五版)[M].北京:化学工业出版社,2015,5.
[4] 常州市松盛香料有限公司. 丙酸甲酯的制备方法:104761451 A[P].2015-07-08.
[5] 钟桐生,俞善信,文瑞明. 硫酸氢钠催化合成丙酸酯[J].贵州师范大学学报,2002,20(2):96-98.
[6] 邢台旭阳煤化工有限公司. 一种催化合成丙酸甲酯的方法:102320962 A[P].2012-04-11.
[7] 赵彦玲,赵艳平,赵丽云. 利用离子液体催化剂合成丙酸甲酯[J].煤炭与化工,2013,36(11):39-41.
[8] 胥学旺,刘震,马春平,等. 离子液体中丙酸甲酯的合成[J].化学世界,2006,47(11):667-668.
[9] Liu Gangliang,Li Gang,Song Haiyan. Direct synthesis of methyl propionate from n-propyl alcohol and methanol using gold catalysts[J].Catal Lett,2009,128(3/4):493-501.
[10] 霍稳周,李花伊,陈明,等. 耐温强酸性阳离子交换树脂催化合成乙酸丁酯[J].石油化工,2006,35(7):681-684.
[11] Kirbastar S I,Baykal Z B,Dramur U. Esterification of acetic acid with ethanol catalysed by an acidic ion-exchange resin[J].Turk J Eng Environ Sci,2001,25(6):569-577.
[12] Erdem B,Cebe M. Kinetics of esterification of propionic acid with n-amyl alcohol in the presence of cation exchange resins[J].Korean J Chem Eng,2006,23(6):896-901.
[13] Ali S H. Kinetics of catalytic esterification of propionic acid with different alcohols over Amberlyst 15[J].Int J Chem Kinet,2009,41(6):432-448.
[14] Tsai Y T,Lin H M,Lee M J. Kinetics of catalytic esterification of propionic acid with methanol over amberlyst 36[J].Ind Eng Chem Res,2010,50(3):1171-1176.
[15] Awad M M B,Salem A M A,Swelam A A. Kinetics of catalysed esterification of propionic acid with various alcohols using synthetic cation exchange resin[J].J Indian Chem Soc,1997,74(6):467-469.
[16] 屈一新,汪文川,陈滨,等. 丙酸和甲醇酯化反应动力学及其化学反应相平衡的研究[J].化工学报,1997,48(5):576-583.
[17] 李柏春,巢飞,徐敬瑞,等. 甲缩醛催化精馏过程宏观动力学研究[J].化学工程,2012,40(6):64-67.
