转录因子MAZ对c1orf109基因转录表达调控的体外研究*
2018-01-19王雪伟任剑波王小怡郭大玮
王雪伟, 任剑波, 王小怡, 王 博, 高 哲, 郭大玮
(山西医科大学法医学院, 转化医学研究中心, 山西 太原 030001)
近来文献发现,人类1号染色体开放阅读框109 (human chromosome 1 open reading frame 109,c1orf109)基因(BmOrfGenBank ID:NM_017850.1)在多种肿瘤细胞系中表达上调,在乳腺癌Hs578T细胞中,c1orf109的外源性表达可诱导乳腺癌Hs578T细胞的增殖。c1orf109启动子区、CAAT盒和TATA盒是其基础调节的顺式作用元件,GC盒在此基础上抑制c1orf109的转录。而染色质免疫沉淀技术(chromatin immunoprecipitation,ChIP)和凝胶电泳迁移实验(electrophoretic mobility shift assay,EMSA)均证明GC盒有结合转录因子特化蛋白1(specificity protein 1,Sp1)的位点[1]。许多研究发现,Myc相关锌指蛋白(Myc-associated zinc-finger protein,MAZ)表达水平异常可以促进许多肿瘤生长及炎症进展过程[2-6]。亦有文献报道MAZ和Sp1常共同参与同一个基因的表达调控,结合位点序列类似,并有重叠或共享结合位点的情况[7-10],但也有文献表明在某些基因的启动区, Sp1和MAZ只结合各自的结合位点[11]。Sp1和MAZ有时共同激活基因的表达[8,12-13],有时共同抑制基因的表达,如MAZ基因[7];而对内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)基因的表达,Sp1与MAZ的作用相反,前者增强其表达,后者则抑制其表达[9]。关于c1orf109基因,目前尚未见到MAZ及Sp1对其转录调控的报道。
材 料 和 方 法
1 主要试剂
THP-1细胞购自中国科学院上海生命科学研究院细胞资源中心;HeLa细胞及荧光报告系统的绿色荧光序列由山西医科大学转化医学研究中心崔永萍教授惠赠;DMEM培养基购自Gibco;胎牛血清购自天津康源生物技术有限公司;青、链霉素混合液(100×)购自北京索莱宝科技有限公司;末端脱氧核糖核酸转移酶和化学发光法EMSA试剂盒购自碧云天生物技术有限公司;EMSA所用探针的寡核苷酸均由Thermo Scientific合成;Biotin-11-dUTP购自Thermo Fisher;LipofectamineTM3000 Reagent购自Invitrogen;Sp1表达质粒pN3-Sp1FL购自Addgene;pReceiver-MAZ表达质粒购自Fulengen。
2 主要方法
2.1细胞培养 对冻存的THP-1和HeLa细胞进行复苏,THP-1细胞以含10%胎牛血清与1%青、链霉素的RPMI-1640培养液、HeLa细胞以含10%胎牛血清与1%青、链霉素的DMEM培养液于37 ℃、5% CO2的条件下常规培养。
2.2细胞核蛋白提取 复苏的细胞稳定传2~3代后, 分别取指数增长期的THP-1和HeLa细胞按实验目的用终浓度为10 mg/L的脂多糖(lipopolysaccharide,LPS)刺激不同的时间。然后采用细胞核蛋白与细胞浆蛋白抽提试剂盒分别提取THP-1细胞和HeLa细胞的核蛋白,保存于-80 ℃。BCA法进行核蛋白定量并利用酶标仪进行检测。
2.3结合探针设计 据报道, MAZ和Sp1结合序列分别为5’- GGGCGG -3’和5’- GGGAGGG -3’[7]。利用PROMO 3.0.2对c1orf109基因转录起始点上游-2 500 bp~-1 bp的DNA序列进行转录因子结合位点预测,筛选出其中1段序列c1orf109WT -1 689~-1 670 bp(5’-TTCCCCGCCCTCCCCACCAA-3’), 合成探针109进行EMSA实验。为了分析Sp1与MAZ结合点的关系, 合成突变探针109M:c1orf109WT -1 692~-1 670 bp mutSp1 (5’-TGTTAAAAGCCCTCCCCACCAA-3’)和109S : c1orf109WT -1 692~-1 670 bp mutMAZ(5’-TGTTCCCCGCCCAAAACACCAA-3’),分别将Sp1结合点和MAZ结合点突变。以Her等[11]报道的mut48探针(5’-GTCTTTGCGGGGGGGAGGGGA-3’)和mut38 探针(5’-GTCTGGGCGGGGTTTAGGGGA-3’)分别作为MAZ和Sp1的阳性对照探针。同时, 为竞争反应合成无关探针20(已做EMSA实验无DNA-蛋白结合带)为5’-TCCCAGCAACTGGAGCAGCTTCAT-3’。
2.4EMSA实验 TE缓冲液(pH 8.0)溶解寡核苷酸单链后,按末端脱氧核糖核酸转移酶说明书配制探针标记体系,以获得生物素标记的单链寡核苷酸。将互补的寡核苷酸单链和PCR Buffer(10×)以9∶9∶2比例混匀,总体积20 μL,95 ℃孵育10 min,室温2 h退火,获得生物素标记的双链探针, -20 ℃保存备用。然后配制探针蛋白结合体系, 室温结合20 min,恒压、I=11~17 mA、TBE缓冲液(0.5×)条件下采用5.5%SDS-PAG进行电泳60 min;然后恒流、U=5~11 V条件下半干转膜60 min,转印至带正电荷尼龙膜上,封闭、洗涤、底物反应、暗室曝光。其中Super-shift实验中,探针、核蛋白及MAZ抗体需4 ℃孵育过夜。
2.5质粒构建 利用实验室前期构建的c1orf109启动子区驱动的增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)报告载体,此报告载体(记作109)中EGFP的表达代表c1orf109蛋白的表达情况,且为了分析MAZ和Sp1在c1orf109基因启动子区的活动,本实验利用c1orf109报告载体中相关的限制性内切酶去掉不同c1orf109启动子区的一些片段,构建含有不同长度c1orf109启动子区分析质粒表达载体,切去-1 795~-1 506 bp的质粒记作109A,切去-1 795~-918 bp的质粒记作109B,切去-918~23 bp的质粒记作109C,其启动子区见图1。
2.6细胞转染后激光共聚焦显微镜及流式细胞术分析 取稳定生长的HeLa细胞,以2~8×105密度用无双抗培养基接种于6孔板,37 ℃、5% CO2培养12 h后转染,转染24 h后用激光共聚焦显微镜采集图像,流式细胞术分析。 其中分析MAZ及Sp1对c1orf109的作用时,用c1orf109启动子区驱动的EGFP报告载体与 MAZ表达质粒和Sp1表达质粒共转染,即MAZ和Sp1过表达。阴性对照用共转染同等量的pGL3空表达载体来控制。
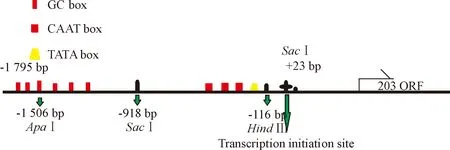
Figure 1. The schematic diagram ofc1orf109 promoter region.
图1c1orf109启动子区结构示意图
3 统计学处理
实验数据用均数±标准差(mean±SD)来表示。应用SPSS 13.0统计软件进行单因素方差(one-way ANOVA)分析,以LSD或Dunnett’s T3法进行组间两两比较。以P<0.05为差异有统计学意义。
结 果
1 转录因子MAZ可与c1orf109启动子区结合,且两者有共享结合位点的情况
Her等[11]报道过,大鼠的PNMT基因启动子区有结合点mut48和mut38,仅分别与MAZ和Sp1结合。EMSA结果显示,c1orf109WT的-1 689 bp~-1 670 bp片段可以结合来自于THP-1细胞核蛋白的转录因子MAZ和Sp1,见图2。
EMSA冷竞争结果显示,分别用无关未标探针20,109M探针用量的1 200倍、未标阳性对照探针mut48,109M探针用量的300倍、100倍、70倍、40倍来竞争已标记的c1orf109M探针结合蛋白,无关未标探针未表现出竞争作用,而随未标阳性对照探针mut48竞争倍数递减,其竞争探针109M结合MAZ的作用逐渐减弱;EMSA冷竞争结果显示,未标阳性对照探针mut38,109S探针用量的1 200倍,对已标探针109M结合THP-1核蛋白有明显的竞争作用,突变掉Sp1结合点的探针109M也可结合Sp1,见图2。
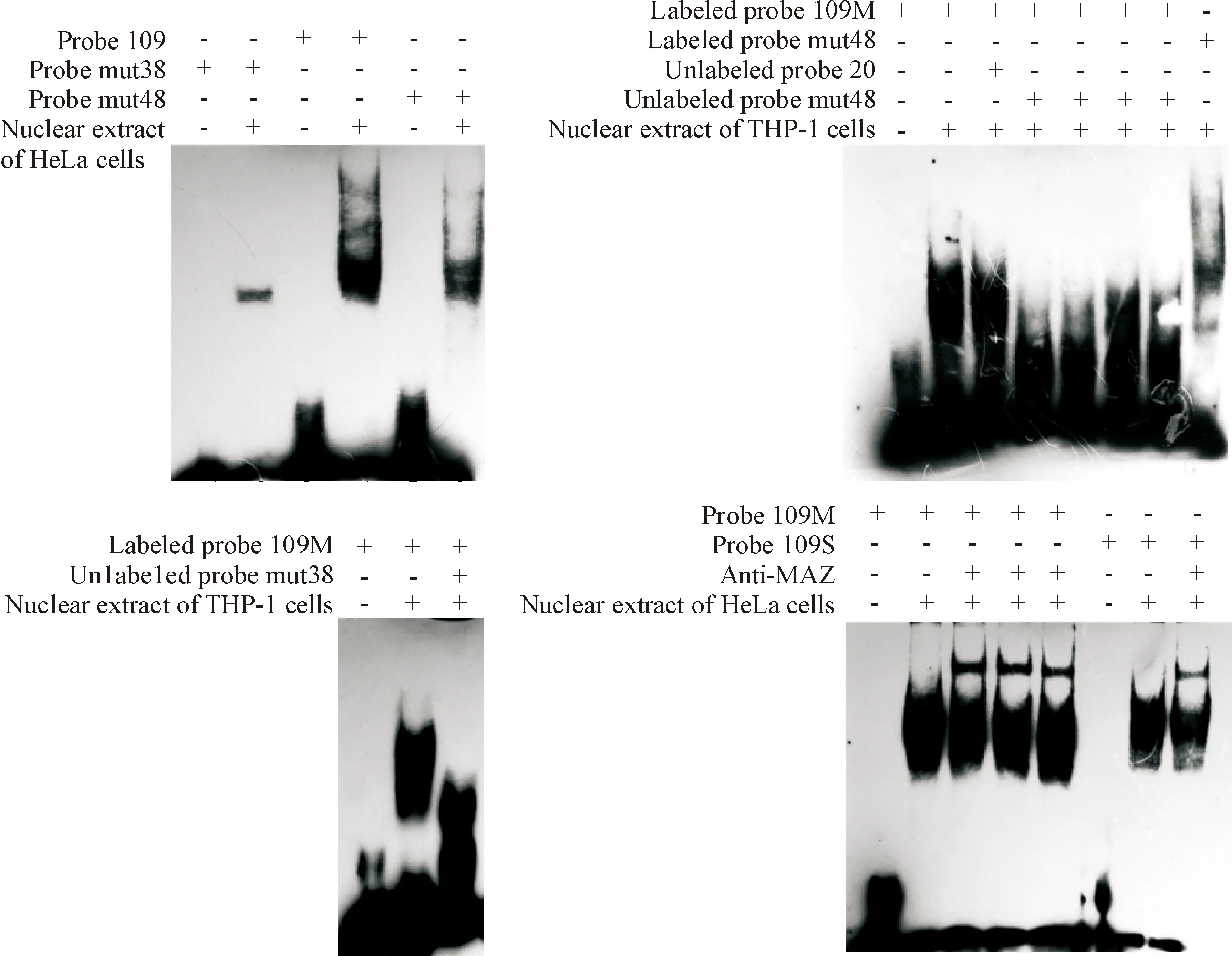
Figure 2. The probe 109, mutation probe 109M and 109S combined with MAZ and Sp1 from the nuclear proteins of cells were analyzed by EMSA.
图2探针109及其突变探针109M和109S与细胞核提取物中的MAZ、Sp1结合的EMSA实验结果
Super-shift结果显示,探针109M,加HeLa细胞核蛋白及MAZ抗体后均有明显的超迁移条带;探针109S,加HeLa细胞核蛋白及MAZ抗体后也有明显的超迁移条带;c1orf109启动子区可结合转录因子MAZ,且在c1orf109WT -1 689 bp~-1 670 bp上MAZ和Sp1两者共享结合位点,见图2。
2 转录因子MAZ和Sp1抑制c1orf109基因的转录表达
为了分析MAZ和Sp1在c1orf109基因启动子区的活动,本实验用含不同长度的c1orf109启动子区的c1orf109报道载体和0.5 μg的MAZ或Sp1表达质粒共转染HeLa细胞,24 h后采用激光共聚焦显微镜观察和流式细胞术分析,其中流式细胞术分析以EGFP的平均荧光强度值来评估c1orf109基因的转录表达情况。激光共聚焦显微镜观察结果显示,过表达转录因子MAZ和Sp1后, EGFP表达减少,且过表达Sp1组的表达量减少更明显。转录因子MAZ和Sp1抑制c1orf109基因的转录表达,且Sp1的抑制作用明显大于MAZ;去MAZ和Sp1的结合点后,过表达MAZ和Sp1后EGFP表达量也相应减少,见图3。

Figure 3. The confocal scanning microscopic observation results of transcription factor MAZ and Sp1 repressing the expression ofc1orf109invitro(×400).
图3在体外实验中转录因子MAZ和Sp1抑制c1orf109基因表达的激光共聚焦显微成像观察结果
对于c1orf109的所有表达载体,流式细胞术分析结果所示,过表达转录因子MAZ和Sp1后EGFP光蛋白表达减少,且过表达Sp1组的表达量减少更明显。转录因子MAZ和Sp1抑制c1orf109基因的转录表达,且明显Sp1的抑制作用大于MAZ;去MAZ和Sp1的结合点后,过表达MAZ和Sp1后,EGFP表达量也相应减少,与激光共聚焦显微镜分析结果相一致。MAZ和Sp1的抑制作用不仅仅只依靠与c1orf109启动子区的直接结合,见图4。
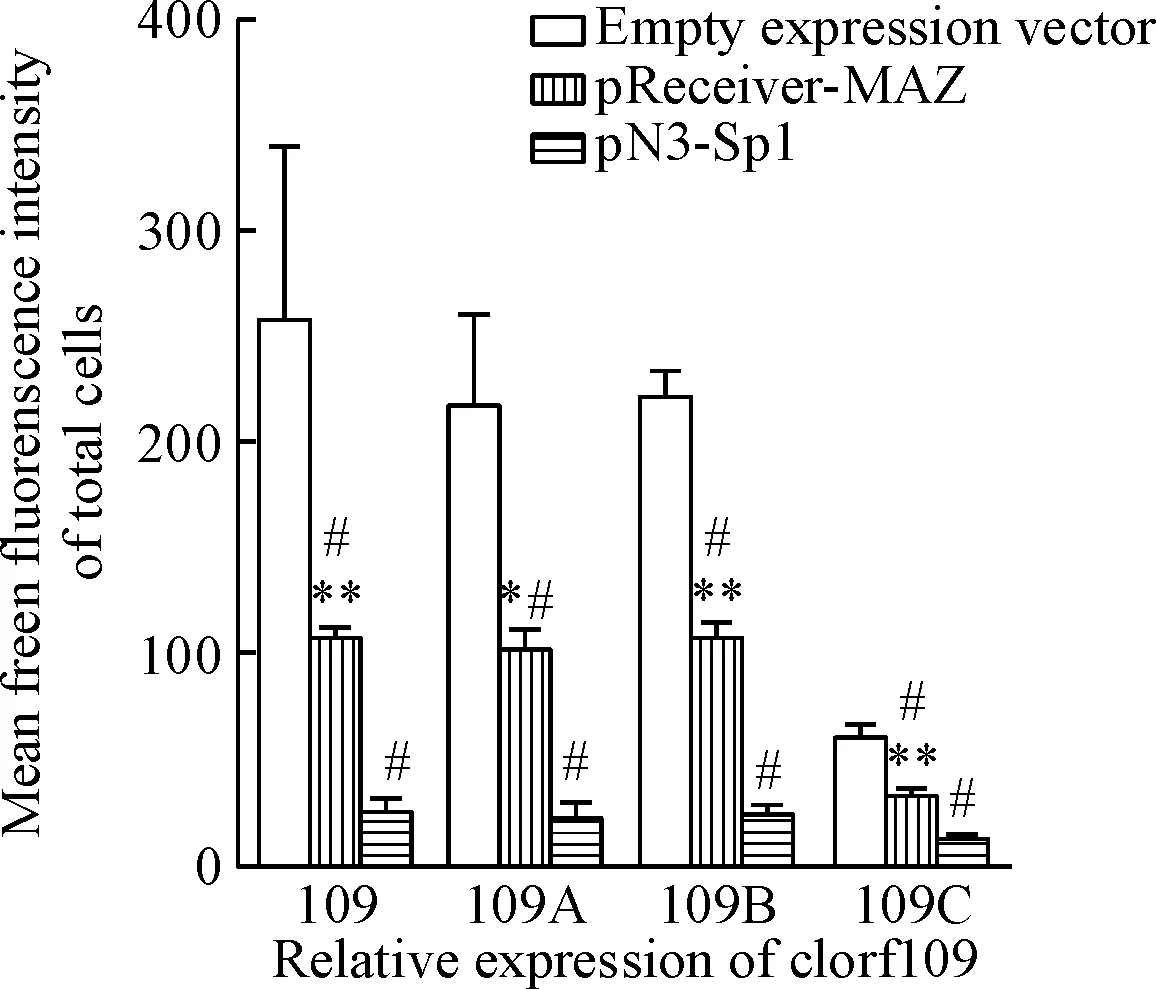
Figure 4. The results of flow cytometry analysis that transcription factor MAZ and Sp1 repressed the expression ofc1orf109invitro. Mean±SD.n=3.*P<0.05,**P<0.01vspN3-Sp1 group;#P<0.05vsempty expression vector group.
图4流式细胞术分析体外实验中转录因子MAZ和Sp1抑制c1orf109转录表达的结果
讨 论
1 转录因子MAZ与c1orf109启动子区结合
Liu等[1]报道,c1orf109启动子区,CAAT盒和TATA盒是基础调节的顺式作用元件,GC盒在此基础上抑制c1orf109的转录,并证明GC盒有结合Sp1的位点。但目前并未有人报道转录因子MAZ可以与c1orf109启动子区结合。MAZ是一种作用较广泛的转录因子,研究发现MAZ表达水平异常可以促进许多肿瘤生长及炎症进展过程,是癌症发生发展过程中十分重要的影响因子之一[2-6],而c1orf109基因在多种肿瘤细胞系中表达上调,如在乳腺癌Hs578T细胞中,c1orf109的外源性表达诱导乳腺癌Hs578T细胞的增殖[1, 14];且据报道 Spl和MAZ常参与同一个基因的表达调控[8-14]。综上所述, 本文通过PROMO软件预测c1orf109基因转录起始点上游-2 500 bp~-1 bp的DNA序列与MAZ的结合位点,合成相关结合探针与HeLa细胞核提取物孵育并经EMSA分析显示转录因子MAZ可与c1orf109启动子区结合。
2 转录因子MAZ和Sp1结合位点的关系
MAZ和Sp1的结合序列分别为5’-GGGCGG-3’ 和 5’-GGGAGGG-3’,序列非常相似,已有报道在MAZ基因[7]、HTlAr基因[8]、eNOS基因[9]、PNMT基因[10]和PTHr基因[12-13]上,MAZ与Sp1的结合位点有重叠,甚至两者的结合点共享;但亦有报道在大鼠的PNMT基因[11]上MAZ和Sp1与它们各自的结合位点的结合是相互独立的。为了进一步分析在c1orf109基因的启动子区两者的结合关系,本文分别用突变此结合位点MAZ点和Sp1点的相关生物素标记探针109S、109M与未标相关的阳性对照探针竞争结合THP-1细胞核蛋白, EMSA分析结果显示,突变Sp1结合位点的探针109M也既可以结合MAZ也可结合Sp1。Super-shift结果示,探针109S也可结合MAZ。提示在c1orf109启动子区转录因子MAZ和Sp1两者有共享结合位点的情况。
3 MAZ与Sp1对c1orf109的复杂调节机制
据报道,MAZ和Sp1介导的对MAZ基因的抑制作用是相互独立的,组蛋白的去乙酰化酶参与MAZ的抑制作用,但在Sp1的抑制作用中却招募DNA甲基转移酶1。因此推测看家基因的下调可能由结合MAZ和Sp1后招募不同的抑制子来完成[15]。本实验用限制性内切酶去不同的c1orf109启动子区的一些片段构建含有不同长度启动子区c1orf109分析质粒表达载体的109A、109B、109C来进一步分析Sp1和MAZ在c1orf109启动子区的活动。经体外转染实验、激光共聚焦显微镜观察和流式细胞术分析结果显示,截掉了MAZ和Sp1的结合位点后,过表达MAZ和Sp1对c1orf109的表达仍有抑制作用。综上提示MAZ和Sp1不仅只通过直接结合c1orf109启动子区来实现对c1orf109基因的调控,可能还招募其它的转录因子来参与对c1orf109的抑制, 由转录因子Sp1 和MAZ介导的分子网络调节机制对c1orf109转录表达的抑制调控很重要,并且这种分子网络调节机制可能很复杂;转录因子MAZ和Sp1的复杂调节在遗传学上有重要意义,进而影响生物的生理进程。
4 转录因子MAZ和Sp1的调节作用对c1orf109的表达有重要意义
根据文献报道, 转录因子MAZ和Sp1对基因表达调节的作用不尽相同。本文用构建的由c1orf109启动子区驱动的绿色荧光报告质粒与MAZ或Sp1表达质粒共转染HeLa细胞24 h后,激光共聚焦显微镜观察及流式细胞术分析结果显示,MAZ和Sp1均对c1orf109基因的转录表达有明显的抑制作用,并且Sp1的抑制作用更强。根据报道,2种及以上的转录因子对基因的同一方向的调节这种功能性冗余概念已多次被提出,这种冗余调节对于相关基因的表达很重要,且细胞因子和转录因子的功能冗余性和遗传冗余性是生物进化、生物复杂性和多样性的基础,有重要的理论意义和实际意义,应该深入研究[16]。如转录因子E2F家族表现有功能冗余性调节,在正常和肿瘤细胞中与染色质结合的E2F家族可能是活性转录复合体的路标[17]。Snail家族是经典的转录抑制子,在淋巴细胞的发育中转录因子Snail家族扮演重要角色,SNAI2和SNAI3的消除对影响成熟T细胞和B细胞的产生有重要作用[18]。在早期发展和细胞的生长和分化中,MAZ和Sp1及SP其它家族成员存在功能性冗余,且由Sp1家庭的转录因子(Sp1和Sp3)和MAZ介导的染色质修饰和染色质重塑的分子网络机制,是未来了解富含GC启动子的基因表达的关键[19]。而在c1orf109基因的转录表达调控中,MAZ和Sp1共同抑制其表达的这种冗余机制提示MAZ和Sp1对c1orf109的抑制调控对c1orf109基因表达有重要意义。c1orf109基因表达对机体的相关生命活动可能也有重要意义。据报道,c1orf109基因本身在多种肿瘤中表达上调,如在乳腺癌Hs578T细胞中,c1orf109的外源性表达诱导乳腺癌Hs578T细胞的增殖;且c1orf109基因还是CK2激酶的底物之一[1],新的证据表明,被检测的所有癌症中CK2激酶表达上调[20-21];因此,c1orf109基因与癌症有着不可忽略的联系,提示转录因子MAZ和Sp1对c1orf109的重要调节作用,可能对与c1orf109表达异常相关癌症的病理生理过程有重要意义。
总之,本实验首次报道c1orf109启动子区可以结合转录因子MAZ,并且发现MAZ和Sp1有共享结合位点的现象;转录因子MAZ及Sp1共同抑制c1orf109的转录表达,且Sp1的抑制作用强于MAZ;MAZ和Sp1不仅只通过结合c1orf109启动子区来实现对c1orf109基因的调控,可能还招募其它的转录因子来参与对c1orf109的抑制;综上所述转录因子MAZ和Sp1的复杂调节及作用方向一致的冗余调节在遗传学上有重要意义,进而影响生物的生理进程。
[1] Liu SS, Zheng HX, Jiang HD, et al. Identification and characterization of a novel gene,c1orf109, encoding a CK2 substrate that is involved in cancer cellproliferation[J]. J Biomed Sci, 2012, 19:49.
[2] Ray A, Ray BK. Isolation and functional characterization of cDNA of serum amyloid A-activating factor that binds to the serum amyloid A promoter[J]. Mol cell Biol, 1998,18(12):7327-7335.
[3] Ray A, Ray BK. A novel cis-acting element is essential for cytokine-mediated transcriptional induction of the serum amyloid A gene in nonhepatic cells[J]. Mol cell Biol, 1996, 16(4): 1584-1594.
[4] Ray A, Dhar S, Ray BK. Control of VEGF expression in triple-negative breast carcinoma cells by suppression of SAF-1 transcription factor activity[J]. Mol Cancer Res, 2011, 9(8):1030-1041.
[5] Wang X, Southard RC, Allred CD, et al. MAZ drives tumor-specific expression of PPAR gamma 1 in breast cancer cells[J]. Breast Cancer Res Treat, 2008, 111(1):103-111.
[6] Jiao L, Li Y, Shen D, et al.The prostate cancer-up-regulated Myc-associated zinc-finger protein (MAZ) modulates proliferation and metastasis through reciprocal regulation of androgen receptor[J]. Med Oncol, 2013, 30(2):570.
[7] Jun S, Murakami H, Tsutsui H, et al. Genomic organization and expression of a human gene for Myc-associated zinc finger protein (MAZ) [J]. J Biol Chem, 1998, 273(32):20603-20614.
[8] Parks CL, Shenk T. The serotonin 1a receptor gene contains a TATA-less promoter that responds to MAZ and Sp1[J]. J Biol Chem, 1996, 271(8):4417-4430.
[9] Karantzoulis-Fegaras F, Antoniou H, Lai SL, et al. Cha-racterization of the human endothelial nitric-oxide synthase promoter[J]. J Biol Chem, 1999,274(5): 3076-3093.
[10] Her S, Bell RA, Bloom AK,et al. Phenyl-ethanolamineN-methyltransferase gene expression. Sp1 and MAZ potential for tissue-specific expression[J]. J Biol Chem, 1999, 274(13):8698-8707.
[11] Her S, Claycomb R, Tal TC, et al. Regulation of the rat phenylethanolamine N-methyltransferase gene by transcription factors Sp1 and MAZ[J]. Mol Pharmacol, 2003,64(5):1180-1188.
[12] Parks CL, Shenk T.Activation of the adenovirus major late promoter by transcription factors MAZ and Spl[J]. J Virol, 1997, 71(12):9600-9607.
[13] Kawane T, Mimura J, Fujii-Kuriyama Y.Para-thyroid hormone (PTH) suppresses rat PTH/PTH-related protein receptor gene promoter[J]. Biochem Biophys Res Commun,2001, 287(2):318-322.
[14] Meng XW, Li Y, Zhang GY,et al. Molecular cloning of tumor metastasis related genes from human lung adenocarcinoma cells by mRNA differential display[J]. Chinese J Med Genet, 1997,14:129-133.
[15] Song J, Ugai H, Kanazawa I, et al. Independent repression of a GC-rich housekeeping gene by Sp1 and MAZ involves the same cis-elements[J]. J Biol Chem, 2001,276(23) :19897-19904.
[16] 吴克复.细胞因子和转录因子的功能丰余性及其意义[J].中国实验血液学杂志, 2003, 11(4):434-436.
[17] Xu X, Bieda X, Jin VX, et al. A comprehensive ChIP-chip analysis of E2F1, E2F4,and E2F6 in normal and tumor cells reveals interchangeable roles of E2F family members[J]. Genome Res, 2007,17(11):1550-1561.
[18] Pioli PD, Weis JH. Snail transcription factors in hematopoietic cell development: a model of functional redundancy[J].Exp Hematol, 2014, 42(6):425-430.
[19] Song J, Uqai H, Nakata-Tsutsui H, et al. Transcriptional regulation by zinc-finger proteins Sp1 and MAZ involves interactions with the same cis-elements[J].In J Mol Med, 2003,11(5):547-553.
[20] Tawfic S, Yu S, Wang H, et al. Protein kinase CK2 signal in neoplasia[J]. Histol Histopathol, 2001, 16(2):573-582.
[21] Trembley JH, Wang G, Unger G, et al. CK2: a key player in cancer biology[J]. Cell Mol Life Sci, 2009, 66(11-12):1858-1867.
