外源性硫化氢对肝细胞NLRP3炎症小体的影响*
2018-01-19王红钢孙伟力钟培育吴东栋王国英李彦章
王红钢, 孙伟力, 钟培育, 吴东栋, 王 军, 蔡 欢, 王国英, 乔 玲, 张 涛, 李彦章
(1河南大学基础医学院, 2河南大学民生学院, 河南 开封 475004)
炎症小体(inflammasome)是机体免疫系统的组成成分,是一种多蛋白复合体,可识别病原微生物和内源性危险信号,即病原相关分子模式和损伤相关分子模式等蛋白复合物,通过激活半胱氨酸天冬氨酸酶-1(caspase-1),诱导促炎因子白细胞介素-1β和白细胞介素-18成熟和分泌,调控炎症反应,抵抗病原体感染和应激损伤,但其过度活化可导致组织器官炎症损伤[1-2]。其中NLRP3炎症小体由NOD样受体家族成员NLRP3、接头蛋白ASC和pro-caspase-1组成,是目前研究最多最透彻的炎症小体。已确认NLRP3炎症小体在很多疾病的炎症发生发展中起重要作用,因此,NLRP3炎症小体已成为众多炎症疾病治疗药物开发的探索靶点。
硫化氢(hydrogen sulfide,H2S)是哺乳动物体内一种重要的气体信号分子,在脂代谢和心肌细胞损伤等生理病理过程中起重要作用,其在哺乳动物体内以半胱氨酸为底物,在胱硫醚γ-裂解酶(cystathionine γ-lyase,CSE)、胱硫醚β-合酶(cystathionine β-synthase,CBS)和3-巯基丙酮酸硫基转移酶(3-mercaptopyruvate sulfurtransferase,3-MST)的催化下产生[3-4],具有重要的抗炎作用[5]。目前,H2S在炎症中的作用已被广泛研究,但其与NLRP3炎症小体的关系鲜见报道,本文用脂多糖(lipopolysaccharide,LPS)刺激人肝细胞L02和SMMC-7721建立炎症模型,用硫氢化钠(sodium hydrosulfide hydrate,NaHS)释放外源性H2S施加干预来研究H2S对NLRP3炎症小体的影响,以期为研发NLRP3炎症小体靶向的抗炎药物提供理论依据。
材 料 和 方 法
1 实验材料
L02细胞和SMMC-7721细胞购自上海纪宁实业;DMEM和胎牛血清购自Gibco;脱脂奶粉购自北京鼎国生物公司。
2 实验方法
2.1细胞分组 将细胞分为4组:对照(control)组、LPS组、LPS+NaHS组和NaHS组。对照组用普通培养基培养18.5 h;LPS组用普通培养基培养0.5 h后,再用LPS(100 μg/L)刺激18 h;LPS+NaHS组用NaHS(200 μmol/L)刺激0.5 h后,再用LPS刺激18 h;NaHS组用NaHS(200 μmol/L)刺激0.5 h后,再用普通培养基培养18 h。
2.2MTT法检测不同浓度LPS对两种肝细胞细胞活力的影响 将肝细胞以1×107/L的浓度接种于96孔板中,每孔0.2 mL,每个浓度设置3个复孔,周边孔不加液体以去除边缘效应,培养24 h后将培养液换为含不同浓度(0、100、200、500和1 000 μg/L)LPS的培养基诱导肝细胞18 h后,每孔加入5 g/L的MTT溶液 20 μL,培养4 h后弃掉培养液,每孔加入150 μL DMSO振荡5 min,然后在酶标仪上测定570 nm处的吸光度(A)值,细胞活力(%)=(处理组A值/对照组A值)×100%。重复上述实验3次。
2.3Western blot实验 弃去6孔板中的培养基,用冷的PBS清洗细胞3遍,然后每孔加入200 μL RIPA裂解液,混匀后室温静置10 min,然后将细胞转移至1.5 mL的离心管中,在冰上振荡裂解5 min,然后12 000×g、4 ℃离心,将上清转移至另一个新的1.5 mL的离心管中,按照BCA试剂盒说明检测蛋白浓度。检测后的蛋白样品经变性处理后用于SDS-PAGE。电泳结束后将胶放在转膜液中平衡10 min,然后组装成“三明治”的形式,100 V、转膜45~60 min,完成后取出PVDF膜,用TBS清洗10~15 min。 I 抗(NLRP3和caspase-1)用含有脱脂奶粉的TBST稀释(1∶1 000),加至PVDF膜室温孵育2 h,然后用TBST缓冲液洗PVDF膜3次,每次10 min,再加入HRP标记 II抗(1∶1 000稀释)室温孵育2 h,然后用TBST缓冲液洗PVDF膜3次,每次10 min,加入显色液照相保存结果。
3 统计学处理
采用GraphPad Prism 5统计软件进行统计分析。数据以均数±标准差(mean±SD)表示,采用t检验分析两组均数间的差异,采用单因素方差分析检验多组均数间的差异,以P<0.05 表示差异有统计学意义。
结 果
1 不同浓度LPS对细胞活力的影响
为确定建立炎症模型所用LPS是否对细胞活力有影响,本实验用不同浓度的LPS分别刺激L02细胞和SMMC-7721细胞18 h后,用MTT法检测细胞活力。结果显示,与对照组(0 μg/L LPS)相比,浓度100~500 μg/L 的LPS对2种肝细胞均无毒性作用,见图1。
2 不同浓度LPS对胞内NLRP3炎症小体表达的影响
为检测LPS的促炎效果,本实验用不同浓度的LPS刺激L02细胞和SMMC-7721细胞18 h后,用Western blot 检测NLRP3炎症小体的表达。结果显示,与对照组相比,用浓度为100 μg/L的LPS刺激细胞,NLRP3和caspase-1在两种细胞中的表达均明显增强(P<0.05),见图2、3。综合以上的实验结果,本实验选择LPS的浓度为100 μg/L。
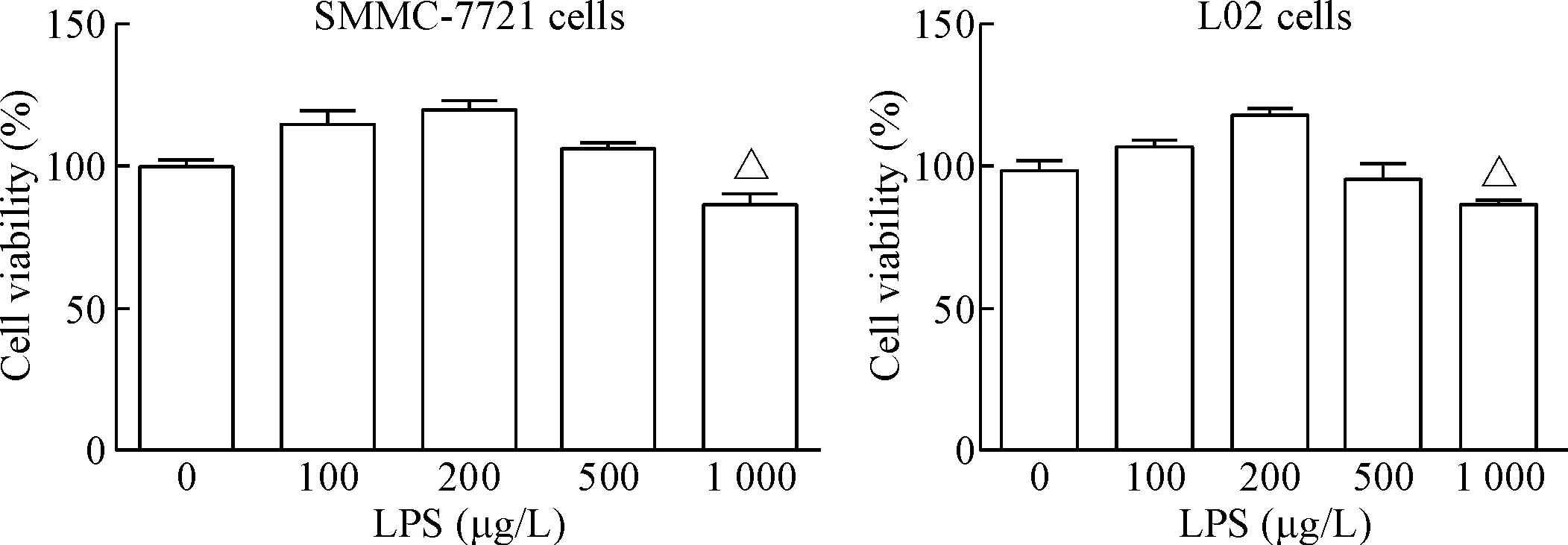
Figure 1. MTT assay was used to measure the effect of LPS at different concentrations on the viability of SMMC-7721 cells and L02 cells. Mean±SD.n=3.△P<0.05vs0 μg/L.
图1不同浓度LPS对SMMC-7721细胞和L02细胞活力的影响
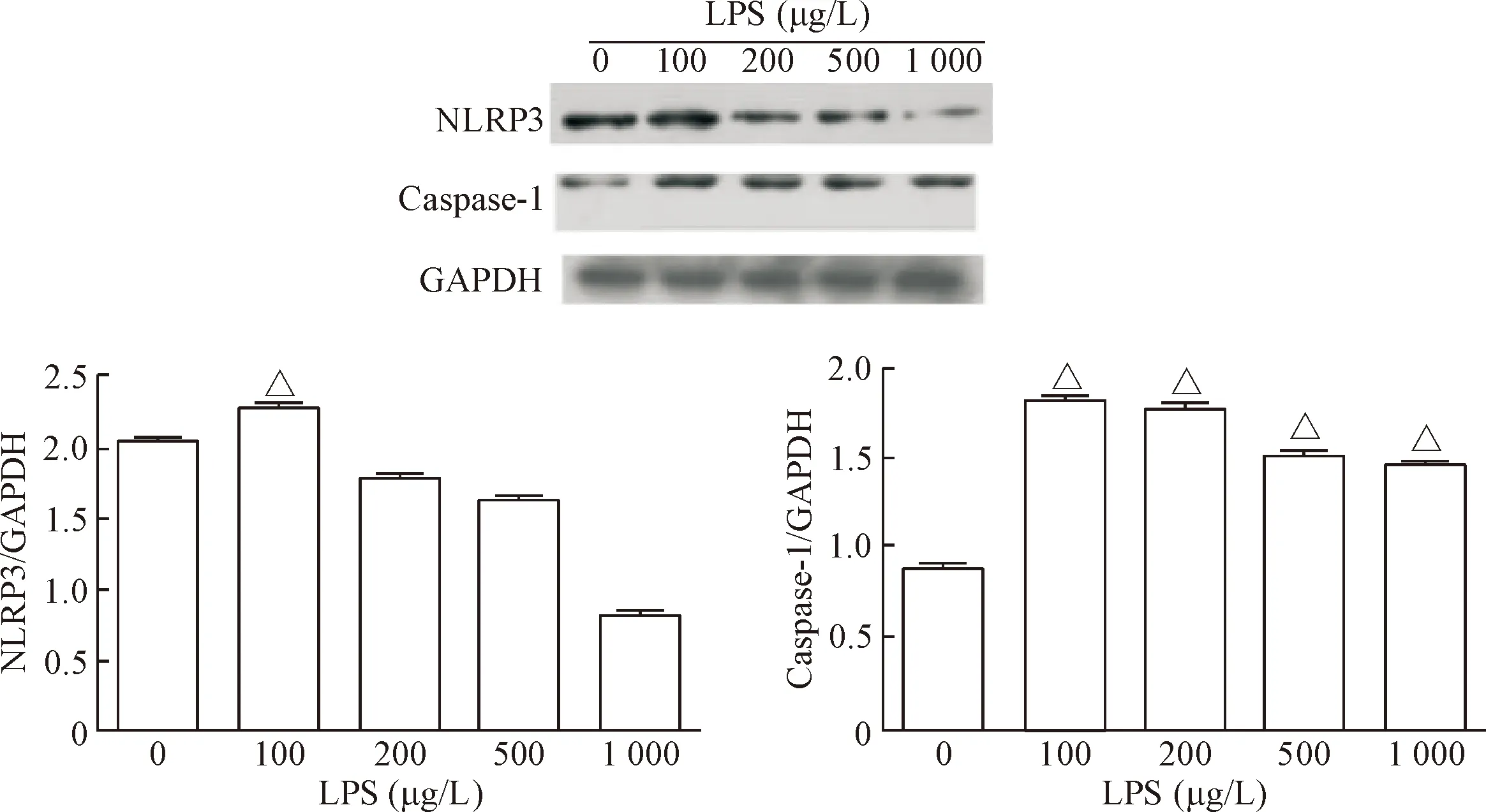
Figure 2. Western blot was used to determine the effect of LPS at different concentrations on the protein expression of NLRP3 and caspase-1 in L02 cells. Mean±SD.n=3.△P<0.05vs0 μg/L.
图2Westernblot检测不同浓度LPS对L02细胞NLRP3和caspase-1蛋白水平的影响
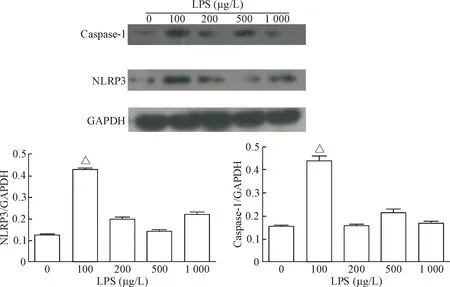
Figure 3. Western blot was used to determine the effect of LPS at different concentrations on the protein expression of NLRP3 and caspase-1 in SMMC-7721 cells. Mean±SD.n=3.△P<0.05vs0 μg/L
图3Westernblot检测不同浓度LPS对SMMC-7721细胞NLRP3和caspase-1蛋白水平的影响
3 外源性H2S对细胞中NLRP3炎症小体的影响
本实验用NaHS作为H2S的释放剂,Western blot结果显示,与对照相比,LPS组的NLRP3和caspase-1表达明显增高,而LPS+NaHS组中的NLRP3和caspase-1表达比LPS组明显降低(P<0.05),见图4、5。
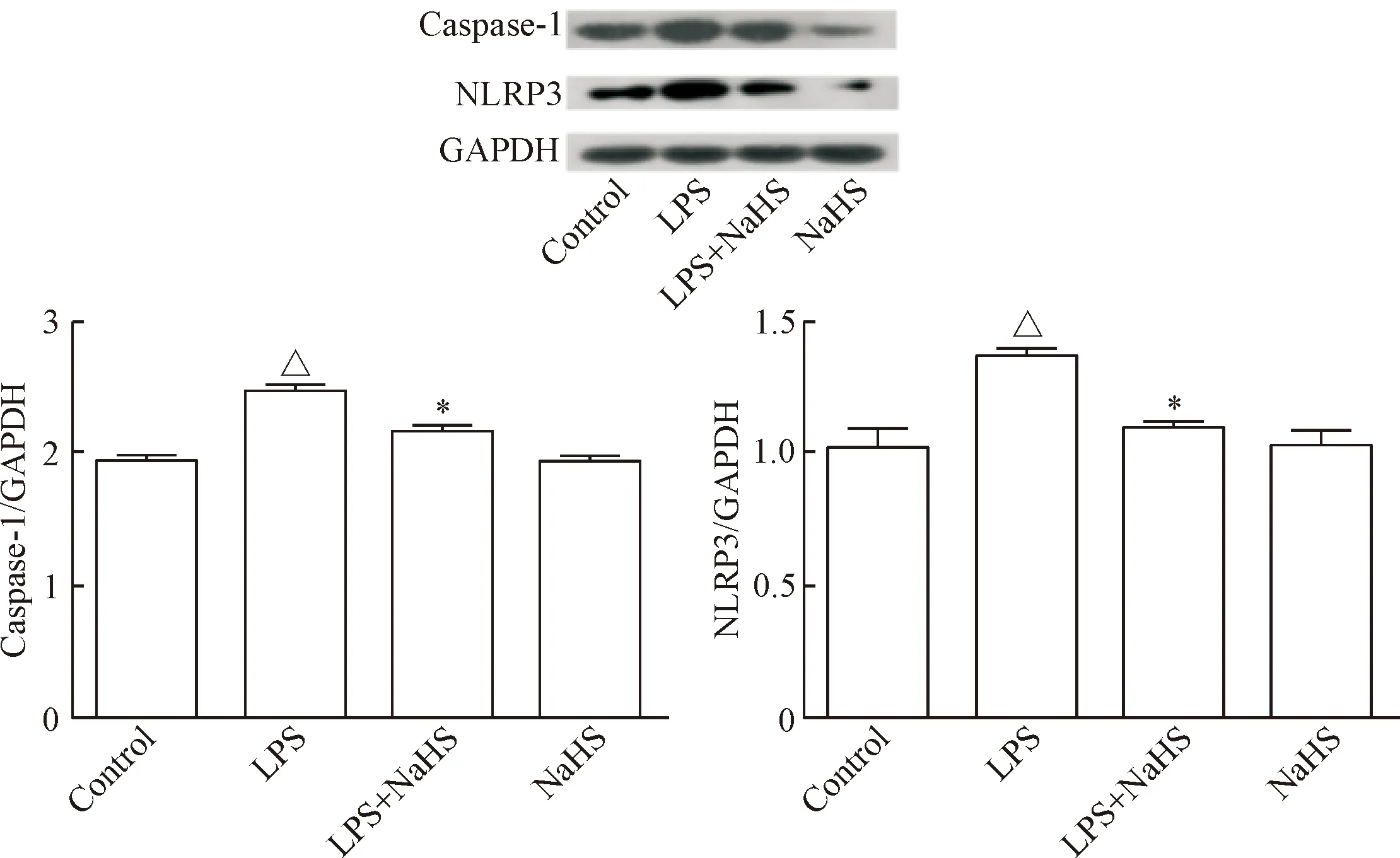
Figure 4. Western blot was used to determine the effect of exogenous H2S on the expression of NLRP3 inflammasome in SMMC-7721 cells. Mean±SD.n=3.△P<0.05vscontrol group;*P<0.05vsLPS group.
图4外源性H2S对SMMC-7721细胞中炎症小体NLRP3蛋白表达的影响

Figure 5. Western blot was used to determine the effect of exogenous H2S on the expression of NLRP3 inflammasome in L02 cells. Mean±SD.n=3.△P< 0.05vscontrol group;*P<0.05vsLPS group.
图5外源性H2S对L02细胞中炎症小体NLRP3表达的影响
讨 论
LPS是革兰氏阴性菌表达的内毒素,可识别Toll样受体4,激活炎症信号通路,上调NLRP3炎症小体的表达[6-7]。采用LPS刺激产生炎症是常见的建立炎症模型的方法,本文MTT结果显示低浓度的LPS可不明显地升高肝细胞活力,但高剂量的LPS会对细胞活力有显著抑制作用,综合Western blot结果确定后续实验所用LPS浓度为100 μg/L。
H2S是哺乳动物体内继一氧化氮和一氧化碳之后被发现的第3种气体信号分子,以前一直被认为是有毒气体,但近年来研究发现,H2S具有重要的抗炎作用。研究表明,给予外源性H2S可明显改善缺血引起的心肌炎症损伤,减少炎症介质的释放[8-9],外源性H2S还可抑制LPS诱导的大鼠原代心肌细胞炎症介质的产生[10],通过抗炎作用减轻缺血再灌注引起的胃黏膜细胞损伤[11]。虽然近年来有关H2S的研究很多,但在人肝细胞中,关于H2S与NLRP3炎症小体的研究还鲜见报道。近年来研究表明,NLRP3在肝炎过程中发挥重要作用,用半乳糖神经酰胺诱导野生型小鼠和NLRP3敲除小鼠建立炎症模型,结果显示在NLRP3敲除小鼠中,肝细胞中的IL-6 和TNF-α等炎症介质以及血浆中的丙氨酸转氨酶比野生小鼠显著减少[12],持续的乙型肝炎病毒感染可抑制肝细胞中NLRP3炎症小体的表达,加重肝脏损伤[13]。本文在L02细胞和SMMC-7721细胞炎症模型的基础上研究H2S对胞中NLRP3炎症小体的影响,结果显示给予外源性H2S后,细胞中炎症小体NLRP3和caspase-1表达均显著减弱,初步证明外源性H2S可抑制人肝细胞中LPS诱导的NLRP3炎症小体的表达,说明H2S具有作为抗炎药物的潜在价值,本实验是一系列研究的起始,H2S是否显著降低炎症小体NLRP3活化之后的下游产物水平?H2S是通过何种信号转导途径抑制炎症小体NLRP3表达的?这一系列问题还有待后续进一步研究,若上述问题被解决,有望为H2S相关药物的研发提供一定的理论基础。
[1] Elliott EI,Sutterwala FS. Initiation and perpetuation of NLRP3 inflammasome activation and assembly[J]. Immunol Rev, 2015, 265(1):35-52.
[2] Jo EK, Kim JK, Shin DM, et al. Molecular mechanisms regulating NLRP3 inflammasome activation[J].Cell Mol Immunol, 2016, 13(2):148-159.
[3] Kimura H. The physiological role of hydrogen sulfide and beyond[J]. Nitric Oxide, 2014, 41:4-10.
[4] 梁伟杰, 何洁仪, 张稳柱, 等. 硫化氢通过抑制坏死性凋亡对抗高糖引起的H9c2 心肌细胞损伤[J]. 中国病理生理杂志, 2016, 32(3):385-391.
[5] Wei X, Zhang B, Zhang Y, et al. Hydrogen sulfide inhalation improves neurological outcome via NF-κB-mediated inflammatory pathway in a rat model of cardiac arrest and resuscitation[J]. Cell Physiol Biochem, 2015, 36(4):1527-1538.
[6] Cullen SP, Kearney CJ, Clancy DM, et al. Diverse activators of the NLRP3 inflammasome promote IL-1β secretion by triggering necrosis[J]. Cell Rep, 2015, 11(10):1535-1548.
[7] Shi J, Zhao Y, Wang K, et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death[J]. Nature, 2015, 526(7575): 660-665.
[8] Sodha NR, Clements RT, Feng J, et al. Hydrogen sulfide therapy attenuates the inflammatory response in a porcine model of myocardial ischemia/reperfusion injury[J]. J Thorac Cardiovasc Surg, 2009, 138(4):977-984.
[9] Elrod JW, Calvert JW, Morrison J, et al. Hydrogen sulfide attenuates myocardial ischemia-reperfusion injury by preservation of mitochondrial function[J]. Proc Natl Acad Sci U S A, 2007, 104(39):15560-15565.
[10] Toldo S, Das A, Mezzaroma E, et al. Induction of microRNA-21 with exogenous hydrogen sulfide attenuates myocardial ischemic and inflammatory injury in mice[J]. Circ Cardiovasc Genet, 2014, 7(3):311-320.
[11] Guo C, Liang F, Shah Masood W, et al. Hydrogen sulfide protected gastric epithelial cell from ischemia/reperfusion injury by Keap1 s-sulfhydration, MAPK dependent anti-apoptosis and NF-κB dependent anti-inflammation pathway[J]. Eur J Pharmacol, 2014, 725:70-78.
[12] Kanbe A, Ito H, Omori Y, et al. The inhibition of NLRP3 signaling attenuates liver injury in an α-galactosylcera-mide-induced hepatitis model[J]. Biochem Biophys Res Commun, 2017, 490(2):364-370.
[13] Yu X, Lan P, Hou X, et al. HBV inhibits LPS-induced NLRP3 inflammasome activation and IL-1β production via suppressing the NF-κB pathway and ROS production[J]. J Hepatol, 2017, 66(4):693-702.
