芥子碱硫氰酸盐抑制IR小鼠血脂血糖升高、动脉粥样硬化及肝细胞脂肪变性*
2018-01-19黄涵柽张希洲刘可云黄德斌
黄涵柽, 张 祝, 张希洲△, 刘可云, 黄德斌
(1三峡大学人民医院, 宜昌市第一人民医院, 湖北 宜昌 443000; 2湖北民族学院医学院, 湖北 恩施 445000)
2型糖尿病合并高血压多为原发性多基因遗传病,近40%患者合并有高风险因素(high risk factor,HRF),如高血压、肥胖(obesity,OB)、血脂血糖(blood lipids and blood glucose,BL-BG)升高、动脉粥样硬化(atherosclerosis,AS)和肝细胞脂肪变性(he-patocellular steatosis,HCS)等,是当今世界高发病率和高死亡率的主要原因[1]。研究表明,脂代谢异常降低了组织细胞对胰岛素的敏感性,反馈性促进胰岛素分泌而导致长期高胰岛素血症[2],一方面促进蛋白非酶糖化产物滞集于血浆、组织和肾小球基膜,损伤血管和肾小球内皮与基膜;另一方面过度激活蛋白激酶C,加快血管紧张素转化酶(angiotensin-converting enzyme,ACE)和内皮素(endothelin,ET)的表达,促进血管收缩,导致血压升高,并通过血管平滑肌增殖、纤维黏连蛋白和胆固醇沉积而加速AS[3-4]。糖尿病一旦发生,其治疗就成为一个长期的医学问题。目前,临床上控制高血糖、高血脂、高血压和延缓AS的最佳措施是多药组合,但由于多药合用不良反应叠加的限制,治疗药物很难用于阻止 2 型糖尿病HRF的发展[5]。目前HRF状态下阻止其发展而不良反应少的有效药物尚属一空白。为探究相关药物,我们研究了莱菔子主要成分芥子碱硫氰酸钠(sinapine thiocyanate,ST)可有效阻止BL-BG升高、减弱胰岛素抵抗(insulin resistance,IR)、延缓AS和减轻HCS的相关机制。
材 料 和 方 法
1 药品、试剂与仪器
ST(纯度≥98%)购于上海远慕生物科技有限公司;高脂高糖饲料(基础饲料+15%猪油+20%蔗糖+1.2% 胆固醇+0.2%胆酸钠)购于北京博泰宏达生物技术有限公司;罗格列酮(rosiglitazone,RT)购于北京嘉林药业股份有限公司;抗3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-coenzyme A reductase, HMGR)、低密度脂蛋白受体(low-density lipoprotein receptor, LDLR)、脂肪酸合酶(fatty acid synthase, FAS)、硬脂酰辅酶A脱饱和酶1(stearoyl-coenzyme A desaturase 1, SCD-1)、肉碱棕榈酰转移酶1a(carnitine palmitoyltransferase 1a, CPT-1a)、酰基辅酶A氧化酶1(acyl-coenzyme A oxidase 1, ACOX-1)和固醇调节元件结合蛋白2(sterol regulatory element-binding protein 2, SREBP-2)抗体购于武汉艾美捷科技有限公司。
AU-2700自动生化分析仪(Olympus);ELx800酶标仪(BioTek); Axio Lab.A1显微镜(Carl Zeiss Jena);CM3050低温恒温器(Leica);ACCU-CHEK罗康血糖仪与血糖试纸(北京丰瑞祥合医疗器械有限公司);ABI 7300 RT-PCR系统和Trans-Blot Cell电转膜仪(Bio-Rad)。
2 方法
2.1动物分组 SPF级雄性8周龄ApoE-/-小鼠60只(18~20 g;北京维通利华实验动物技术有限公司提供,动物合格证编号为No.11400700189994),置于恒温(22±4) ℃光暗交替(12 h/12 h)环境中适应1周,后随机分成对照组(control group,CG)、生理盐水组(saline group,SG)、罗格列酮组(rosiglitazone group,RG)和ST治疗组,后者再分别分成ST低剂量组(ST-L)、中剂量组(ST-M)和高剂量组(ST-H),每组10只,每笼5只。在标准实验条件下,恒温(22±4) ℃,光暗交替(12 h/12 h)环境中每天自由进食和饮水。整个研究过程中,实验动物的护理与使用均在湖北民族学院医学实验动物管理委员会的指导下进行。
2.2动物饲养与给药 除CG小鼠给予常规饲料喂养外,其它所有动物均以高脂高糖饲料饲养12周制备动脉粥样硬化模型;同时,CG和SG小鼠分别每天以等体积生理盐水灌胃1次,RG小鼠每天以罗格列酮灌胃1次(1.33 mg/kg),ST各组小鼠每天分别以10 mg/kg、30 mg/kg和90 mg/kg ST灌胃1次[5]。所有药物均用生理盐水稀释成溶液或混悬液(每次体积为20 mL/kg)。
2.3IR模型的诱导[6]饲养至最后3周,CG小鼠每天腹腔注射等体积生理盐水,其它所有动物每天腹腔注射地塞米松 0.8 mg/kg,诱导小鼠IR模型。
2.4血样收集与标本采集 第12周结束时禁食12 h(不禁水),以10%水合氯醛(5 mL/kg)腹腔注射麻醉小鼠,心脏穿刺收集血液于EDTA试管中,离心15 min(4 ℃,3 000 r/min)分离血清,吸取血清分装冻存于-80 ℃冰箱。剪开肋骨,以1×PBS心脏灌注3 min(4 mL/min),分离出主动脉(去除脂肪与结缔组织)和肝脏,称量肝脏重量(liver weight,LW),计算肝脏系数(liver coefficient,LC),LC与空腹体重(fasting weight,FW)相关性计算公式如下[4]:LC(%)=LW/FW×100%。分别取升主动脉中段和肝右前叶上段以10%甲醛固定,石蜡包埋,HE染色,10倍镜下观察;另取一部分肝脏匀浆离心,分离出上清液置于-80 ℃冰箱冷冻保存。分离切取双侧股四头肌中段0.4 g,用于丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路相关蛋白表达水平的测定。
2.5体重、血糖及血脂代谢相关指标水平的测定 在饲养的12周中,每周的最后1 d 禁食12 h后,秤量FW并计算每天每只小鼠的饲料消耗量(feed consumption,FC),断尾采集血样检测空腹血糖(fasting plasma glucose,FPG)水平。第12周结束时用ELISA试剂盒和全自动生化仪检测FPG、空腹胰岛素(fasting insulin,FIns)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)及脂蛋白胆固醇等代谢相关指标的水平,并计算稳态模型评估的胰岛素抵抗指数(homeostatic model assessment of insulin resistance,HOMA-IR)[4]:HOMA-IR=FPG(mmol/L)×FIns(mU/L)/22.5。
2.6肝脂质(liver lipids,LL)的测量与组织学分析 取肝组织样品0.2 g,放入氯仿与甲醇的混合液(2∶1)中,溶于Triton X-100中,按上述步骤测量肝甘油三酯(liver triglyceride,L-TG)和肝总胆固醇(liver total cholesterol,L-TC)含量。将固定良好的肝样品进行石蜡包埋切片(5 μm),HE染色,10倍镜下观察摄片。
2.7肝脂质代谢与骨骼肌MAPK信号通路相关蛋白表达的测定 用Western blot法检测相关蛋白表达。取骨骼肌0.1 g,加入1 mL细胞裂解液后行SDS-PAGE、转膜,PVDF膜室温封闭,置于相应 I 抗中,摇动过夜(4 ℃)洗膜,置于 II 抗中(辣根过氧化物酶标记),室温反应2 h后用化学发光法检测。目的蛋白相对含量以目的蛋白与β-actin的比值表示。
3 统计学处理
所有实验数据采用SPSS 13.0软件处理,数据用均数±标准误(mean±SEM)表示。多组间数据比较采用单因素方差分析,多个样本间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 ST对各组小鼠FC、FW和FPG的影响
CG的FC呈现缓慢持续增长;第5周以前,RG的FC显著少于SG(P<0.05);第9周后,所有高脂饲料组的FC均呈快速增加,其中ST-H组显著高于ST-M组,ST-M组显著高于SG和ST-L(P<0.05),SG-L与RG间差异无统计学意义,见表1。饲养期间,CG的FW呈现缓慢持续增长;10周后,其它各组的FW呈现快速增长,均显著高于CG(P<0.05),其中ST各组呈现剂量依赖性慢于RG而快于CG(P<0.05),见表2。CG的FPG无显著升高,显著低于其它各组(P<0.05);饲养3周后,所有高脂饲料组的FPG呈现缓慢持续升高;10周以后,所有高脂饲料组的FPG呈现快速升高,其中,ST各组呈现剂量依赖性低于SG而高于RG(P<0.05),见表3。
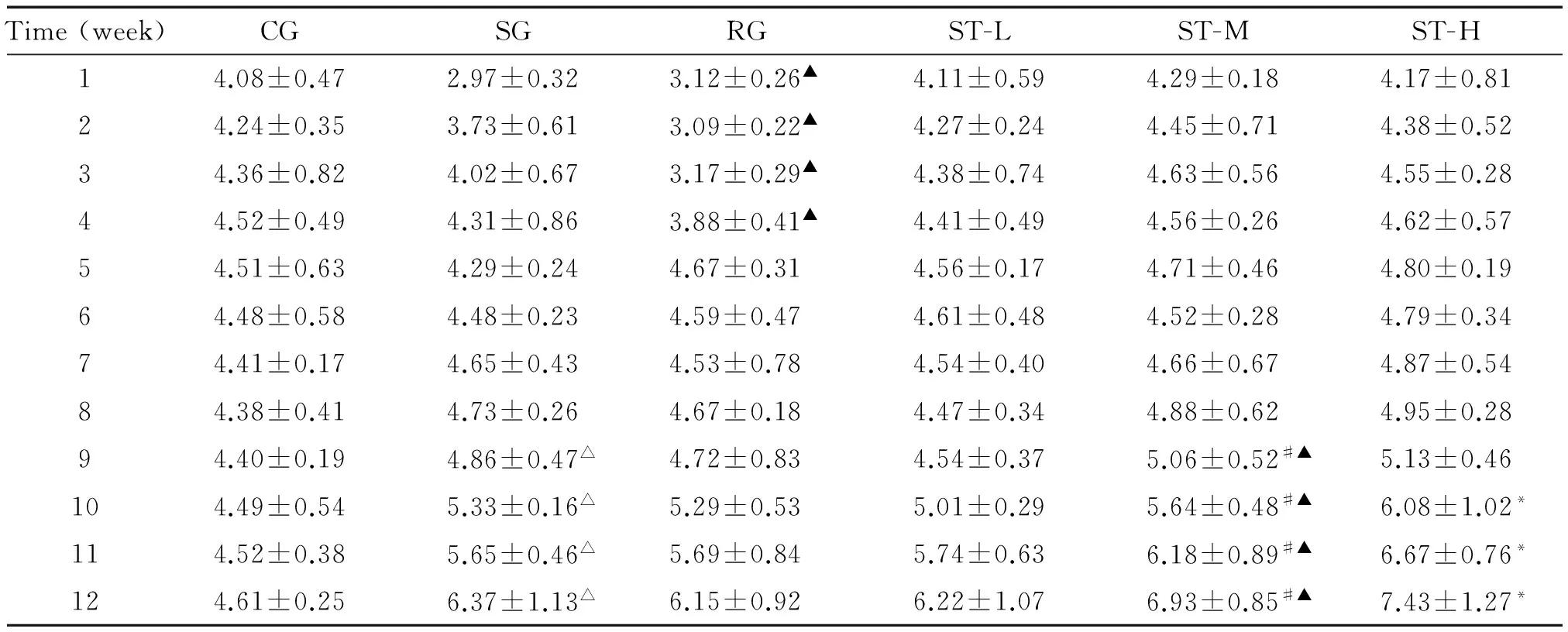
表1 ST对各组小鼠FC的影响
*P<0.05vsST-M;#P<0.05vsST-L;△P<0.05vsCG;▲P<0.05vsSG.
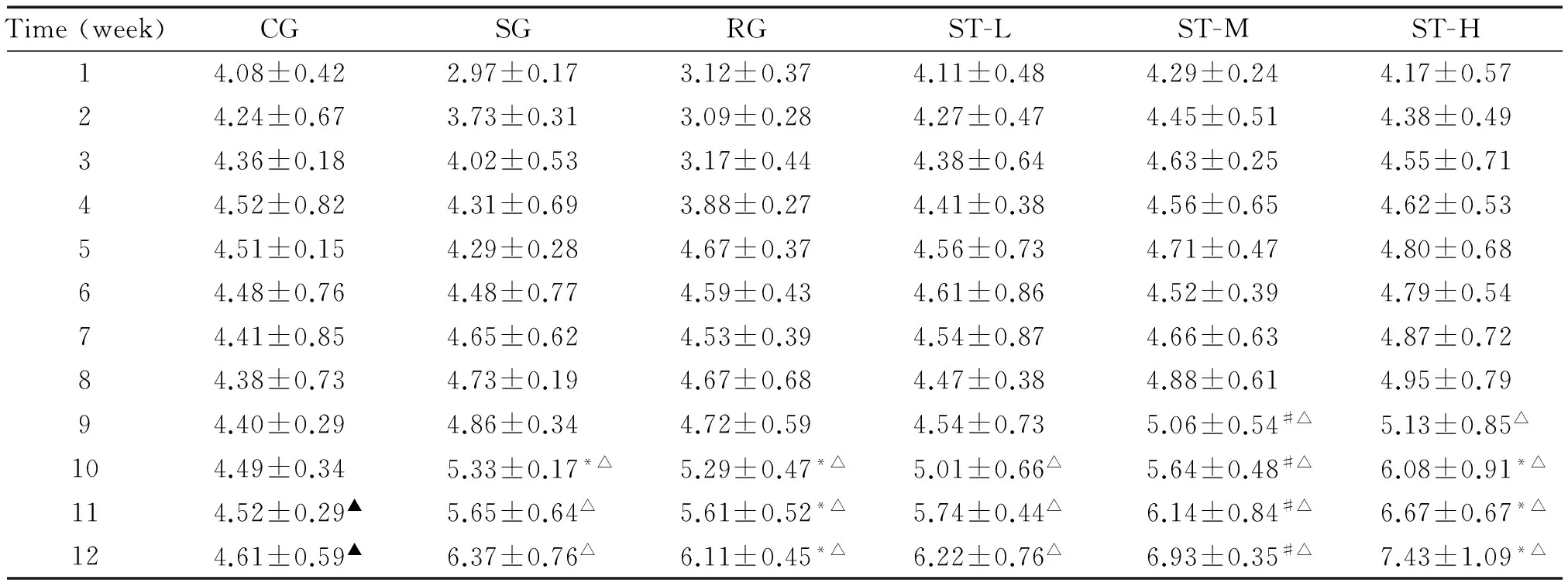
表2 ST对各组小鼠FW的影响
*P<0.05vsST-M;#P<0.05vsST-L;△P<0.05vsCG;▲P<0.05vsSG.
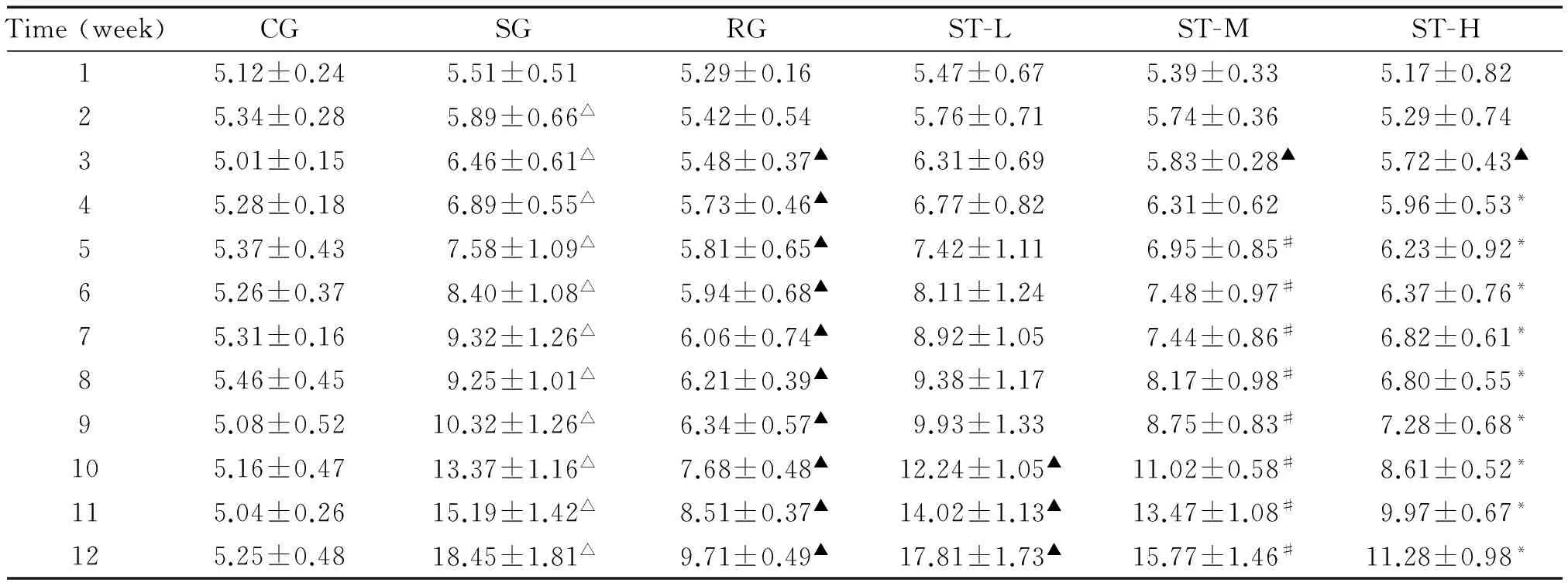
表3 ST对各组小鼠FPG的影响
*P<0.05vsST-M;#P<0.05vsST-L;△P<0.05vsCG;▲P<0.05vsSG.
2 ST对各组小鼠血脂、血糖及胰岛素的影响
第12周处死动物后,血脂检测结果显示,高脂饲料各组小鼠的血脂水平明显升高,其中ST-H组与CG的血脂各项指标差异无统计学意义,SG和RG的高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)显著低于CG、ST-M组和ST-H组(P<0.05),ST呈剂量依赖性延缓血脂水平的升高,增加HDL-C,见表4。第12周处死动物后,FPG和FIns检测及HOMA-IR的计算结果显示,CG各项指标显著低于SG(P<0.05),表明IR模型复制成功;ST各组呈剂量依赖性降低FPG、FIns和HOMA-IR,但显著弱于RG(P<0.05),见表5。
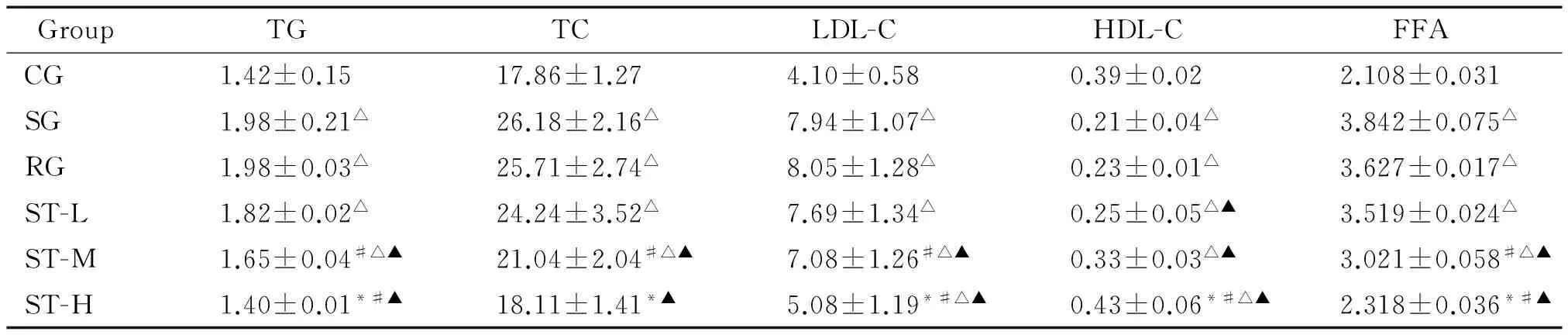
表4 ST对各组小鼠血脂的影响
*P<0.05vsST-M;#P<0.05vsST-L;△P<0.05vsCG;▲P<0.05vsSG.
表5ST对各组小鼠血糖和胰岛素的影响
Table 5. The effect of ST on FPG and FIns in the mice of each group (Mean±SEM.n=10)
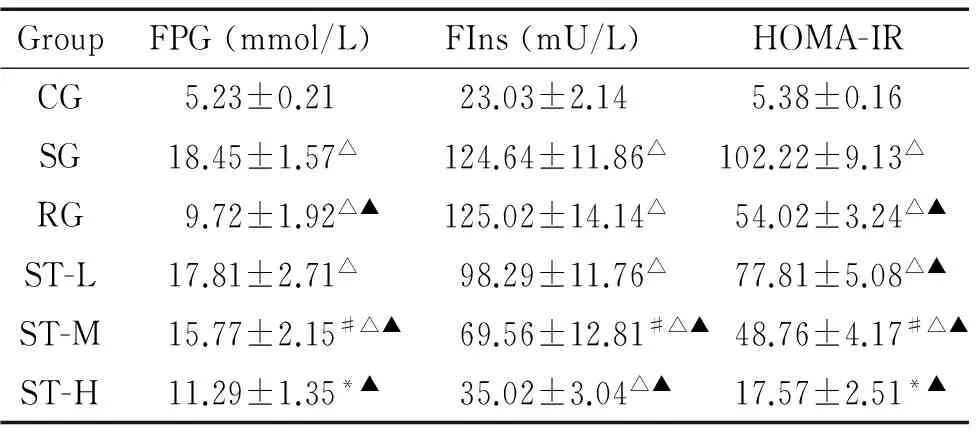
GroupFPG(mmol/L)FIns(mU/L)HOMA-IRCG5.23±0.2123.03±2.145.38±0.16SG18.45±1.57△124.64±11.86△102.22±9.13△RG9.72±1.92△▲125.02±14.14△54.02±3.24△▲ST-L17.81±2.71△98.29±11.76△77.81±5.08△▲ST-M15.77±2.15#△▲69.56±12.81#△▲48.76±4.17#△▲ST-H11.29±1.35*▲35.02±3.04△▲17.57±2.51*▲
*P<0.05vsST-M;#P<0.05vsST-L;△P<0.05vsCG;▲P<0.05vsSG.
3 ST对各组小鼠LW、LC、LL、TNF-α与肝组织学的影响
第12周处死动物后,结果显示,ST-H的肝脏相关指标与CG相当,显著低于SG和RG(P<0.05),ST呈剂量依赖性减轻LW和降低LC,减少T-TG和L-TC(P<0.05),表明高脂饲料促进了脂肪肝的形成,ST抑制脂肪肝的形成;结果还显示,高脂饲料各组TNF-α显著高于CG(P<0.05),表明高脂饲料可能导致肝功能损伤;ST呈现剂量依赖性降低TNF-α(P<0.05),见表6。
肝脏大体观察可见,CG组的肝脏外观红褐色,表面光滑,边缘锐利,质软,弹性良好,切面无明显油腻感;SG和RG的肝脏呈土黄色,包膜紧张,边缘圆钝,明显肿大,质硬,弹性差,切面油腻感明显;ST各组呈剂量依赖性明显优于SG和RG。肝脏病理学观察发现,光镜下CG的肝小叶结构正常,肝细胞形态正常,大小均一,肝索排列整齐;SG和RG的肝小叶变形,肝索排列紊乱,肝细胞形态变形,大小不均匀,中央静脉周围大量肝细胞气球样大小泡混合型HCS,炎性细胞浸润显著,凋亡肝细胞多;ST-M组的肝小叶少有变形,肝索排列尚可,肝细胞形态偶有变形,大小基本均匀,中央静脉周围小泡型HCS,少见炎性细胞浸润和肝细胞凋亡;ST-H组未见明显HCS,未见炎性细胞浸润和肝细胞凋亡,与CG组相当,见图1。
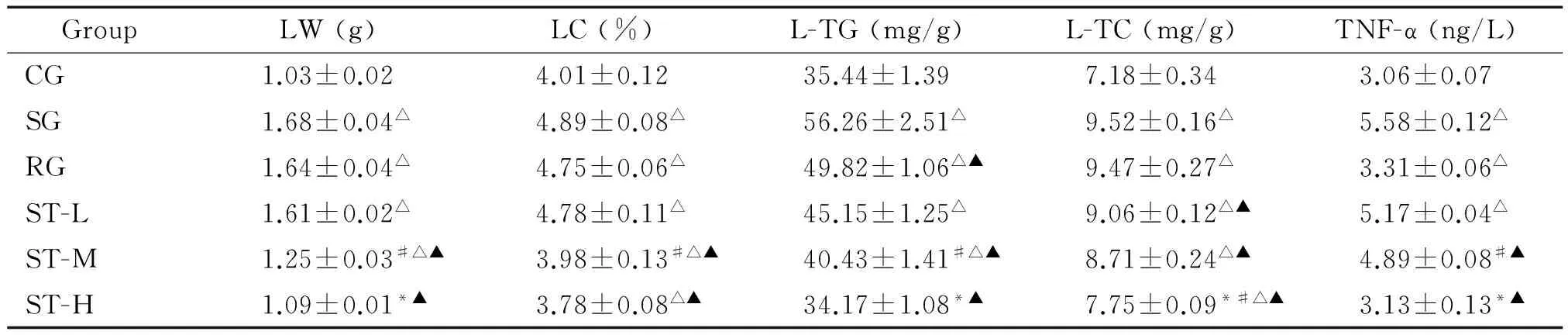
表6 ST对各组小鼠LW、LC、LL及TNF-α的影响
*P<0.05vsST-M;#P<0.05vsST-L;△P<0.05vsCG;▲P<0.05vsSG.
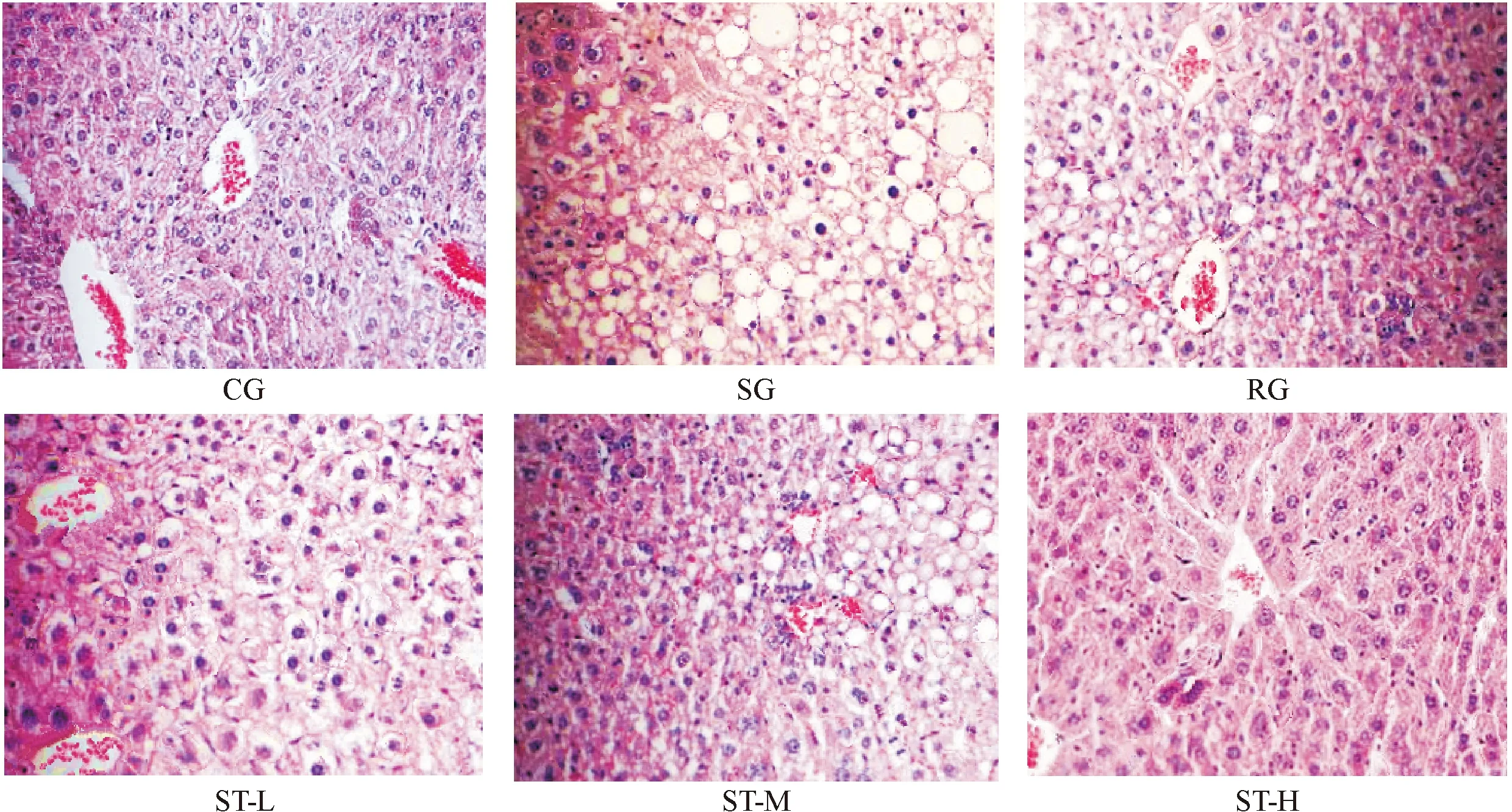
Figure 1. The effect of ST on HCS in the mice of each group (HE staining, ×200).
图1ST对各组小鼠HCS的影响
4 ST对各组小鼠AS的影响
镜下可见,CG小鼠的主动脉管壁未见脂质斑块,SG管壁明显增厚毛糙,管腔变形变窄,僵硬,典型的AS已经形成;RG与ST-L组相当,均有大量泡沫细胞和脂质斑块,管壁有增厚,管腔稍变形变窄,AS病变趋于形成;ST-M组的主动脉内膜下出现堆积的泡沫细胞和脂质斑块,表现为早期AS病变;ST-H组的主动脉内膜有少量泡沫细胞和少许脂质斑块,早期AS趋于形成,见图2。
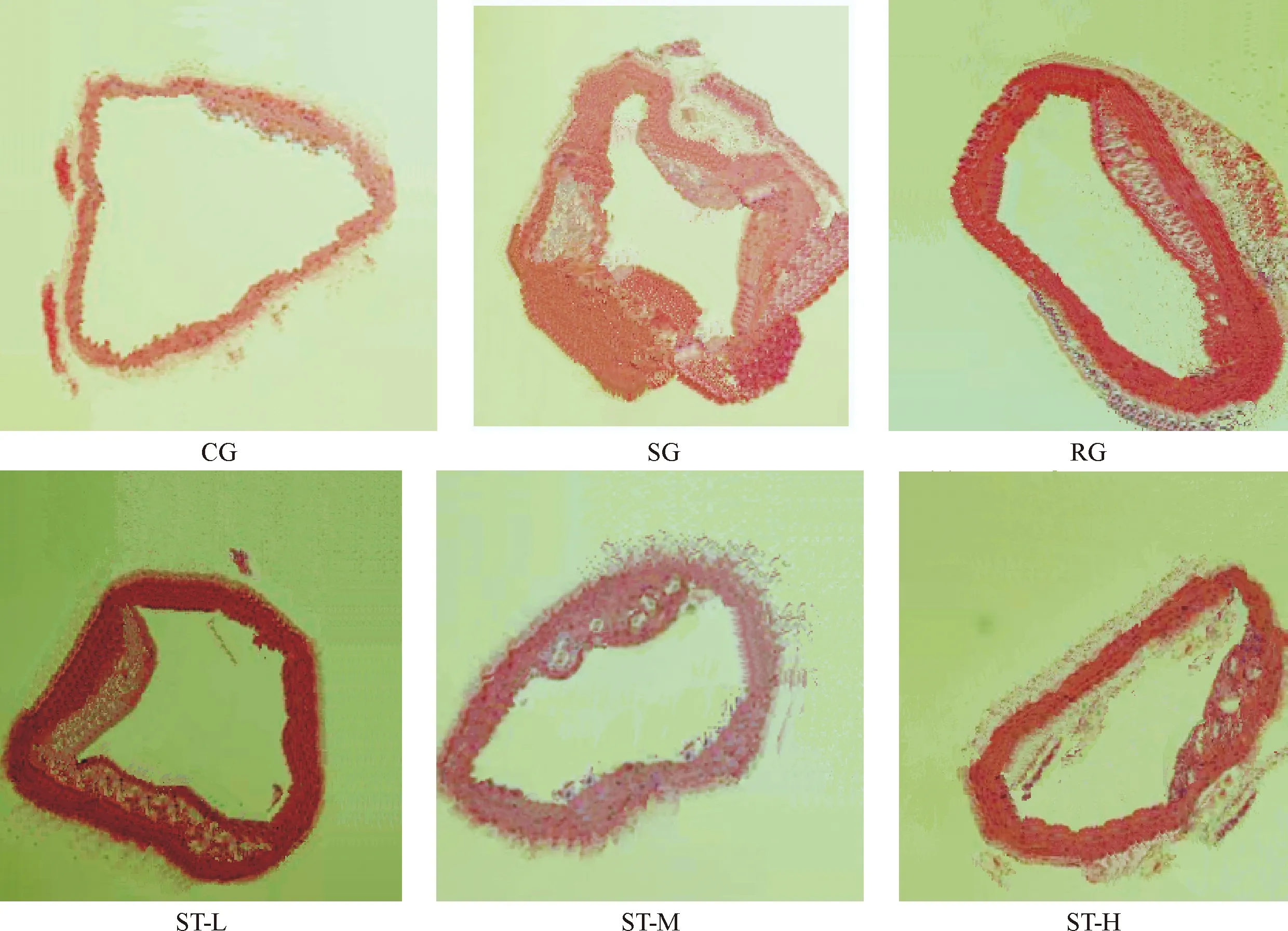
Figure 2. The effect of ST on AS in the mice of each group (HE staining, ×10).
图2ST对各组小鼠AS的影响
5 ST对各组小鼠肝脂质代谢相关蛋白表达的影响
第12周处死动物后,检测结果显示SG和RG的HMGR、FAS和CPT-1a蛋白表达均显著高于CG组,而SCD-1则低于CG(P<0.05),ACOX-1和SREBP-2的水平与CG相当(P>0.05);ST呈现剂量依赖性抑制HMGR、FAS和CPT-1a蛋白的表达,而增强LDLR、SCD-1、ACOX-1和SREBP-2蛋白的表达(P<0.05),见图3A。
6 ST对各组小鼠骨骼肌MAPK信号通路的影响
第12周处死动物后,Western blot检测结果显示,JNK蛋白的表达水平各组间比较差异无统计学显著性;SG的ERK蛋白表达与ST-L组和ST-M组相当(P>0.05),显著低于CG、RG和ST-H组(P<0.05);SG的p-ERK、p38、p-p38和p-JNK蛋白水平显著高于CG、RG和ST-H组,显示出ST 呈剂量依赖性地降低相关蛋白水平(P<0.05),见图3B。
讨 论
目前,对于糖尿病与肥胖合并HRF的最佳防治措施是多药组合,由于受到多药组合不良反应叠加的限制,治疗药物一般很难用于高血压和糖尿病的HRF预防[5]。ApoE-/-小鼠具有脂质代谢紊乱和IR遗传背景,高脂饲养和糖皮质激素可稳定诱导其脂质代谢紊乱和IR[6]。为探究高血压、糖尿病HRF的不良反应少的防治性药物,我们研究证实,莱菔子主要成分ST能显著减缓高脂饲料喂养ApoE-/-小鼠体重增加、BL-BG升高,延缓AS与IR进程,并能抑制脂肪肝形成和肝细胞凋亡。
根据本研究结果,我们认为其作用机制为:一方面,ST通过抑制TNF-α的产生,减轻肝细胞的损伤,延缓AS和HCS进程。研究证实,OB与肝内脂质异常代谢和骨骼肌脂质转运酶异常表达密切相关[7]。有报道表明,钩藤总碱与ST配伍能调控TNF-α导致的血管内皮细胞变化[5]。肝细胞是维持和调控脂质代谢的主要场所,肝细胞受损可影响脂质代谢和调控,形成病理性肥胖状态[3,7]。另有报道,慢性低度炎症与OB诱发的IR类似,器官长期低度炎症而减弱器官对胰岛素的敏感性,形成IR[4, 7]。由于脂肪细胞可分泌较多炎性因子TNF-α,活化胰岛素靶细胞炎性通路JNK和IKKβ等,激活下游AP-1和NF-κB而促进TNF-α和IL-6 表达,加重慢性低度炎症,促进血管内皮细胞和肝细胞的损伤[8]。本研究发现,在第12周,高脂饲料各组的TNF-α显著高于CG,ST呈现剂量依赖性降低TNF-α,表明高脂饲料可导致血管内皮细胞和肝细胞周围长期慢性低度炎症而受损,ST能抑制TNF-α的产生,保护血管内皮细胞和肝细胞,维持其正常代谢,延缓AS和HCS进程。
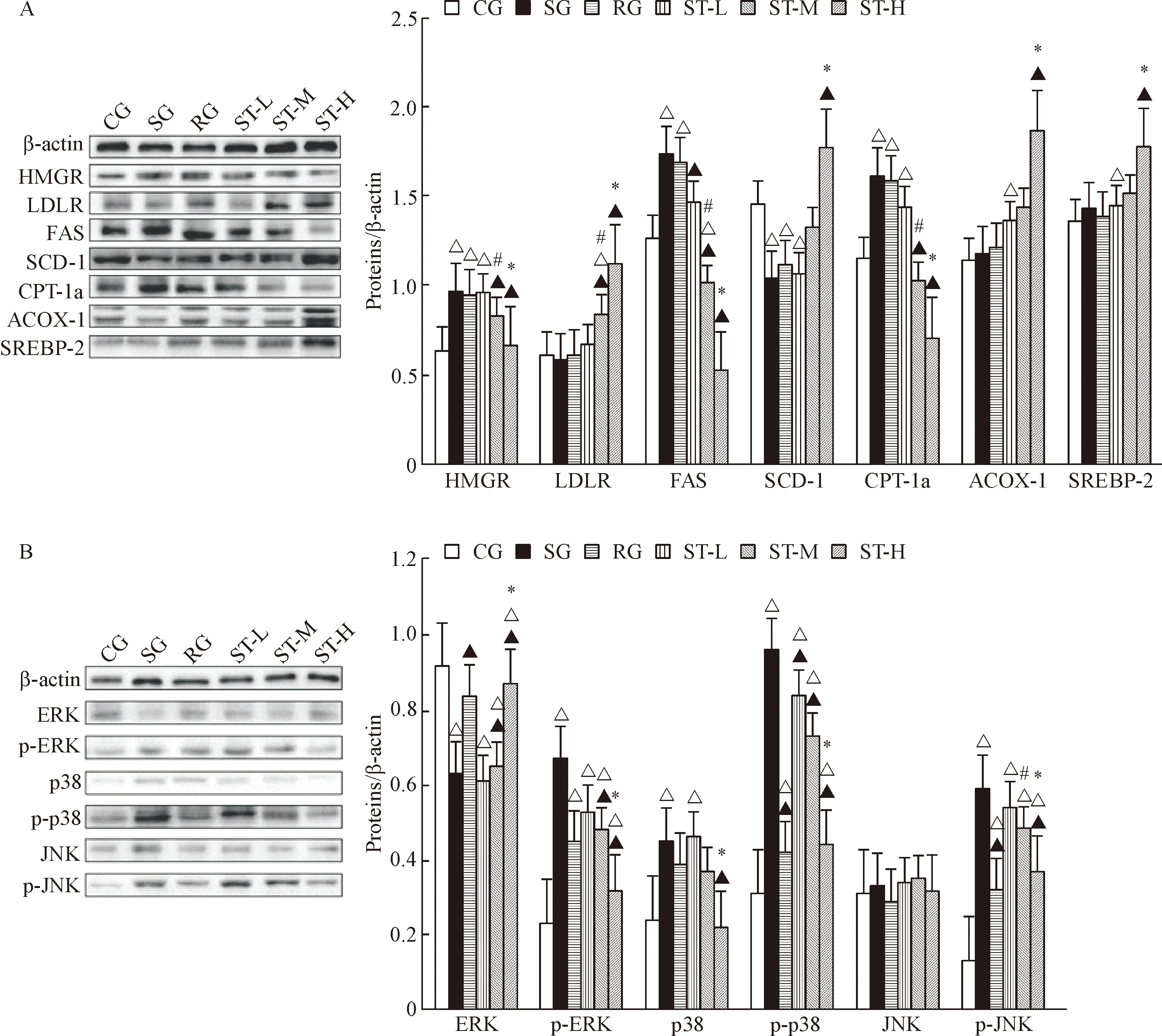
Figure 3. The representitive images of Western blot for determining the protein levels of lipid metabolism-related proteins in the liver (A) and the signaling pathway of MAPK-related molecules in the skeletal muscle (B). Mean±SEM.n=10.*P<0.05vsST-M;#P<0.05vsST-T;△P<0.05vsCG;▲P<0.05vsSG.
图3肝脂质代谢相关蛋白和骨骼肌MAPK信号通路相关蛋白检测的Westernblot结果
另一方面,ST通过调控肝细胞相关信号通路蛋白表达,维持其正常脂质代谢,从而削弱HRF。HMGR是肝细胞合成胆固醇的关键限速酶,抑制HMGR可上调肝细胞膜LDLR而加快胆固醇(cholesterol,Ch)的摄取,降低血Ch,使VLDL生成减少和促进VLDL残粒(难转化成VLDL)或β-VLDL异化而降低血LDL[8]。Fas是结合死亡受体TNFRSF6/Fas的细胞凋亡分子,介导T细胞毒性[9]。肝内T细胞活化可诱导Fas和FasL表达,触发靶细胞程序性凋亡[7]。同时,活化的相邻T淋巴细胞Fas与FasL也可彼此杀伤[8]。SCD-1是脂肪细胞分泌的瘦素信号靶基因,能使硬脂酰辅酶A与棕榈酰辅酶A去饱和,维持体重,减少进食和加快能量消耗[8]。高脂饮食可下调SCD-1表达,降低肝细胞FFA去饱和力而沉积[9]。油酰辅酶A(SCD-1产物)可促进肝细胞神经酰胺合成,增加脂肪沉积和升高肝重指数[9]。CPT-1是脂肪酸-氧化限速酶,若表达上调,脂肪酸氧化减慢,血糖降低,HCS减轻[10]。酰基辅酶A氧化酶是脂肪细胞内与脂肪酸的氧化有关的起始酶,可降低TC,延缓OB、IR和HCS进程[5,9]。肝细胞内质网的SREBP-2是细胞TC代谢转录调节物,当Ch缺乏时,SREBP-2激活,干扰TC外源性吸收,增加TC逆转运和内源性TC转化为胆汁酸,而降低血TC[10]。本研究证实,SG和RG的FAS、SCD-1和CPT-1a蛋白表达均显著强于CG,而HMGR低于CG;ST呈剂量依赖性增加HMGR、ACOX-1和SREBP-2蛋白表达而抑制LDLR、FAS、SCD-1和CPT-1a蛋白表达(P<0.05)。提示ST以上述多信号路径的调控形式维持正常肝脂质代谢,减缓HRF的发生。
此外,ST还通过调控骨骼肌MAPK信号通路相关蛋白表达,阻止IR进程。IR和OB与骨骼肌胰岛素抵抗密切相关[2],骨骼肌是代谢能量物质(糖、脂等)的重要场所,可处置70%~90%葡萄糖,与血脂、血糖、IR、AS及HCS密切相关[7, 11]。MAPK在胰岛素信号转导中具有重要作用,其级联反应激活酶有ERK、JNK及p38[11]。其中ERK是表面受体传导信号给细胞核的关键路径,可由生长因子激活,并介导NF-κB、AP-1、c-Fos和c-Jun转录,调控细胞增殖、分化和凋亡等,JNK和p38可由游离脂肪酸激活而参与应激反应和炎性反应[9,12]。有研究证实,2型糖尿病患者脂肪细胞p-p38、p-ERK及p-JNK的蛋白水平均高于正常人[13]。本研究提示,高脂饲料喂养小鼠骨骼肌MAPK信号通路调控与CG的差异存在统计学显著性。SG的p-ERK、p38、p-p38和p-JNK蛋白水平显著高于CG、RG和ST-H组,显示出ST呈剂量依赖性抑制其磷酸化,提示ST调控骨骼肌IR的机制是在抑制p38磷酸化,降低游离脂肪酸对骨骼肌刺激。
总之,十字花科植物萝卜(RaphanussativusL.)种子莱菔子主要成分之一的ST具有来源广、成本低、不良反应很少的特点。大量研究表明ST有降血压作用,本研究进一步证实其具有预防性阻止血脂血糖升高、延缓IR、AS和HCS等作用,其机制与调控肝脂质代谢和骨骼肌MAPK信号通路相关蛋白表达有关。提示ST在糖尿病、高血压的前期亚健康状态时HRF(BL-BG、IR、AS和HCS)预防性治疗方面显示出良好的应用前景。
[1] 杨楚枫, 杨 洋, 张 玥, 等. 豆茶决明对高脂诱导C57BL/6J小鼠肥胖和胰岛素抵抗的影响[J]. 中国实验方剂学杂志, 2015, 21(10):141-144.
[2] 孙 婧, 刘素娟, 牛燕媚, 等. Wnt信号通路在有氧运动改善高脂饮食诱导 C57BL/6小鼠胰岛素抵抗中的作用[J]. 中国运动医学杂志, 2015, 34(3):219-222.
[3] 王 杏, 王 超, 宋光耀, 等. 氧化苦参碱对高脂诱导胰岛素抵抗ApoE-/-小鼠肝脏脂代谢相关基因的影响[J]. 中国药理学通报, 2015, 31(12):1688-1692.
[4] 王 超, 张会欣, 邢邯英, 等. 氧化苦参碱改善高脂诱导ApoE-/-小鼠的胰岛素抵抗[J]. 中国病理生理杂志, 2016, 32(11):2010-2014.
[5] 董婧婧, 刘艳菊, 涂济源, 等. 三七粉调血脂作用及机制研究[J]. 中草药, 2017, 48(8):1597-1601.
[6] 黄国钧, 黄勤挽. 医药实验动物模型—制作与应用[M]. 第1版. 北京:化学工业出版社, 2008:536-537.
[7] 金 鑫, 张会欣, 张彦芬, 等.津力达对高脂诱导的胰岛素抵抗ApoE-/-骨骼肌甘油三酯相关酶的影响[J].中国实验动物学报, 2015, 23(1):69-74.
[8] 金 鑫, 张会欣, 崔雯雯, 等. 津力达对高脂诱导的胰岛素抵抗ApoE-/-小鼠MAPK信号通路的影响[J]. 中国新药杂志, 2015, 24(14):1648-1653.
[9] 汤世国, 李 伶, 杨刚毅, 等. 高脂诱导胰岛素抵抗apoE-/-小鼠HMGCR、SREBP-2和LDLr基因表达的变化[J]. 中国糖尿病杂志, 2012, 20(4):292-296.
[10] 刘丽荣, 李 霜, 王圆圆, 等. 氧化苦参碱抑制高糖诱导的大鼠肾小管上皮-间充质转化及其机制研究[J].中国病理生理杂志, 2013, 29(12):2152-2159.
[11] 宓 伟, 练 武, 尹淑英, 等. 山楂原花青素及维生素C对胰岛素抵抗大鼠肝脏氧化应激的影响[J].中草药, 2016, 47(4):625-630.
[12] Kwak MK, Ha H. Where are we now in diabetic research[J]. Arch Pharm Res, 2013, 36(2):142-144.
[13] Pedersen BK, Febbraio MA. Muscles, exercise and obesity: skeletal muscle as a secretory organ[J]. Nat Rev Endocrinol, 2012, 8(8):457-465.
