干旱胁迫下黄腐酸钾对烤烟幼苗保水渗透调节能力的影响
2018-01-19宋文静赵永长王程栋禚其翠邱春丽董建新
宋文静,赵永长,2,况 帅,王程栋,禚其翠,2,解 燕,邱春丽,董建新*
(1.中国农业科学院烟草研究所,农业部烟草生物学与加工重点实验室,中国农业科学院青岛烟草资源与环境野外科学观测试验站,青岛 266101;2.中国农业科学院研究生院,北京 100081;3.云南省烟草公司曲靖市公司,云南 曲靖 655000)
干旱逆境下,植物体内水分状况会发生改变,表现为组织含水量下降,各种生理代谢活动紊乱[1]。植物为了维持体内水分平衡及生理代谢正常进行,通过积累可溶性糖、脯氨酸及可溶性蛋白等渗透调节物质来降低细胞水势,使细胞继续吸水。因此,渗透调节物质的积累对植物适应逆境胁迫有着重要的意义[2]。相关研究表明[3],干旱胁迫下,植株体内脯氨酸和可溶性糖含量显著增加[4-5]。TAJI等[6]报道,干旱胁迫下渗透调节物质的积累与植物抗旱性显著相关。此外,可溶性蛋白是植物体代谢过程中表征蛋白质损伤的重要指标,其含量变化可反映细胞内蛋白质合成/降解等信息,对渗透调节也有一定贡献[7]。刘锦春等[8]研究表明,干旱胁迫抑制蛋白质合成促进其分解,从而使蛋白质含量减少;也有研究表明[9],干旱胁迫会导致植物体内可溶性蛋白含量升高。大量研究表明,在干旱条件下,植物内源渗透调节物质与植物抗逆性相关[10]。但在干旱胁迫下,外源喷施黄腐酸钾对烤烟幼苗保水渗透调节能力和渗透调节物质的响应机制的报道较少。因此,本研究以抗旱性不同的两个烤烟品种为试材,利用控制条件水培试验,研究干旱胁迫下叶面喷施黄腐酸钾对烤烟幼苗体内水分状况及渗透调节物质的影响,以探讨黄腐酸钾提高烤烟抗旱性与渗透调节之间的关系,为烤烟逆境生长提供理论基础。
1 材料与方法
1.1 供试材料
抗旱性强烤烟品种红花大金元和弱抗旱性烤烟品种云烟100分别由国家烟草种质资源中期库和玉溪中烟种子有限责任公司提供。
1.2 研究地点与方法
1.2.1 试验地点 中国农业科学院烟草研究所青岛试验基地温室。
1.2.2 培养方法 当烤烟幼苗4叶1心时,选取长势均一幼苗,移栽于1/4 Hoagland营养液(pH 5.5)的塑料箱(7 L)水培处理,不同处理如下:(1)常规对照(CK),叶面喷施蒸馏水;(2)叶面喷施黄腐酸钾(FA-K);(3)干旱胁迫+叶面喷施蒸馏水(PEG);(4)干旱胁迫+叶面喷施黄腐酸钾(P+FA-K)。以浓度为5.00%的PEG-6000模拟干旱胁迫,黄腐酸钾浓度为0.1%。每2天于傍晚17:00—18:00喷施1次。分别于处理0、1、3、5、7、9 d时取幼苗完全展开叶作为试验材料。
1.3 测定项目与方法
1.3.1 水分含量的测定 采用快速称重法[11]。取生长点下第3片完全展开功能叶,称其质量(m1),然后浸泡于4℃蒸馏水中,黑暗下放置5 h,取出,擦干叶片表面水分后,称其质量(m2)。随后,将此叶片转入4℃ 65%蔗糖溶液中,黑暗处放置5 h后,取出叶片,用蒸馏水洗净,擦干,立即称其质量(m3)。最后将叶片置于75℃下烘至恒量,称其质量(m4)。

1.3.2 叶片水势的测定 取各处理植株生长点以下第3片完全展开功能叶,利用HR-33T-R型露点微伏压计结合专配的C-52样品室快速测定该叶片的水势(MPa)。
1.3.3 渗透调节物质含量的测定 可溶性糖含量采用蒽酮比色法测定,可溶性蛋白含量采用考马斯亮蓝G-250法测定,脯氨酸含量采用酸性茚三酮法测定[12]。
1.4 数据分析
试验数据采用SAS 8.0进行统计分析。
2 结果
2.1 干旱胁迫下外源黄腐酸钾对烤烟幼苗叶片水分的影响
2.1.1 对相对含水量的影响 由表1可知,未经干旱胁迫条件下,施黄腐酸钾处理(FA-K)的两品种叶片相对含水量和水分饱和亏与对照相比无显著差异。PEG干旱胁迫下,两品种叶片相对含水量显著降低,而水分饱和亏显著升高。与PEG处理相比,干旱胁迫下施黄腐酸钾处理(P+FA-K)使两品种叶片相对含水量升高,水分饱和亏降低,但对抗旱性强烤烟品种红花大金元的影响不显著。可见,干旱胁迫下,增施黄腐酸钾可以在一定程度上增强叶片保水能力,提高抗旱性弱烤烟品种的叶片水分含量,减轻胁迫对植株生长造成的伤害。
2.1.2 对自由水和束缚水含量的影响 由表1可知,未经干旱胁迫条件下,施黄腐酸钾处理(FA-K)的两品种叶片自由水和束缚水含量与对照相比没有显著差异,叶片总含水量差异也不显著。PEG干旱胁迫下,红花大金元叶片中自由水含量和总含水量较对照分别降低18.66%和7.67%,云烟100相应降低23.26%和12.16%,而两品种叶片中束缚水含量却升高,增幅分别为11.91%(红花大金元)和13.82%(云烟100)。这表明在干旱胁迫下,云烟100叶片比红花大金元叶片更容易失水。干旱胁迫下,黄腐酸钾处理(P+FA-K)的两品种叶片自由水和总含水量与单一PEG处理相比显著增加,其中红花大金元叶片自由水和总含水量增加9.02%和4.07%,云烟100相应增加24.32%和11.61%,这表明施黄腐酸钾可以减缓胁迫下烤烟幼苗叶片含水量的下降,尤其对云烟100减缓效果更好。此外,干旱胁迫还明显提高了两品种叶片的束缚水含量/自由水含量,而在P+FA-K处理下,该比值则显著降低。
2.1.3 对水势的影响 由表1可知,未经干旱胁迫条件下,施黄腐酸钾处理(FA-K)后云烟100叶片水势与对照相比显著上升,而红花大金元叶片水势则无显著变化。干旱胁迫下,两品种叶片水势与对照相比均显著下降,降幅分别为81.63%(红花大金元)和97.95%(云烟100)。与PEG处理相比,干旱胁迫下黄腐酸钾处理(P+FA-K)的烤烟叶片水势均显著上升,增幅分别为6.74%(红花大金元)和13.78%(云烟100),说明黄腐酸钾可以在一定程度上促进胁迫下烤烟幼苗细胞吸水,改善体内水分状况,使植株维持较高的叶水势。就试验所用的两个烤烟品种而言,干旱胁迫下,云烟100叶片水势降幅大于红花大金元,而施黄腐酸钾处理后,云烟100叶片水势的增幅要大于红花大金元,这表明云烟100的叶片比红花大金元更容易失水,而黄腐酸钾对减缓干旱胁迫下叶片失水的效果则云烟100优于红花大金元。

表1 干旱胁迫下黄腐酸钾对烤烟幼苗叶片水分状况的影响Table 1 Effect of fulvic acid potassium on water status in leaves of flue-cured tobacco seedlings under drought stress
2.2 干旱胁迫下黄腐酸钾对烤烟幼苗叶片可溶性糖含量的影响
由图1可知,在整个处理期间,对照组两品种烤烟幼苗叶片中可溶性糖含量随时间推移呈上升趋势,但变化幅度不大。未经干旱胁迫条件下,施黄腐酸钾(FA-K)后,两品种叶片中可溶性糖含量仅在处理第5天时显著高于对照,其余时间与对照相比无显著差异。干旱胁迫下,两品种烤烟幼苗叶片中可溶性糖含量与对照相比显著增加,且随处理时间延长呈现先上升后缓慢下降的变化趋势,在处理第5天时达到最大值,随后又有所下降,峰值处红花大金元和云烟100叶片中可溶性糖含量较对照分别增加了78.87%和67.58%。与单一PEG处理相比,干旱胁迫下黄腐酸钾处理(P+FA-K)进一步提高了两品种叶片中可溶性糖含量,在胁迫处理第9天时,分别增加了51.52%(红花大金元)和61.54%(云烟100),且在整个处理过程中云烟100的增幅均大于红花大金元。
2.3 干旱胁迫下黄腐酸钾对烤烟幼苗叶片可溶性蛋白含量的影响
由图2可知,未经干旱胁迫条件下,喷施黄腐酸钾处理(FA-K),红花大金元叶片中可溶性蛋白含量在整个处理期间虽高于对照,但无显著差异;云烟100叶片中可溶性蛋白含量在处理第5天时,显著高于对照,其余时间与对照相比无显著差异。干旱胁迫下,两品种叶片中可溶性蛋白含量变化明显不同,在胁迫0~3 d内,两品种叶片中可溶性蛋白含量与对照和单一PEG处理相比均升高,且云烟100叶片中可溶性蛋白含量的增幅高于红花大金元;随胁迫处理时间的延长,红花大金元叶片中可溶性蛋白含量继续升高,且在胁迫处理第7天时达峰值,然后有所下降,而云烟100叶片中可溶性蛋白含量却持续下降,在胁迫处理第5、7和9天时较同期对照分别降低了24.31%、47.09%和53.52%。与PEG处理相比,胁迫下黄腐酸钾处理(P+FA-K)显著提高了两品种叶片中可溶性蛋白含量,且云烟100叶片中可溶性蛋白含量的增幅大于红花大金元,这表明黄腐酸钾可促进胁迫下蛋白质的合成或积累,减缓其降解,且对云烟100的作用效果要好于红花大金元。

图1 干旱胁迫下黄腐酸钾对烤烟幼苗叶片中可溶性糖的影响Fig.1 Effects of fulvic acid potassium on soluble sugar in leaves of flue-cured tobacco seedlings under drought stress
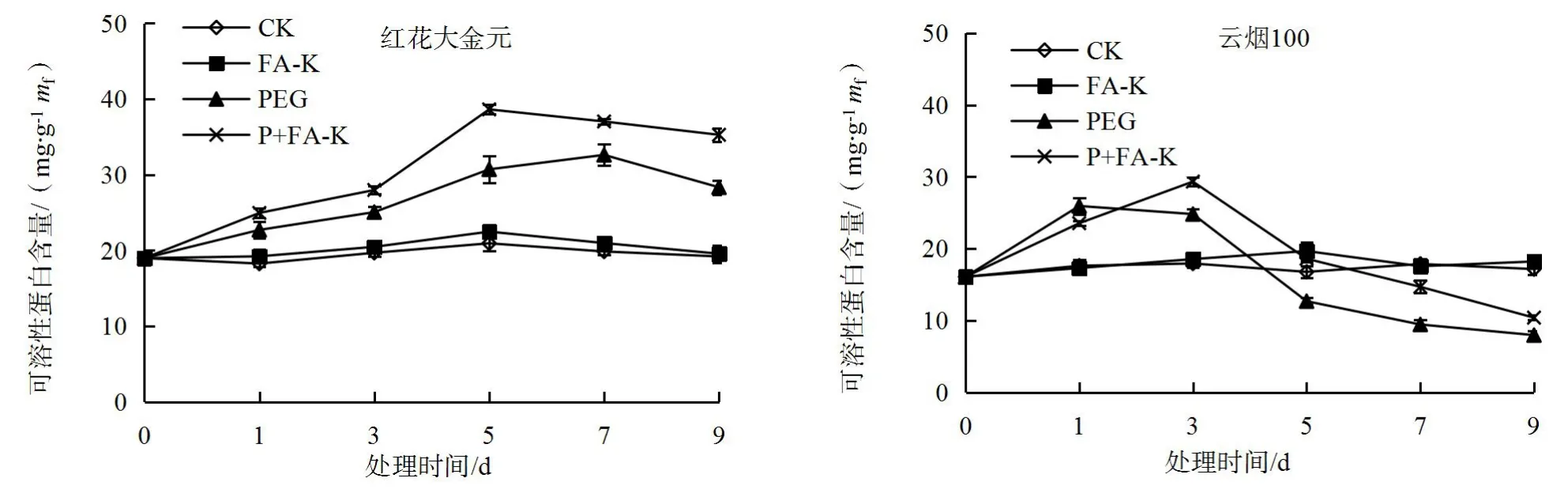
图2 干旱胁迫下黄腐酸钾对烤烟幼苗叶片中可溶性蛋白的影响Fig 2 Effects of fulvic acid potassium on soluble protein in leaves of flue-cured tobacco seedlings under drought stress
2.4 干旱胁迫下黄腐酸钾对烤烟幼苗叶片脯氨酸含量的影响
由图3可知,干旱胁迫下,随着时间的推移,不同烤烟品种叶片内脯氨酸呈逐渐上升的趋势,且显著高于对照;处理9 d时,两品种叶片中脯氨酸含量较对照分别提高了332.15%(红花大金元)和257.20%(云烟100)。与PEG处理相比,胁迫下黄腐酸钾处理(P+FA-K)进一步提高了两品种叶片中脯氨酸含量,在处理7 d后,两品种叶片中脯氨酸含量变化不同,红花大金元叶片中脯氨酸含量仍持续上升,而云烟100叶片中脯氨酸含量则趋于稳定;在胁迫处理后期,红花大金元叶片脯氨酸含量增幅小于云烟100,说明在胁迫后期,黄腐酸钾对云烟100受干旱胁迫伤害的减缓效果好于红花大金元。

图3 干旱胁迫下黄腐酸钾对烤烟幼苗叶片中脯氨酸含量的影响Fig.3 Effects of fulvic acid potassium on proline contents in leaves of flue-cured tobacco seedlings under drought stress
3 讨论
干旱逆境下,植物组织失水,叶片相对含水量(RWC)、自由水含量及水势均显著降低,而束缚水含量升高[13]。本研究中,干旱胁迫下,烤烟幼苗叶片的RWC、总含水量及水势均明显降低,经黄腐酸钾处理后减缓了叶片水分含量及水势的下降,表明黄腐酸钾可以有效改善干旱胁迫下烤烟植株的水分状况,增强其抗旱性。就两个烤烟品种而言,与云烟100相比,干旱胁迫下红花大金元仍保持较高的叶水势,表明红花大金元受干旱胁迫的程度较轻,这与尉庆丰等[14]“干旱条件下保持较高水势是植物抗旱的一个重要机制”的结论相吻合;干旱胁迫下,红花大金元叶片的RWC高于云烟100,说明红花大金元的保水能力较云烟100强,这可能与体内渗透调节物质积累的程度有关。
渗透调节是植物适应逆境环境的自我调节生理机能。研究报道,干旱胁迫下,植物体内可溶性糖及脯氨酸等渗透调节物质大量积累,且积累量与抗旱性正相关[15-17]。本研究表明,干旱胁迫下,不同烤烟品种幼苗叶片中可溶性糖和脯氨酸含量在体内大量积累,用于自身调节以适应水分亏缺;但随着胁迫时间延长,脯氨酸含量持续升高,而可溶性糖含量较前期有所下降,这表明长时间的干旱胁迫导致可溶性糖的积累小于其降解,因而其含量相应降低。干旱胁迫条件下外源施用黄腐酸钾能促进胁迫下可溶性糖及脯氨酸的合成或积累,加速渗透调节过程,缓解胁迫伤害,这与前人在马铃薯[4]、小麦[18]等作物上的研究结果一致。
可溶性蛋白含量在一定程度上可反映植物的整体代谢水平[19]。研究表明[20-23],干旱逆境下,可溶性蛋白含量逐渐升高或者先升高后降低。本研究中,干旱胁迫下,两品种烤烟幼苗叶片中可溶性蛋白含量在胁迫前期均显著高于对照,但随胁迫时间延长,云烟100叶片中可溶性蛋白含量逐渐低于对照,红花大金元叶片中可溶性蛋白含量仍持续走高,在处理第9天时含量虽有所下降但仍高于对照,这说明可溶性蛋白在烤烟体内的积累与植物品种及胁迫时间有关。黄腐酸钾可促进胁迫下蛋白质的合成或减缓其降解,从而使蛋白质含量保持较高水平。
4 结论
干旱胁迫降低了烤烟植株体内水分含量及叶片水势,诱导了脯氨酸和可溶性糖的积累。黄腐酸钾处理可以有效提高脯氨酸、可溶性蛋白及可溶性糖的含量,减缓叶片含水量及水势的下降,通过增强渗透调节系统来缓解胁迫伤害,增强其抗旱性。与云烟100相比,干旱胁迫下红花大金元受干旱胁迫的程度较轻,耐旱能力更强。
[1]高辉,张红芳,袁思安,等.植物内源激素对干旱胁迫的响应研究[J].绿色科技,2013(11):5-7.
[2]刘球,吴际友,李志辉.干旱胁迫对植物叶片解剖结构影响研究进展[J].湖南林业科技,2015,42(3):101-104.
[3]牛志强,刘国顺,师婷婷,等.烟草NCED3基因的克隆及其干旱胁迫表达分析[J].中国烟草学报,2015,21(3):100-106.
[4]邱孟柯,回振龙,黄晓鹏,等.黄腐酸对雾培马铃薯幼苗抗旱性的影响[J].干旱地区农业研究,2013,31(3):155-161.
[5]任磊,赵夏陆,许靖,等.4种茶菊对干旱胁迫的形态和生理响应[J].生态学报,2015,35(15):5131-5139.
[6]TAJI T,OHSUMI C,IUCHI S,et al.Important roles of drought-and cold-inducible genes for galactinol synthase in stress tolerance in Arabidopsis thaliana[J].Plant Journal,2002,29(4):417-426.
[7]盛业龙,王莎莎,许美玲,等.24个烤烟品种田间抗旱性的比较筛选与综合评价[J].热带作物学报,2014,35(12):2340-2348.
[8]刘锦春,钟章成,何跃军.干旱胁迫及复水对喀斯特地区柏木幼苗活性氧清除系统的影响[J].应用生态学报,2011,22(11):2836-2840.
[9]王智真.24-表油菜素内酯对葡萄幼苗缓解水分胁迫的生理效应[D].杨凌:西北农林科技大学,2015.
[10]张彩凤,王慧,潘虹,等.低温胁迫下叶面喷施腐植酸钾对红掌生理生化指标的影响[J].山西农业科学,2015,43(2):167-171.
[11]侯福林.植物生理学实验教程[M].北京:科学出版社,2004.
[12]高俊凤.植物生理学实验技术[M].西安:世界图书出版公司,2000.
[13]赵翔,李娜,王棚涛,等.脱落酸调节植物抵御水分胁迫的机制研究[J].生命科学,2011,23(1):115-120.
[14]尉庆丰,张英利.旱地农业中综合保水技术的抗旱增产效应[J].土壤通报,1995,26(3):108-110.
[15]周莉娜,孙丽蓉,毛晖,等.黄腐酸抗旱营养剂对小麦和玉米生长的影响[J].干旱地区农业研究,2012,30(1):154-158.
[16]AHMED I M,DAI H X,ZHENG W T,et al.Genotypic differences in physiological characteristics in the tolerance to drought and salinity combined stress between Tibetan wild and cultivated barley[J].Plant Physiology&Biochemistry,2013,63:49-60.
[17]CAMPOS H,TREJO C,PEÑA-VALDIVIA C B,et al.Stomatal and non-stomatal limitations of bell pepper(Capsicum annuumL.)plants under water stress and re-watering:Delayed restoration of photosynthesis during recovery[J].Environmental and Experimental Botany,2014,98:56-64.
[18]薛测产.黄腐酸抗旱龙不同处理对冬小麦抗逆性影响的研究[J].腐植酸,2005(5):35-38.
[19]DUAN J,ZHANG M,ZHANG H,et al.OsMIOX,a myo-inositol oxygenase gene,improves drought tolerance through scavenging of reactive oxygen species in rice(Oryza sativaL.)[J].Plant science,2012,196:143-151.
[20]FAHAD S,HUSSAIN S,MATLOOB A,etal.Phytohormones and plant response to salinity stress:areview[J].PlantGrowth Regulation,2015,75(2):391-404.
[21]GOMES F P,OLIVA M A,MIELKE M S,et al.Osmotic adjustment,proline accumulation and cell membrane stability in leaves of Cocos nucifera submitted to drought stress[J].Scientia hortic-ulturae,2010,126(3):379-384.
[22]杜长霞,李娟,郭世荣,等.外源亚精胺对盐胁迫下黄瓜幼苗生长和可溶性蛋白表达的影响[J].西北植物学报,2007,27(6):1179-1184.
[23]白建芬,裴玉贺,赵秋霞,等.干旱胁迫下玉米幼苗几种生理生化指标的变化[J].山东农业科学,2012(3):25-28.
