异甲·特丁净乳油在花生和土壤中的残留动态及安全性评价
2018-01-19刘同金李瑞娟宋国春于建垒门兴元李丽莉
刘同金,李瑞娟,宋国春,于建垒,门兴元,李丽莉
(山东省农业科学院植物保护研究所/山东省植物病毒学重点实验室,山东济南 250100)
异丙甲草胺(Metolachlor),化学名称:2-乙基-6-甲基-N-(1′-甲基-2′-甲氧乙基)氯代乙酰替苯胺,属于氯代酰胺类除草剂,CAS号是51218-45-2,对一年生禾本科杂草具有高效的杀灭作用,是目前常用的选择性芽前除草剂,能够有效地防除花生、玉米、大豆、棉花等旱田作物中的杂草,对人、畜低毒[1-3]。特丁净(Terbutryn),化学名称:2-甲硫基-4-乙氨基-6-特丁氨基-1,3,5-三嗪,CAS号是886-50-0,具有内吸性传导作用,属选择性芽前和芽后除草剂,可用于花生、冬小麦、大麦、大豆、马铃薯等作物田,防除多年生黑麦草、繁缕、马唐、看麦娘、狗尾草等[4]。50%异甲·特丁净乳油由异丙甲草胺(33%)和特丁净(17%)复配而成,提高了防效,扩大了杀草谱,对花生田马唐、牛筋草一年生禾本科杂草以及反枝苋、马齿苋等一年生阔叶杂草均有很好的防效[5]。目前,有关异丙甲草胺、特丁净的残留检测方法及其在作物上的残留研究较少。汪文娟等[6]采用了SP-501型气相色谱仪电子捕获检测器测定异丙甲草胺在花生和土壤中的残留;田宏哲等[7]、Andrade等[8]采用Agilent 7890B气相色谱仪电子捕获检测器研究了异丙甲草胺等除草剂在瓜果类蔬菜中的残留。而有关50%异甲·特丁净在花生中的残留趋势及安全性评价的研究鲜见报道。
花生(ArachishypogaeaLinn.)是我国重要的经济作物、食用油源和蛋白质源,是净出口农产品和食品工业的理想原料,种植区域广阔。山东是我国主要花生生产区之一,占全国种植面积的20%。花生田杂草发生种类繁多,危害严重,严重影响了花生的产量和品质[9]。笔者通过山东省、浙江省、湖南省2年的残留试验,采用Agilent 7890A 气相色谱仪进行检测分析,研究了50%异甲·特丁净乳油在花生和土壤中的消解动态和最终残留,旨在为异甲·特丁净在花生上安全、合理使用提供理论依据。
1 材料与方法
1.1材料
1.1.1药剂与试剂。50%异甲·特丁净乳油、异丙甲草胺标准品(98.0%)、特丁净标准品(97%)、甲醇(色谱纯)、乙腈(色谱纯)、无水硫酸钠(AR)、石油醚(AR)、正己烷(AR)、氯化钠(AR)。
1.1.2主要仪器。Agilent 7890A气相色谱仪,ECD检测器;LC-20AT液相色谱仪,紫外吸收检测器;旋转蒸发仪(IKA)、超声波清洗仪、小型粉碎机、250 mL分液漏斗、250 mL平底烧瓶,电子天平、精密移液枪以及其他实验室常用仪器设备。
1.2田间试验方法参照农业部农药检定所的《农药残留试验准则》[10]和《农药登记残留田间试验标准操作规程》[11],于2016—2017年在山东省、浙江省、湖南省三地进行50%异甲·特丁净乳油的消解动态和最终残留试验。
1.2.1消解动态试验。
1.2.1.1花生消解动态试验。选择未施用过异丙甲草胺和特丁净的花生田划区,小区面积30 m2,顺序排列,3次重复。50%异甲·特丁净乳油3 375 g a.i./hm2,在花生播种后出苗前,土表喷雾1次。花生出苗后(2片真叶)开始第1次取样,以后每间隔5 d取样1次,共取5次。在试验小区随机多点采集不少于1 kg的生长正常、无病害的花生茎叶,去根、切碎,并于不锈钢盆中混匀,四分法缩分,分取250 g样品,装入样本容器中,粘好标签,立即放于-20 ℃冰箱中保存,待测[12]。
1.2.1.2土壤消解动态试验。在花生田选一块30 m2的地块,单独施药,施药剂量为3 375 g a.i./hm2。用药液为600 kg/hm2,喷施1次。于施药后2 h及1、3、5、7、14、21、30、45、60 d随机取点5~10个,采用土钻采集0~10 cm的土壤1~2 kg,在不锈钢盆中除去碎石、杂草和植物根茎等杂物,捣碎混匀,取500 g装入样本容器中,粘好标签,放于-20 ℃冰箱中保存,待测[13]。
1.2.2最终残留量试验。选择未施用过异丙甲草胺和特丁净的花生田划区,设2个施药剂量,即低剂量2 250 g a.i./hm2和高剂量3 375 g a.i./hm2,在花生播种后出苗前,土表喷雾1次。小区面积30 m2,顺序排列,重复3次,收获期分别采集花生及土壤样品,另设空白对照,处理间设保护带。
于收获期,每小区10点取样,取花生1 kg、花生秧500 g,花生植株样品切碎,花生壳、花生仁粉碎,分别装入样本容器中,粘好标签,放于-20 ℃冰箱中保存,待测。土壤采用土钻采集0~15 cm 的土壤1 kg,在不锈钢盆中混匀,除去砂粒、石块、草根等杂物,装入样本容器中,粘好标签,放于-20 ℃冰箱中保存,待测[14]。
1.3分析方法
1.3.1样品提取与净化。
1.3.1.1异丙甲草胺的提取与净化。
(1)异丙甲草胺在花生植株、花生壳和土壤中的提取与净化方法。称取粉碎的花生植株(壳或土壤)10.0 g于锥形瓶中,加入60 mL石油醚,超声提取15 min,重复3次,经无水硫酸钠过滤,合并滤液相至平底烧瓶中,在45 ℃下浓缩至近干,用石油醚定容至10 mL,待测[15]。
(2)异丙甲草胺在花生仁中的提取与净化方法。称取粉碎的花生仁5.0 g,加入40 mL正己烷饱和的乙腈浸泡过夜,次日超声波提取15 min,过滤于分液漏斗中,加入20 mL乙腈饱和的正己烷,液-液分配,取下层乙腈相于平底烧瓶中,再向分液漏斗中加20 mL正己烷饱和的乙腈,液-液分配,取下层乙腈相,合并乙腈相,浓缩至干,用石油醚定容至5 mL,待测[16]。
1.3.1.2特丁净的提取与净化。
(1)特丁净在花生植株和花生壳中的提取与净化方法。称取粉碎的植株(壳)10.0 g于锥形瓶中,加入60 mL二氯甲烷,超声波提取15 min,重复3次,过滤至平底烧瓶中,减压浓缩至干,用30 mL乙腈分4次洗平底烧瓶,转移至50 mL分液漏斗中,加入10 mL石油醚,液-液分配,重复2次,取下层乙腈相至平底烧瓶中,减压浓缩至近干,吹干,用甲醇定容至5 mL,过0.45 μm微孔滤膜,待测[17]。
(2)特丁净在花生仁中的提取与净化方法。称取10.0 g粉碎的花生仁,加入10 mL水和50 mL乙腈,超声波提取20 min,过滤至装有7 g氯化钠的100 mL具塞量筒中,剧烈振荡2 min,静置20 min,取25 mL上层乙腈相至250 mL分液漏斗中,加入10 mL石油醚,液-液分配,取下层乙腈相至平底烧瓶中,浓缩至近干,用甲醇定容至5 mL,过0.45 μm微孔滤膜,待测。
(3)特丁净在土中的提取和净化方法。称取10.0 g土壤样品,加入60 mL二氯甲烷,超声波提取15 min, 重复3次,过滤至平底烧瓶中,减压浓缩至近干,吹干,用甲醇定容至10 mL,过0.45 μm微孔滤膜,待测[18]。
1.3.2仪器条件。
1.3.2.1异丙甲草胺气相色谱条件。Agilent 7890A 气相色谱仪;检测器:ECD;色谱柱:KB-5(30 m×320 μm×0.33 μm);检测温度:花生植株、花生仁、土柱温为170 ℃;花生壳柱温为165 ℃;进样口温度260 ℃;检测器温度300 ℃; 载气(高纯氮气):1.5 mL/min,不分流;进样量:1 μL。
1.3.2.2特丁净液相色谱条件。LC-20AT液相色谱仪;检测器:带SPD-20A紫外吸收检测器,n=228 nm;柱温:室温;进样量:20 L;色谱柱:VP-ODS C18(250.0 mm×4.6 mm)不锈钢柱;流动相:花生植株、壳为乙腈∶水=50∶50;花生仁为乙腈∶水=70∶30;土壤为乙腈∶水=80∶20;流速:1 mL/min。
2 结果与分析
2.1方法学考察
2.1.1异丙甲草胺标准曲线。用异丙甲草胺标准品配制5个不同浓度的样品,在上述条件下绘制标准曲线,异丙甲草胺进样量在5×10-11~1×10-9g,有良好的线性关系,直线回归方程为:y=19 252x+472.26,R2=0.999 3,其中y为峰面积响应值,x为进样量(ng)。这说明在一定浓度范围内异丙甲草胺的峰面积和进样量有良好的线性关系(图1)。

图1 异丙甲草胺标准曲线Fig.1 The standard curve of metolachlor
2.1.2特丁净标准曲线。用特丁净标准品配5个不同浓度的样品,在“1.3.2”条件下绘制标准曲线,特丁净进样量在1×10-10~2×10-8g,有良好的线性关系,直线回归方程为:y=12 511x+2 446.5,R2=0.999 4,其中y为峰面积响应值,x为进样量(ng)。这说明在一定浓度范围内特丁净的峰面积和进样量有良好的线性关系(图2)。
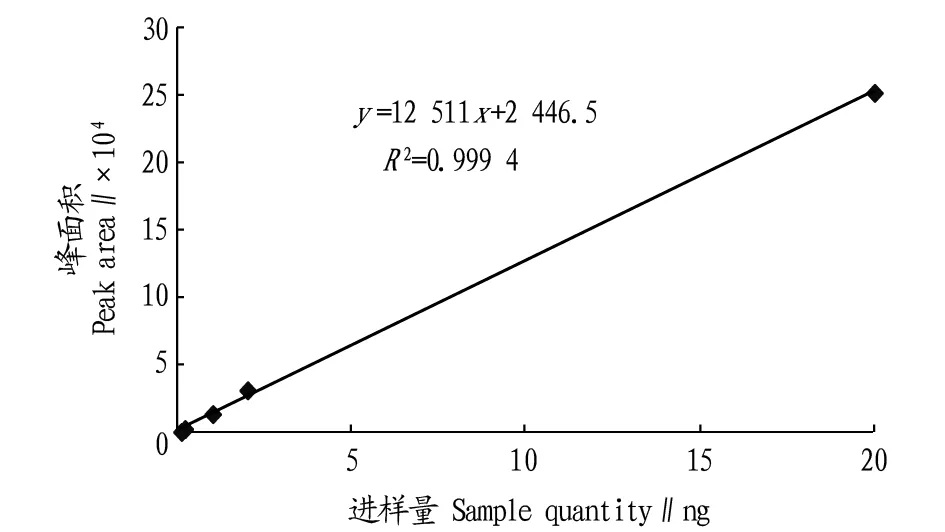
图2 特丁净标准曲线Fig.2 The standard curve of terbutryn
2.1.3方法灵敏度、准确度及精密度。在“1.3.2”色谱条件下,异丙甲草胺最小检出量为5×10-11g,特丁净的最小检出量为2×10-10g。异丙甲草胺在土壤、花生植株、花生壳、花生仁中的最低检知浓度为0.05 mg/kg。特丁净在土壤、花生植株、花生壳、花生仁中的最低检知浓度为0.01 mg/kg,说明该方法灵敏度较好。
准确度及精密度用添加回收率和标准偏差来表示。在空白的花生植株、花生壳、花生仁及土壤中添加1.00、0.50、0.05 mg/kg的异丙甲草胺标准溶液和1.00、0.10、0.01 mg/kg的特丁净标准溶液,每个浓度重复5次,用上述分析方法测定回收率。由表1可知,异丙甲草胺在花生植株中的添加回收率为82.1%~96.4%,相对标准偏差为6.2%~6.9%;在花生壳中的回收率为81.6%~95.3%,相对标准偏差为4.6%~5.9%;在花生仁中的回收率为82.2%~95.4%,相对标准偏差为5.3%~8.2%;在土壤中的回收率为85.8%~104.5%,相对标准偏差为4.8%~7.8%。特丁净在花生植株中的回收率为86.2%~91.9%,相对标准偏差为2.0%~8.6%;在花生壳中的回收率为80.6%~84.8%,相对标准偏差为2.6%~8.6%;在花生仁中的回收率为85.3%~92.9%,相对标准偏差为7.1%~7.6%;在土壤中的回收率为83.4%~91.4%,相对标准偏差为4.9%~6.8%。说明该方法有较好的准确度及精密度,符合农药残留检测要求[19]。

表1 异丙甲草胺、特丁净在花生植株、花生壳、花生仁和土壤中添加回收率
2.2残留消解动态2016—2017年在山东、浙江、湖南进行了50%异甲·特丁净乳油在花生植株、土壤中的残留消解规律试验,异丙甲草胺和特丁净在土壤中的消解规律均符合一级动力学方程式Ct=C0e-kt,式中Ct为施药后间隔的残留农药浓度,C0为药后原始沉积量,k为消解速率常数,t为药后天数。由表2、3可知,异丙甲草胺在土壤中的半衰期为11.6~14.8 d,药后30 d消解在89.1%以上;特丁净在土壤中的半衰期为12.1~14.7 d,药后30 d消解在87.2%以上。总趋势基本一致,50%异丙甲草胺·特丁净乳油在土壤中消解速度较快。2年3地试验结果表明,异丙甲草胺、特丁净在花生植株中残留量均未检出(异丙甲草胺<0.05 mg/kg、特丁净<0.01 mg/kg),半衰期无法计算。

表2 异丙甲草胺在土壤中的残留消解动态
注:异丙甲草胺在土壤中消解率为药后30 d测定
Note: The dissipation rate of metolachlor in soil was determined in 30 days after treatment
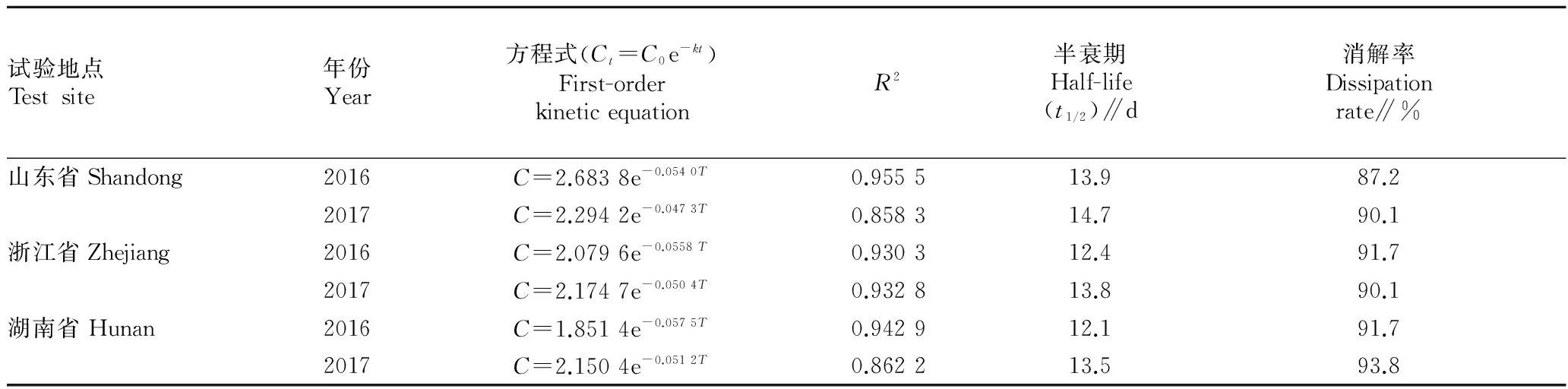
表3 特丁净在土壤中的残留消解动态
注:特丁净在土壤中消解率为药后30 d测定
Note: The dissipation rate of terbutryn in soil was determined in 30 days after treatment
2.3最终残留量异丙甲草胺、特丁净在花生植株、花生壳、花生仁和土壤中最终残留量试验结果表明,2 250、3 375 g a.i./hm250%异甲·特丁净乳油于花生播种后出苗前土表喷雾1次,收获期取样(取样间隔期为108~135 d),花生植株、花生壳、花生仁及土壤中异丙甲草胺、特丁净残留量均未检出(异丙甲草胺<0.05 mg/kg、特丁净<0.01 mg/kg)。对照区样品均未检出。
3 结论与讨论
在该试验检测条件下,异丙甲草胺进样量在5×10-11~1×10-9g,特丁净在1×10-10~2×10-8g,线性关系良好。异丙甲草胺的最小检出量为5×10-11g,特丁净为2×10-10g。异丙甲草胺在土壤、花生植株、花生壳、花生仁中的最低检知浓度为0.05 mg/kg;特丁净在土壤、花生植株、花生壳、花生仁中的最低检知浓度为0.01 mg/kg。该方法有较好的灵敏度,符合农药残留检测要求。
50%异甲·特丁净乳油在花生植株、土壤中的残留消解规律试验表明,异丙甲草胺、特丁净在花生植株中的残留量均未检出,半衰期无法计算;异丙甲草胺在土壤中的半衰期为11.6~14.8 d,药后30 d消解89.1%以上;特丁净在土壤中的半衰期为12.1~14.7 d,药后30 d消解87.2%以上。总的来说,异丙甲草胺和特丁净在土壤中半衰期较短,消解速度较快。
我国规定异丙甲草胺在花生上的最大残留限量(MRL值)为0.5 mg/kg(GB 2763—2016)[20];我国尚未规定特丁净在花生上的最大残留限量(MRL值),澳大利亚规定特丁净在粮谷中的最高残留限量为0.1 mg/kg。异丙甲草胺以0.5 mg/kg为依据,特丁净暂以0.1 mg/kg为依据,50%异甲·特丁净乳油用于防除花生田杂草,以2 250~3 750 g a.i./hm2的施用量,于花生播后苗前土壤喷施1次,收获期的花生植株、花生壳、花生仁中异丙甲草胺残留量均未检出(<0.05 mg/kg),特丁净残留量均未检出(<0.01 mg/kg)。因此,50%异丙甲草胺·特丁净乳油在花生上使用是安全的。
[1] 于峰,于佳动,李青.大豆、花生中异丙甲草胺残留量检测技术研究[J].中国卫生检验杂志,2011,21(10):2399-2400.
[2] ARMEL G R,WILSON H P,RICHARDSON R J,et al.Mesotrione,acetochlor,and atrazine for weed management in corn(Zeamays)[J].Weed technology,2003,17(2):284-290.
[3] 杜锦屏,张颖,朱骋,等.2,4-D丁酯·异丙甲草胺与扑草净不同配比对杂草的防除效果[J].安徽农业科学,2014,42(12):3568,3628.
[4] 郭建军,王风池,朱仲学.9种除草剂在覆膜棉田田间药效试验[J].山东农业科学,2009(2):87-89.
[5] 路兴涛,张勇,马士仲,等.异甲·特丁净乳油防除花生田杂草的效果[J].杂草科学,2009(3):58-60.
[6] 汪文娟,张寿江,刘炳海,等.异丙甲草胺在花生上的残留量及动态研究[J].农业环境科学学报,1992,11(3):123-124.
[7] 田宏哲,白雪松,苑馨方,等.气相色谱-电子捕获检测器同时测定瓜果类蔬菜中15种除草剂残留[J].农药学学报,2016,18(5):625-632.
[8] ANDRADE G C R M,MOTEIRO S H,FRANCISCO J G,et al.Liquid chromatography-electrospray ionization tandem mass spectrometry and dynamic multiple reaction monitoring method for detenmining multiple pesticide residues in tomato[J].Food Chem,2015,175:57-65.
[9] 刘文静,潘葳.福建省花生营养品质评价及其食用品质灰色关联法分析[J].安徽农业科学,2016,44(22):88-92.
[10] 中华人民共和国农业部.农药残留试验准则:NY/T 788—2004[S].北京: 中国农业出版社, 2004.
[11] 农业部农药鉴定所.农药登记残留田间试验标准操作规程[S].北京:中国标准出版社, 2007.
[12] 刘英伟,刘同金,田伟.氟酰胺在花生和土壤中的残留行为及安全使用评价[J].山东农业科学,2015,47(10):106-111.
[13] 刘同金,李瑞娟,于建垒,等.吡草醚在小麦和土壤中的残留及安全使用评价[J].山东农业科学,2014,46(2):125-128.
[14] 宋国春,李瑞娟,刘同金,等.溴氰菊酯在油麦菜和土壤中的残留动态及安全使用评价[J].山东农业科学,2016,48(12):146-150.
[15] 樊德方.农药残留量分析与检测[M].上海: 上海科学技术出版社, 1982.
[16] 丁蕊艳,张树秋,谷晓红,等.气相色谱法测定毒死蜱在花生及土壤中的残留量[J].山东农业科学,2013,45(1):122-125.
[17] 姜国华,陈令梅,高磊, 等.花生中氟乐灵残留测定方法[J].山东农业科学,2012,44(1):115-116.
[18] 刘同金,李瑞娟,于建垒,等.8%氟虫腈悬浮种衣剂在玉米和土壤中的残留研究及安全评价[J].中国农学通报,2014,30(22):251-257.
[19] 农业部农药检定所.农药残留量实用检测方法手册:第3卷[M].北京:中国农业出版社,2005.
[20] 中华人民共和国卫生部,中华人民共和国农业部.食品中农药最大残留限量:GB 2763—2016[S].北京:中国标准出版社,2016:207.
科技论文写作规范——引言
扼要地概述研究工作的目的、范围、相关领域的前人工作和知识空白、理论基础和分析、研究设想、研究方法和实验设计、预期结果和意义等。一般文字不宜太长,不需做详尽的文献综述。在最后引出文章的目的及试验设计等。“引言”两字省略。
