外源葡萄糖增强高表达转玉米C4型pepc水稻耐旱性的生理机制
2018-01-18张金飞何亚飞谢寅峰
张金飞 李 霞 何亚飞 谢寅峰
外源葡萄糖增强高表达转玉米C4型水稻耐旱性的生理机制
张金飞1,2李 霞1,*何亚飞1,2谢寅峰2
1江苏省农业科学院粮食作物研究所 / 江苏省优质水稻工程技术研究中心 / 国家水稻改良中心南京分中心, 江苏南京 210014;2南京林业大学生物与环境学院, 江苏南京 210037
为揭示葡萄糖参与植物耐旱性的内在机制, 以高表达转玉米C4型磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase, PEPC)基因(C4)水稻(PC)和受体“Kitaake”(WT)为材料, 通过盆栽和水培试验, 研究外施葡萄糖联合干旱处理下, 功能叶片的光合参数、总可溶性糖及其组分、Ca2+、NO含量、己糖激酶活性、B类钙调磷酸酶(calcineurin B-like, CBL)与蔗糖非发酵1 (sucrose nonfermenting-1, SNF1)相关蛋白激酶(SNF1-related protein kinase 3s, SnRK3s)基因表达的变化。结果表明, 在盆栽试验中, 分蘖期外施3%葡萄糖联合干旱处理对水稻的产量及其构成因子影响不显著, 而在孕穗期处理, PC的株高、穗数、每穗实粒重和单株产量均显著高于WT。在水培试验中, 外施1%葡萄糖和12% (m/v)聚乙二醇6000 (polyethylene glycol-6000, PEG-6000)模拟干旱处理, 均显著提高了PC功能叶片的净光合速率(n)、气孔导度(s)和羧化效率(CE), 叶片内蔗糖和果糖的含量也均显著高于WT。值得关注的是, PC叶片己糖激酶(hexokinase, HXK)活性、/基因的相对表达量在外施1%葡萄糖联合12% PEG模拟干旱处理下均显著低于12%PEG处理, 而NO含量则显著上升。相关性分析也表明, PC中n、胞间CO2浓度(i)和s分别与葡萄糖含量、HXK活性和基因表达显著相关。外施葡萄糖处理可上调PC糖水平, 下调其和基因表达, 诱导NO参与叶片气孔调节, 从而增强保水能力, 保持光合能力稳定, 最终表现为耐旱。
水稻; 葡萄糖; 磷酸烯醇式丙酮酸羧化酶; 气孔导度; 干旱
水稻作为最重要的谷类作物之一, 养活了全世界一半以上的人口[1]。近年来高温和干旱等极端天气频发, 水稻受到不利影响而减产[2]。目前, 采用常规育种方法改善和提高作物产量的步伐正在减慢或停滞, 主要因为作物单叶光合能力几乎没有改善。因此, 进一步提高作物单叶光合能力, 将成为今后作物增加产量的关键途径之一[3]。研究表明, 玉米等C4植物, 在干旱条件下可比C3植物具有更高的光合作用和水分利用效率, 且适应干旱[4]。已通过基因工程将C4光合基因如磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase, PEPC)基因() 引入水稻, 获得了高表达的转C4型基因水稻, 提高了水稻光合效率和产量[5], 这作为一条重要的作物产量改良技术途径已被广泛重视[6]。
磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase, PEPC; EC4.1.1.31)不可逆催化磷酸烯醇式丙酮酸(phosphoenolpyruvate, PEP)羧化, 产生草酰乙酸(oxaloacetate, OAA)和无机磷酸(phosphoric acid, Pi), 是重要的多功能酶[7-8]。已有研究表明, 高表达转玉米C4型基因水稻在农艺性状上与野生型水稻相比, 具有较高的千粒重、单株有效穗、穗长和单株产量[9-10]。在干旱条件下, 该转基因水稻表现出耐旱、耐强光能力, 能减缓干旱胁迫对水稻光合的抑制[10-13]。其保卫细胞中PEPC可特异性地调控, 导致苹果酸或草酰乙酸积累, 从而促进气孔开放, 增强光合作用[5]。而3,3-二氯-二羟基膦酰基-甲基-2-丙烯酸酯(DCDP, 3,3-dichloro-2-dihydroxyphosphinoyl-methyl-2- propenoate)(PEPC的抑制剂)可限制气孔开放[14]。高表达转玉米C4型基因水稻可通过H2O2、NO和钙离子参与调节PEPC酶活性和基因的表达, 从而在气孔开放调节中起作用[8-9,15]。
植物光合作用产生糖是一个重要的过程, 并能通过糖信号的转导, 调整生长发育, 保持能量平衡, 响应代谢及环境波动, 从而表现胁迫耐受性[16]。不同植物叶片中, 葡萄糖响应的差异性很可能是物种的结构、发育阶段以及碳和氮储存方式或使用效率的不同所引起[17-19]。糖还与其他信号成分, 包括激素、miRNA、活性氧(reactive oxygen species, ROS)及其他信号分子发生相互作用[20-24]。多种糖信号已经成为从植物胚胎发生到衰老的关键调节因子, 其中葡萄糖是植物生长和发育中控制基因和蛋白质表达、细胞周期进程、次级代谢等最古老的保守信号分子[25]。全基因组转录分析揭示, 葡萄糖调控一系列基因的表达, 包括信号转导、碳水化合物代谢和与代谢转运、胁迫响应相关的基因[25]。葡萄糖信号主要通过2个机制被感知和转导, 即通过葡萄糖传感器的直接感测, 或通过各种能量和代谢物传感器的间接感测[25]。其中, 己糖激酶1 (hexokinase1, HXK1; EC2.7.1.1)是具有催化和调节作用的双功能酶, 是进化上保守的葡萄糖传感器, 作为糖产生的生理反馈环, 可被葡萄糖促进和被氮素抑制[18-19,26]。此外, 蔗糖非发酵1 (sucrose nonfermenting-1, SNF1)相关蛋白激酶(sucrose nonfermenting-1-related protein kinase, SnRKs)也是联系糖信号与胁迫信号的关键蛋白因子[27]。如SnRK1可被调节因子葡萄糖-6-磷酸(glucose-6-phosphate, G-6-P)和海藻糖-6-磷酸(trehalose-6-phosphate, T-6-P)负调控, 从而直接与糖信号之间建立联系[28-29]。但是, 目前有关SnRKs直接参与信号的相关证据并不多。我们的前期研究发现, 高表达转玉米C4型基因水稻中存在较多的可溶性糖[30], 大多数PEPC在接近胞质溶胶的最佳生理pH下, 可被变构效应子G-6-P正调节或被苹果酸和天冬氨酸负调节, 从而响应于糖信号, 暗示了糖和PEPC均参与植物生理功能[31]。本研究旨在解析糖参与高表达转玉米C4型基因水稻耐旱的生理机制, 并为通过C4光合特性的改良提高水稻耐旱性提供理论依据。
1 材料与方法
1.1 试验材料
以第14代稳定遗传的高表达转玉米C4型水稻(以下简称PC)和未转基因原种“Kitaake”(以下简称WT)作试材, 最初使用转基因材料是由Ku教授馈赠的T3植株[5]。水稻种子经75%酒精消毒5 min, 去离子水充分冲洗后, 用50%的次氯酸钠消毒10 min, 再用去离子水充分冲洗, 然后挑选大小一致的种子, 在恒温黑暗培养箱中25℃催芽3 d。待幼苗长到二叶期时, 转移至国际水稻研究所(International Rice Research Institute)标准营养液中, 置人工气候箱以30℃/25℃(昼/夜)、14 h/10 h (光/暗)培养[32]。待秧苗长到五至六叶期, 选择株型、长势、叶片均一的植株, 于晴天的傍晚进行处理, 并统一测定生理指标。
1.2 试验设计
1.2.1 水培试验处理 将植株分为2组, 在晴天的傍晚用超微喷雾器喷施1%葡萄糖溶液, 以喷清水作为对照, 处理后转移到30℃/25℃(昼/夜)人工气候箱中先暗处理10 h, 再用光照处理2 h, 随后测定植株倒二叶的光合参数。之后将植株转移到含有12% (m/v)聚乙二醇6000 (polyethylene glycol-6000, PEG- 6000)的培养液中(以下称模拟干旱胁迫), 在光照培养箱中光照处理2 h后, 测定植株光合参数。之后取下倒二叶, 迅速在-80℃液氮中保存, 用于测定其他生理指标。同时测定处理前后相对含水量(relative water content, RWC), 在苗期并以RWC作为耐旱性指标。
1.2.2 盆栽试验处理 于2016年5月4日至8月10日在江苏省农业科学院专用网室中进行。盆栽用土为稻田黏壤土, 盆钵随机区组排放, 进行常规水肥和病虫管理。在分蘖期和孕穗期, 待盆钵土自然落干后, 对水稻叶片喷施3%葡萄糖溶液, 以喷清水为对照。随机分成两组, 一组正常灌溉(对照, CK), 一组自然干旱(drought stress, DS)。自然干旱组, 每3 d喷施3%葡萄糖溶液1次, 共处理5次, 每株共喷施50 mL溶液(以下称联合干旱胁迫), 均以喷清水为对照(以下称干旱胁迫)。5次处理结束后, 所有处理均恢复正常灌溉, 开花后50 d收获, 考察产量及其构成因子, 以单株产量作为耐旱性指标。
1.3 测定方法
1.3.1 相对含水量 按文献[33]的方法测定植株RWC。
1.3.2 糖组分含量 参照Ambavaram等的方法[34]测定蔗糖、葡萄糖和果糖含量。
1.3.3 光合参数 参照Li等的方法[35], 使用LI-6400 (Li-Cor, Lincoln, NE, USA) 便携式光合作用测定系统, 采用红蓝光源叶室(LI-6400-40), 设置光量子通量密度(photosynthetic photon quanta flux density, PPFD) 800 μmol m2s–1, 流速500 μmol s–1。室外温度25~30℃, 相对湿度67%~79%, PPFD为(1000±0) μmol m–2s–1, CO2浓度为(390.0±10.5) μmol mol–1, 上午9:00至11:00之间, 选取水稻倒二叶测定净光合速率(n, net photosynthesis rate)、气孔导度(s, stomatal conductance)和胞间CO2浓度(i, intercellular CO2concentration)等, 通过CE =n/i,计算出羧化效率(CE, carboxylation efficiency)。每个处理测定4张叶片, 3次重复。
1.3.4 钙离子(Ca2+)和一氧化氮(NO)含量 分别参照Yang等[36]和Murphy与Noack[37]的方法。
1.3.5 己糖激酶活性 参照Schaffer和Petreikov[38]的方法。
1.3.6 总RNA的提取和实时荧光定量聚合酶链式反应(quantitative real-time PCR, qRT-PCR) 根据Jung等[39]报道的方法制备总RNA。参考Chen等[8]的方法反转录, 在PCR仪(ETC811, 北京东胜创新生物科技有限公司)上进行。根据制造商的说明书使用SYBR Premix ExII试剂盒[TaKaRa Biotechnology(大连)有限公司]进行qRT-PCR分析, 用Applied Biosystems Step One实时PCR系统(Applied Biosystems, Foster City, CA, USA)分析。qRT-PCR反应条件为95℃ 10 min; 94ºC 30 s, 58℃ 40 s和68℃各1 min, 共32次循环。重复3次。在Primer3上设计引物, 以水稻组成性表达的基因为内部参照, 引物序列见表1。
1.4 统计与分析方法
使用SPSS19.0软件对数据进行One-Way ANOVA分析, 采用Microsoft Excel 2016对数据进行描述和作图。使用2–ΔΔCt方法分析qRT-PCR数据。
2 结果与分析
2.1 分蘖期和孕穗期干旱胁迫下喷施葡萄糖对水稻产量及其构成因子的影响
如表2所示, 分蘖期干旱胁迫后, PC的结实率显著高于WT, 但在联合干旱胁迫下, PC并没有显著提高单株产量。孕穗期干旱胁迫后, PC和WT的株高、穗数、每穗实粒数、千粒重和单株产量均显著降低, 而联合干旱胁迫下, PC的株高、最高分蘖数、每穗实粒数、每株实粒重和单株产量均显著高于WT。表明喷施葡萄糖可以显著缓解孕穗期干旱胁迫对PC产量造成的损失。

表1 qRT-PCR的基因和引物
Act: 肌动蛋白; CBL: B类钙调磷酸酶; SnRK: 蔗糖非发酵相关蛋白激酶。
Act: actin; CBL: calcineurin B-like; SnRK: sucrose nonfermenting-1-related protein kinase.

表2 分蘖期外施葡萄糖联合干旱处理对水稻产量及其构成因子的影响
CK: 正常灌溉和叶面喷施清水; DS: 干旱胁迫+叶面喷施清水; DS+Glc: 干旱胁迫+叶面喷施3%葡萄糖溶液。表中数字后标以不同的字母表示在5%水平上差异显著。
CK: irrigation and leaf spray application of water; DS: drought stress and leaf spray application of water; DS+Glc: drought stress and leaf spray application of 3% glucose. Values followed by different letters are significantly different at the 5% probability level.

表3 孕穗期外施葡萄糖联合干旱处理对水稻产量及其构成因子的影响
缩写同表2。表中数字后标以不同的字母表示在5%水平上差异显著。
Abbreviations are the same as those given in Table 2. Values followed by different letters are significantly different at the 5% probability level.
2.2 喷施葡萄糖联合12% PEG-6000模拟干旱胁迫对水稻叶片光合参数的影响
如图1-A~D所示, 相比于正常生长条件, 干旱胁迫下PC和WT的净光合速率(n)、胞间CO2浓度(s)以及羧化效率(CE)均显著降低, 但PC的n、胞间CO2浓度(i)和CE均显著高于WT, 而s则显著低(<0.05)。联合干旱处理则显著缓解了PC和WTn和s的下降,i和CE均显著上升, 而且PC的n和CE均显著高于WT, 说明外施葡萄糖可一定程度缓解干旱胁迫导致的光合能力下降, 尤其有益于PC。从图1-B还可以看出, 模拟干旱胁迫下, PC的s显著低于WT (<0.05), 说明PC通过关闭气孔减少水分丧失响应胁迫。联合干旱胁迫下PC和WT的s均提高, 从而增加光合作用的底物(i), 减少光合能力的下降。值得关注的是, 在联合干旱处理下, PC始终维持比WT高的光合能力, 但其气孔导度却始终显著低于WT。可见, PC通过调节气孔保持一定程度的关闭而维持光合作用稳定, 可能是其耐旱性强更重要的原因之一。
2.3 喷施葡萄糖联合12% PEG-6000模拟干旱胁迫对水稻叶片相对含水量、可溶性糖、糖组分以及PEPC酶活性的影响
由图2-A可知, 模拟干旱显著降低了PC和WT叶片的相对含水量。而与联合干旱胁迫相比, 干旱胁迫下PC的相对含水量显著高, 并且在干旱胁迫和联合干旱胁迫下, PC相对含水量都显著高于WT (<0.05), 说明PC因C4-基因的导入使耐旱性更强, 另一方面也说明外施葡萄糖能够增强水稻叶片保水能力。图2-B所示, 干旱胁迫下PC和WT的可溶性糖含量均显著高于正常灌溉, 并且PC可溶性糖含量显著高于WT (<0.05), 但外施葡萄糖并没有显著增加水稻植株内总可溶性糖含量。有趣的是, 干旱处理下调了PC的葡萄糖含量(图3-B), 而对蔗糖和果糖并没有显著影响(图3-A和图3-C), WT中蔗糖和葡萄糖含量显著增加, 对果糖则没有显著影响(<0.05)。此外, 联合干旱处理显著降低了WT的糖组分含量, 其中蔗糖和果糖水平回落到正常灌溉下的; 而与联合干旱处理相比, 干旱处理显著增加了PC糖组分的含量, 其中葡萄糖含量差异不大, 蔗糖和果糖含量显著高。图3-D所示, 各处理PC中PEPC活性均显著高于WT, 干旱处理进一步诱导了PC中的PEPC酶, 其活性显著提高, 但联合干旱处理对PC中PEPC酶活性影响不大。显然, 外源葡萄糖在早期干旱响应中可能涉及更多的信号或者转录水平发生变化, 但还未涉及翻译水平的响应。

图1 喷施葡萄糖联合12% PEG-6000模拟干旱处理对水稻叶片光合参数的影响
CK: 正常灌溉和叶面喷施清水; DS : 干旱胁迫+叶面喷施清水; DS +Glc: 干旱胁迫+叶面喷施1%葡萄糖。图中标以不同小写字母的柱值表示差异显著(< 0.05)。
CK: irrigation and leaf spray application of water; DS: drought stress and leaf spray application of water; DS+Glc: drought stress and leaf spray application of 1% glucose. Bars labeled with different letters are significantly different at< 0.05.
2.4 喷施葡萄糖联合12% PEG-6000模拟干旱胁迫对水稻叶片HXK的影响
图4所示, 相比正常条件, 干旱处理下PC和WT的HXK活性均降低, 外施葡萄糖更加剧了酶活性的降低, 其中PC的HXK活性始终显著低于WT。因此, 外施葡萄糖引起内源糖组分的变化可能通过下调HXK途径或者不依赖HXK途径响应干旱胁迫。
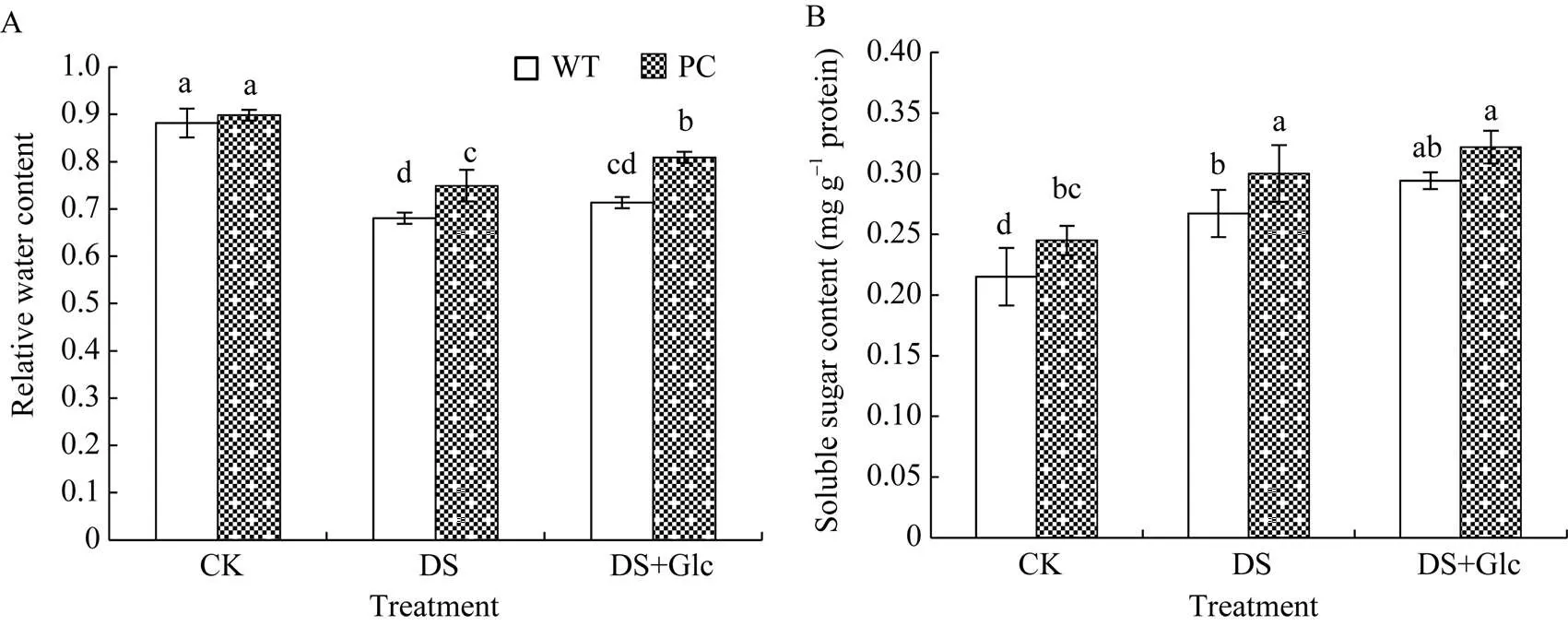
图2 喷施葡萄糖联合12% PEG-6000模拟干旱处理对水稻叶片相对含水量和可溶性糖含量的影响
缩写同图1。图中标以不同小写字母的柱值表示差异显著(< 0.05)。
Abbreviations are the same as those given in Fig. 1. Bars labeled with different letters are significantly different at< 0.05.
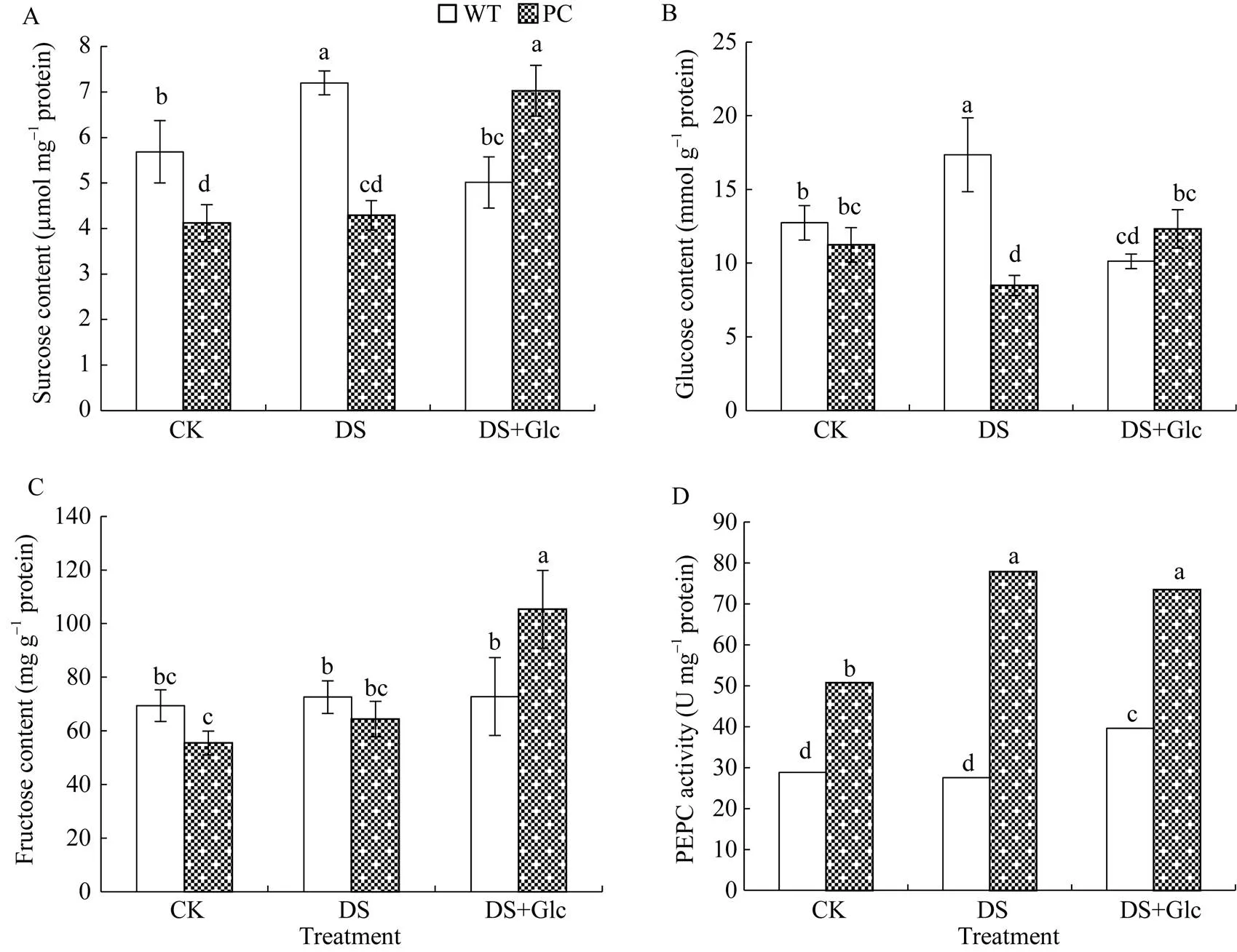
图3 喷施葡萄糖联合12% PEG-6000模拟干旱处理对水稻蔗糖、葡萄糖、果糖和磷酸烯醇式丙酮酸羧化酶的影响
缩写同图1。图中标以不同小写字母的柱值表示差异显著(< 0.05)。
Abbreviations are the same as those given in Fig. 1. Bars labeled with different letters are significantly different at< 0.05.
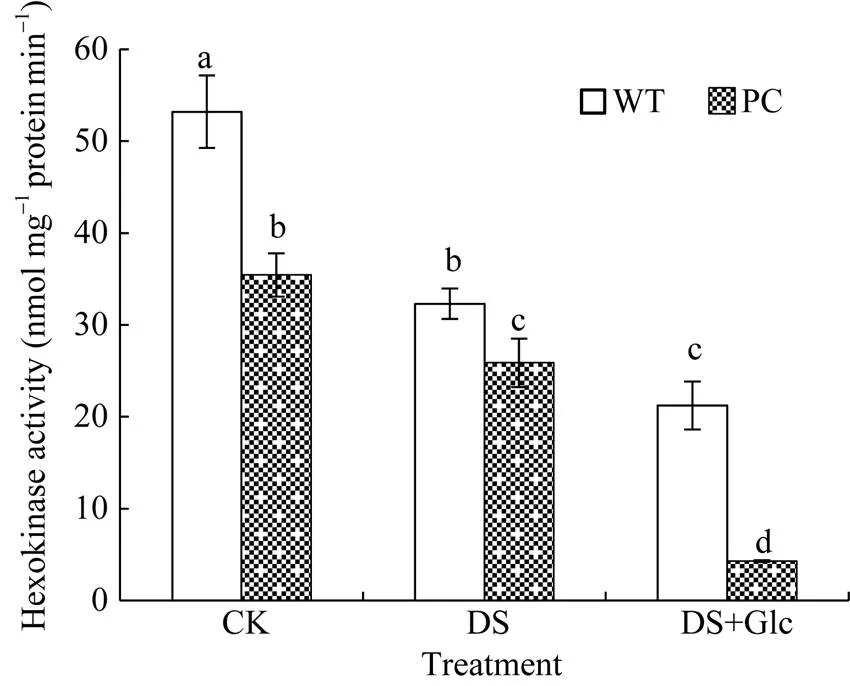
图4 喷施葡萄糖联合12% PEG-6000模拟干旱处理对水稻己糖激酶的影响
缩写同图1。图中标以不同小写字母的柱值表示差异显著(< 0.05)。
Abbreviations are the same as those given in Fig. 1. Bars labeled with different letters are significantly different at< 0.05.
2.5 喷施葡萄糖联合12% PEG-6000模拟干旱胁迫对水稻叶片Ca2+和NO的影响
从图5可知, 两信号分子的含量在WT和PC间存在差异, 其中WT叶内钙离子水平在不同处理间表现稳定。在干旱胁迫下, PC的钙离子含量显著高于WT, 干旱处理显著诱导PC中钙离子含量增加, 但外施葡萄糖则消除了PC和WT间的差异。有趣的是, 干旱处理显著下调了两材料NO水平, 而外施糖则显著提升了两材料的NO水平, 其中对于PC, NO水平提升到对照的水平。可见, 外施葡萄糖调节两材料的信号分子恢复到正常水平, 其中PC的提高更为显著。
2.6 喷施葡萄糖联合12% PEG-6000模拟干旱胁迫对水稻叶片CBL1、CBL10和SnRK3s基因表达的影响
干旱处理后PC中B类钙调磷酸酶1 (calcineurin B-like1, CBL1)基因表达显著诱导增加, 而WT则没有显著变化, 外施葡萄糖则消除了PC与WT间基因表达的差异, 这个变化与钙水平的变化类似(图6)。干旱处理下, PC中基因表达量显著上升, 联合干旱处理下, PC中基因相对表达量也显著高于WT (图6)。可见, PC中更敏感感知糖信号。图7表明正常条件下, PC的3个基因和均保持较低的表达量, 干旱处理下调了PC中、和的基因表达, 联合干旱处理进一步加剧了PC中、和基因表达量的下调, 但显著上调了WT的响应基因表达, 其基因相对表达量显著高于PC。可见, 单独干旱处理显著下调了PC中、和的基因表达水平, 而联合干旱处理显著提高了PC中的糖含量(蔗糖和果糖), 高的糖组分作为糖信号与钙信号互作, 可能在一定程度上反馈抑制、和的相对表达量, 维持气孔一定程度的开放, 增加光合作用底物CO2的浓度(i), 从而维持光合作用, 表现为PC耐旱性增强, 产量稳定。
2.7 喷施葡萄糖联合干旱胁迫下PC和WT的单株产量与各个指标的相关性
如表4和表5所示, 孕穗期联合干旱胁迫下PC单株产量与各参数间存在显著的相关。对于WT,n与i、n与HXK、HXK与i均存在极显著相关性(< 0.01),n与蔗糖、n与、NO与s、HXK与i、与i、与蔗糖、葡萄糖与Ca2+、葡萄糖与、Ca2+与、HXK与均存在显著相关性(< 0.05)(表4), 这意味着光合作用的变化与葡萄糖、蔗糖、己糖激酶、NO、Ca2+、和都密切相关。对于PC,n与s极显著相关(< 0.01), 葡萄糖含量分别与n、s和i显著相关; HXK活性分别与n、s、i、葡萄糖含量及基因的表达量显著相关;分别与n、s显著相关(表5)。值得关注的是, PC的单株产量与显著相关, PEPC酶活性与果糖含量显著相关, 说明联合干旱处理后, PC中葡萄糖含量显著影响光合作用。同时, 己糖激酶途径可能是联系光合作用与糖和的中心枢纽, PEPC通过参与调节糖含量的变化, 间接介导己糖激酶途径, 调控的基因表达, 最终影响产量。
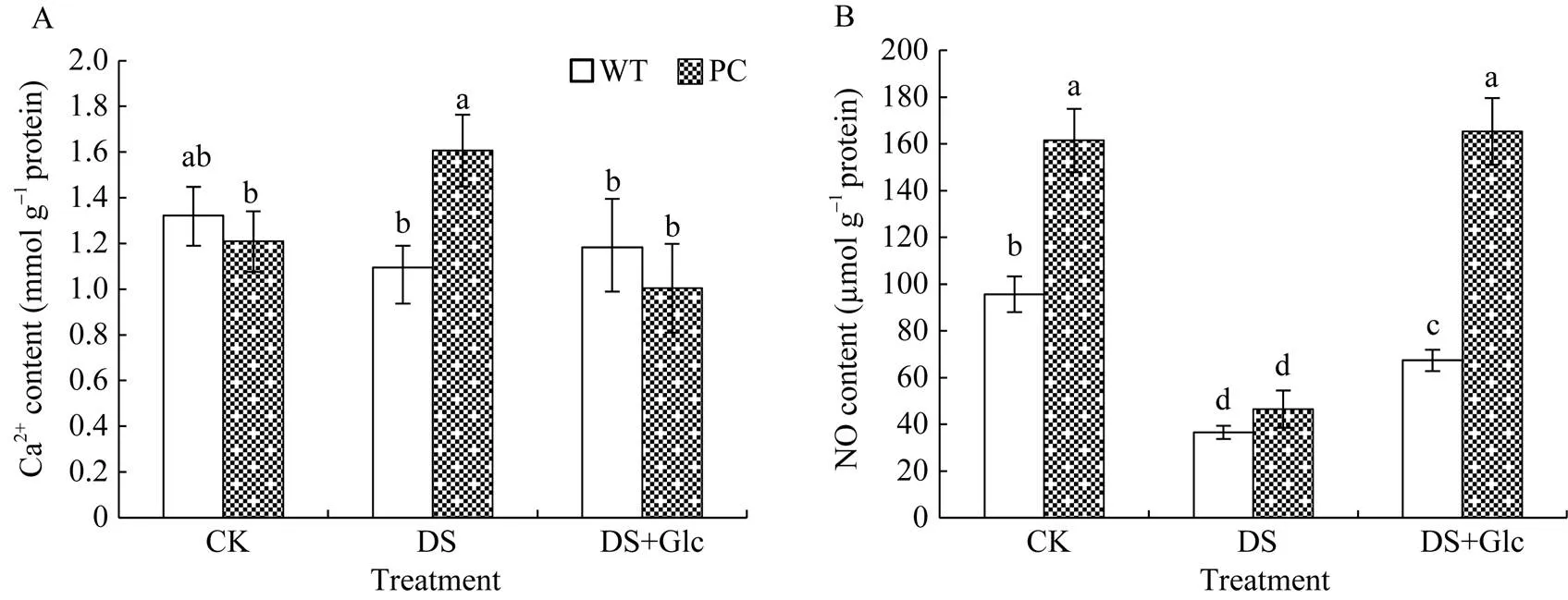
图5 喷施葡萄糖联合12% PEG-6000模拟干旱处理对水稻Ca2+和NO的影响
缩写同图1。图中标以不同小写字母的柱值表示差异显著(< 0.05)。
Abbreviations are the same as those given in Fig. 1. Bars labeled with different letters are significantly different at< 0.05.
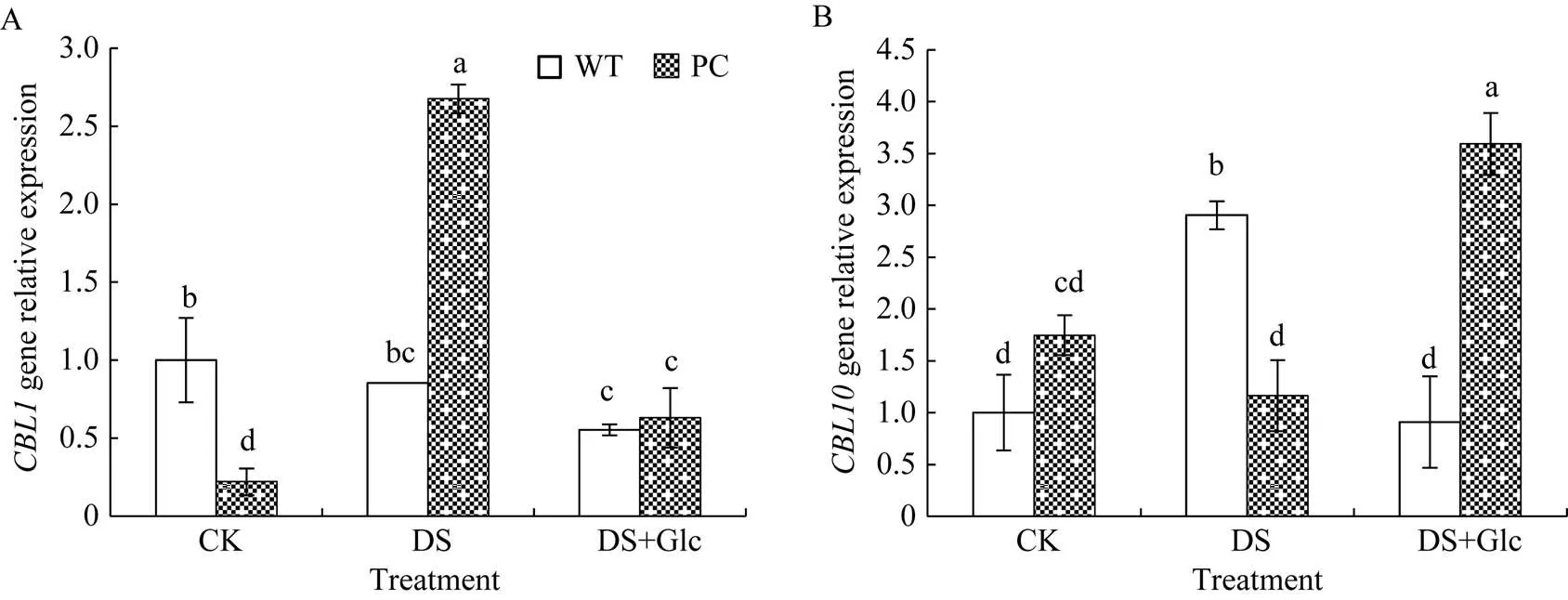
图6 喷施葡萄糖联合12% PEG-6000模拟干旱处理对水稻CBL1和CBL10基因表达量的影响
缩写同图1。图中标以不同小写字母的柱值表示差异显著(< 0.05)。
Abbreviations are the same as those given in Fig. 1. Bars labeled with different letters are significantly different at< 0.05.

图7 喷施葡萄糖联合12% PEG-6000模拟干旱对水稻SnRK3.1/ SnRK3.4/SnRK3.21/SnRK3.16基因表达量的影响
缩写同图1。图中标以不同小写字母的柱值表示差异显著(<0.05)。
Abbreviations are the same as those given in Fig. 1. Bars labeled with different letters are significantly different at<0.05.

3 讨论
植物PEPC是催化PEP生物合成OAA的必需酶, 对于所有C4植物初级代谢都是关键酶[40]。因此, 将C4-PEPC引入C3植物被认为是增强C4光合作用所必需的酶[41-42]。本研究表明, 外施糖改变了内源糖如蔗糖和果糖的含量, 并通过下调糖感受器HXK和与钙离子相关的基因的表达量, 参与调控保卫细胞的运动, 维持气孔一定程度的开放, 从而增加了光合作用底物CO2的浓度(i), 维持光合作用, 表现为PC耐旱性增强, 产量稳定。
在拟南芥和水稻中, 光合能力的增强和可溶性糖含量的增加, 最终表现为生物量和产量的增加[43-44]。有研究报道, 在干旱胁迫下, 植物中的碳分配从不可溶性碳水化合物(淀粉)向可溶性碳水化合物转移, 从而积累更多的可溶性碳水化合物(如葡萄糖、蔗糖、果糖、山梨醇、甘露糖醇等), 有助于胁迫保护[45]。本研究中, PC产量及其构成因子的变化也得到相似的结论。通常认为, 糖过度累积会对光合作用产生反馈抑制, 从本试验来看, 外施葡萄糖对水稻植株总可溶性糖含量影响并不大, 而对内糖组分(单糖和二糖)有显著影响。对WT而言, 外施葡萄糖增加糖的分解, 糖各组分水平均降低, 而对于PC, 糖组分则较稳定。外施葡萄糖诱导PC中蔗糖和果糖水平显著增加, 这种表现与其光合参数的变化同步(图3-A和C)。因此, 在干旱条件下, PC通过下调糖组分水平以解除糖对光合作用的抑制, 并通过气孔关闭减缓植株的水分丧失, 从而表现耐旱。外施葡萄糖则通过动员糖的分解, 使糖水平恢复, 维持气孔开度, 增加光合作用底物, 保持光合能力稳定, 从而缓解干旱胁迫。有研究认为, 可能由于这种反馈抑制(“过度的”蔗糖抑制光合作用)在PC中的敏感性较低(具有C4型PEPC基因有利于更多光合产物的积累), 或者是由于较强的库源活动使蔗糖含量在关键的位点较低[19]。植物细胞中HXK是糖信号通路的关键感知因子[18], 糖信号的关键元件HXK活性在PC中维持很低的水平, 尤其是外施葡萄糖后, 其活性显著降低, 暗示这些糖组分通过下调HXK途径参与干旱响应。已有研究显示, 植物可通过高PEPC酶活性积累更多的糖和有机酸, 反馈抑制HXK活性[46]。本研究观察到, 在不同处理下PC的PEPC酶活性均高; 另一方面, 有研究报道, 在保卫细胞中HXK可感知糖水平, 刺激气孔关闭, 协调胞内糖水平与蒸腾速率, 提高植株水分利用率[47], 本研究也得到类似的结果。最近在小麦研究中也有类似的发现, 喷施外源T-6-P前体物质, 可以作为一种糖信号达到“生物合成扩增”的明显效果, 显著提高小麦产量[48]。但PC是否引起T-6-P的变化以参与干旱响应仍值得深入研究。值得注意的是, 本研究外施葡萄糖对水稻不同生育期干旱胁迫的影响有差异, 分析其原因, 初步认为喷施葡萄糖可以显著缓解孕穗期干旱胁迫对PC造成的产量损失, 可能是孕穗期比分蘖期对葡萄糖溶液更敏感。本课题组以前的研究结论, 在整个生育期都受到干旱胁迫的情况下, PC相比于WT表现出较高的千粒重、有效穗数和单株产量[9-10]。本研究取得相似的研究结果, 而且更进一步发现, 与分蘖期相比, 孕穗期干旱胁迫对产量影响更显著, 喷施葡萄糖也在更大程度上缓解PC的干旱胁迫。
信号分子参与干旱耐性的报道已有很多, 其中包括Ca2+和NO信号[49]。本研究中喷施葡萄糖后, 可回调信号分子Ca2+含量, 从而消除PC与WT间的差异, 这与Furuichi等[50]在拟南芥中发现糖可以诱导Ca2+含量变化的报道类似。值得关注的是, 外施葡萄糖显著上调了干旱胁迫下PC中NO含量, 暗示外施葡萄糖可以通过上调NO参与PC的耐旱性。已知NO可以负调节保卫细胞中脱落酸信号, 是否外施葡萄糖可以通过NO参与PC的ABA信号调控气孔运动尚需进一步验证。
植物B类钙调磷酸酶(calcineurin B-like, CBL)可以感知Ca2+和糖信号[51]。CBL蛋白家族本身并没有激酶活性, 需要通过招募相关的蛋白激酶形成复合体来传递信号, 这类蛋白质称为CBL相关蛋白激酶[52]。SnRKs是联系糖信号与胁迫信号的关键蛋白因子[27], 其中SnRK3具有CBL相关蛋白激酶功能[53], 通过与感知胞内Ca2+信号和糖信号的钙信号相关蛋白CBL相互作用, 共同响应逆境胁迫[54]。本研究发现, 外施葡萄糖显著下调PC的基因以及基因的相对表达量。已有研究表明,复合体是调控 AKT1 (K+transporter 1, AKT1)的主要蛋白[55], AKT1在保卫细胞中主要调控K+转运。复合体在调控细胞响应于渗透胁迫时发挥重要功能, 由于糖信号引起的糖代谢上的级联放大, 增加了胞质溶胶浓度,因此,复合体基因表达量下降, 即通过膜下调渗透作用[56]。本研究外施葡萄糖也是通过下调上述相关基因的表达, 维持气孔的一定开度而响应干旱。
综上所述, 在干旱条件下, PC降低糖组分的含量, 解除高糖对光合作用的抑制, 并通过气孔关闭, 减少植株在干旱条件下的水分丧失, 从而表现耐旱; 而外施葡萄糖则通过动员糖的分解, 使糖水平恢复到正常水平, 维持气孔一定程度的开度, 增加光合作用底物, 保持光合能力稳定, 缓解干旱胁迫, 从而维持产量稳定。本研究的结果将为今后进一步从内源糖研究PC的耐旱生理机制,从而揭示更多的糖参与调节的信息。
4 结论
孕穗期喷施葡萄糖联合干旱胁迫使PC的株高、每穗实粒数、每株实粒重和单株产量都显著高于WT。分蘖期喷施葡萄糖联合模拟干旱胁迫处理使PC表现出更高的相对含水量、蔗糖和果糖含量、NO含量以及基因的相对表达量, 下调HXK激酶活性和基因相对表达量, 维持一定程度的气孔开放, 提高干旱胁迫下的光合能力, 从而实现植株更多的分蘖数和单株产量。
[1] Khush G S. What it will take to feed 5.0 billion rice consumers in 2030., 2005, 59: 1–6
[2] Todaka D, Shinozaki K, Yamaguchi-Shinozaki K. Recent advances in the dissection of drought-stress regulatory networks and strategies for development of drought-tolerant transgenic rice plants., 2015, 6: 84
[3] Long S P, Marshall-Colon A, Zhu X G. Meeting the global food demand of the future by engineering crop photosynthesis and yield potential., 2015, 161: 56–66
[4] Aubry S, Brown N J, Hibberd J M. The role of proteins in C3plants prior to their recruitment into the C4pathway., 2011, 62: 3049–3059
[5] Ku M S B, Agarie S, Nomura M, Fukayama H, Tsuchida H, Ono K, Hirose S, Toki S, Miyao M, Matsuoka M. High-level expression of maize phosphoenolpyruvate carboxylase in transgenic rice plants., 1999, 17: 76–80
[6] Orta D R, Merchant S S, Alric J, Barkan A, Blankenship R E, Bock R, Moore T A. Redesigning photosynthesis to sustainably meet global food and bioenergy demand., 2015, 112: 8529–8536
[7] Johnson J F, Vance C P, Allan D L. Phosphorus deficiency inaltered lateral root development and enhanced expression of phosphoenolpyruvate carboxylase., 1996, 112: 31–41
[8] Chen P B, Li X, Huo K, Wei X D, Dai C C, Lu C G. Promotion of photosynthesis in transgenic rice over-expressing of maize C4phosphoenolpyruvate carboxylase gene by nitric oxide donors., 2014, 171: 458–466
[9] Ren C G, Li X, Liu X L, Wei X D, Dai C C. Hydrogen peroxide regulated photosynthesis in C4-transgenic rice., 2014, 74: 218–229
[10] 方立锋, 丁在松, 赵明. 转基因水稻苗期抗旱特性研究. 作物学报, 2008, 34: 1220–1226 Fang L F, Ding Z S, Zhao M. Characteristics of drought tolerance inoverexpressed rice seedlings., 2008, 34: 1220–1226 (in Chinese with English abstract)
[11] Qian B, Li X, Liu X, Wang M. Improved oxidative tolerance in suspension cultured cells of C4-transgenic rice by H2O2and Ca2+under PEG-6000., 2015, 57: 534–549
[12] 周宝元, 丁在松, 赵明.过表达可以减轻干旱胁迫对水稻光合的抑制作用. 作物学报, 2011, 37: 112–118 Zhou B Y, Ding Z S, Zhao M. Alleviation of drought stress inhibition on photosynthesis by overexpression ofgene in rice., 2011, 37: 112–118 (in Chinese with English abstract)
[13] 丁在松, 周宝元, 孙雪芳, 赵明. 干旱胁迫下过表达增强水稻的耐强光能力. 作物学报, 2012, 38: 285–292 Ding Z S, Zhou B Y, Sun X F, Zhao M. High light tolerance is enhanced by overexpressedin rice under drought stress., 2012, 38: 285–292 (in Chinese with English abstract)
[14] Vavasseur A, Raghavendra A S. Guard cell metabolism and CO2sensing., 2005, 16: 665–682
[15] Liu X L, Li X, Zhang C, Dai C C, Zhou J Y, Ren C G, Zhang J F. Phosphoenolpyruvate carboxylase regulation in C4-expressing transgenic rice during early responses to drought stress., 2017, 159: 178–200
[16] Li L, Sheen J. Dynamic and diverse sugar signaling., 2016, 33: 116–125
[17] Moore B, Zhou L, Rolland F, Hall Q, Cheng W H, Liu Y X, Hwang I, Jones T, Sheen J. Role of the Arabidopsis glucose sensor HXK1 in nutrient, light, and hormonal signaling., 2003, 300: 332–336
[18] Kelly G, David-Schartz R, Sade N, Moshelion M, Levi A, Alchanatis V, Granot D. The pitfalls of transgenic selection and new roles of AtHXK1: a high level of AtHXK1 expression uncouples hexokinas1-dependent sugar signaling from exogenous sugar., 2012, 159: 47–51
[19] Kim Y M, Heinzel N, Giese J O, Koeber J, Melzer M, Rutten T, Wiren N, Sonnewald U, Hajirezaei M R. A dual role of tobacco hexokinase1 in primary metabolism and sugar sensing., 2013, 36: 1311–1327
[20] Considine M J, Foyer C H. Redox regulation of plant development., 2014, 21: 1305–1326
[21] Matsoukas I G. Interplay between sugar and hormone signaling pathways modulate floral signal transduction., 2014, 5: 218
[22] Tsai A Y, Gazzarrini S. Trehalose-6-phosphate and SnRK1 kinases in plant development and signaling: the emerging picture., 2014, 5: 119
[23] Jung K, Nemhauser J L, Perata P. New mechanistic links between sugar and hormone signalling networks., 2015, 25: 130–137
[24] Yu S, Lian H, Wang J W. Plant development transitions: the role of microRNAs and sugars., 2015, 27: 1–7
[25] Sheen J. Master regulators in plant glucose signaling networks., 2014, 57: 67–79
[26] Zhang Z W, Yaun S, Xu F, Yang H, Zhang N H, Cheng J, Lin H H. The plastid hexokinase pHXK: a node of convergence for sugar and plastid signals in., 2010, 584: 3573–3579
[27] Hanson J, Smeekens S. Sugar perception and signaling: an update., 2009, 12: 562–567
[28] Toroser D, Plaut Z, Huber S C. Regulation of a plant SNF1- related protein kinase by glucose-6-phosphate., 2000, 123: 403–412
[29] Zhang Y, Primavesi L F, Jhurreea D, Andraloj P J, Mitchell R A C, Powers S J, Schluepmann H, Delatte T, Wingler A, Paul M J. Inhibition of SNF1-related protein kinase1 activity and regulation of metabolic pathways by trehalose-6-phosphate., 2009, 149: 1860–1871
[30] Li X, Wang C. Physiological and metabolic enzymes activity changes in transgenic rice plants with increased phosphoenolpyruvate carboxylase activity during the flowering stage., 2013, 35: 1503–1512
[31] Doubnerová V, Ryšlavá H. What can enzymes of C4photosynthesis do for C3plants under stress?, 2011, 180: 575–583
[32] Yoshida S, Forno D A, Cock J H. Laboratory Manual for Physiological Studies of Rice. Philippines: International Rice Research Institute, 1976. pp 61–64
[33] Smart R E, Bingham G E. Rapid estimates of relative water- content., 1974, 53: 258–260
[34] Ambavaram M M, Basu S, Krishnan A, Ramegowda V, Batlang U, Rahman L, Pereira A. Coordinated regulation of photosynthesis in rice increases yield and tolerance to environmental stress., 2014, 5: 93
[35] Li X, Wang C, Ren C G. Effects of 1-butanol, neomycin and calcium on the photosynthetic characteristics oftransgenic rice., 2011, 10: 17466–17476
[36] Yang C Q, Liu W N, Zhao Z H, Wu H Y. Determination of the content of serum calcium with methylthymol blue as chromogenic reagent., 1998, 18: 485–487
[37] Murphy M E, Noack E. Nitric oxide assay using hemoglobin method., 1994, 233: 240–250
[38] Schaffer A A, Petreikov M. Sucrose-to-starch metabolism in tomato fruit undergoing transient starch accumulation., 1997, 113: 739–746
[39] Jung H, Kim J K, Ha S W. Use of animal viral IRES sequence makes multiple truncated transcripts without mediating polycistronic expression in rice., 2011, 54: 678–684
[40] Izui K, Matsumura H, Furumoto T, Kai Y. Phosphoenolpyruvate carboxylase: a new era of structural biology., 2004, 55: 69–84
[41] Sethi D, Dash S, Mohapatra S, Mohanty P. C4rice: an advance technique for enhancing rice production., 2016, 5: 2535–2542
[42] 吴琼, 许为钢, 李艳, 齐学礼, 胡琳, 张磊, 韩琳琳. 田间条件下转玉米C4型基因小麦的光合生理特性. 作物学报2010, 37: 2046–2052 Wu Q, Xu W G, Li Y, Qi X L, Hu L, Zhang L, Han L L. Physiological characteristics of photosynthesis in transgenic wheat with maize C4gene under field conditions., 2010, 37: 2046–2052 (in Chinese with English abstract)
[43] Karaba A, Dixit S, Greco R, Aharoni A, Trijatmiko K R, Marsch-Martinez N, Pereira A. Improvement of water use efficiency in rice by expression of, an Arabidopsis drought and salt tolerance gene., 2007, 104: 15270–15275
[44] Kebeish R, Niessen M, Thiruveedhi K, Bari R, Hirsch H J, Rosenkranz R, Peterhänsel C. Chloroplastic photorespiratory bypass increases photosynthesis and biomass production in., 2007, 25: 593–599
[45] Abebe T, Guenzi A C, Martin B, Cushman J C. Tolerance of mannitol-accumulating transgenic wheat to water stress and salinity., 2003, 131: 1748–1755
[46] Daloso D M, Anjos L, Fernie A R. Roles of sucrose in guard cell regulation., 2016, 211: 809
[47] Granot D, Lugassi N, Kottapalli J, Kelly G. Sensing sugar and saving water., 2015, 29: 3
[48] Griffiths C A, Sagar R, Geng Y, Primavesi L F, Patel M K, Passarelli M K, Davis B G. Chemical intervention in plant sugar signaling increases yield and resilience., 2016, 540: 574–578
[49] Corpas F J, Barroso J B. Peroxisomal plant metabolism: an update on nitric oxide, Ca2+and the NADPH recycling network., 2017, jcs. 202978.
[50] Furuichi T, Cunningham K W, Muto S. A putative two pore channel AtTPC1 mediates Ca2+flux in Arabidopsis leaf cells., 2001, 42: 900–905
[51] Li Z Y, Xu Z S, Chen Y, He G Y, Yang G X, Chen M, Ma Y Z. A novel role for Arabidopsisin affecting plant responses to glucose and gibberellin during germination and seedling development., 2013, 8: e56412
[52] Batistic O, Kudla J. Plant calcineurin B-like proteins and their interacting protein kinases., 2009, 1790: 985–992
[53] Tominaga M, Harada A, Kinoshita T, Shimazaki K. Biochemical characterization of calcineurin B-like-interacting protein kinase inguard cells., 2010, 51: 408–421
[54] Mao J, Manik S M, Shi S, Chao J, Jin Y, Wang Q, Liu H. Mechanisms and physiological roles of the CBL-CIPK networking system in., 2016, 7: 62
[55] Li J, Long Y, Qi G N, Xu Z J, Wu W H, Wang Y. The Os-AKT1 channel is critical for K+uptake in rice roots and is modulated by the rice CBL1-CIPK23 complex.2014,26: 3387–3402
[56] Kudahettige N P, Pucciariello C, Parlanti S, Alpi A, Perata P. Regulatory interplay of the Sub1A and CIPK15 pathways in the regulation of α-amylase production in flooded rice plants., 2011, 13: 611–619
Physiological Mechanism on Drought Tolerance Enhanced by Exogenous Glucose in C4-Rice
ZHANG Jin-Fei1, 2, LI Xia1,*, HE Ya-Fei1, 2, and XIE Yin-Feng2
1Institute of Food Crops, Jiangsu Rice Engineering Research Center, National Center for Rice Improvement (Nanjing), Jiangsu Academy of Agricultural Sciences, Nanjing 210014, Jiangsu, China;2College of Biology and Environment, Nanjing Forestry University, Nanjing 210037, Jiangsu, China
In order to investigate the intrinsic mechanism of glucose participated in drought tolerance in plants, the effects of glucose were studied using the phosphoenolpyruvate carboxylase (C4-) rice (PC) and “Kitaake” (WT) rice lines in pot experiments and hydroponics experiments respectively. The changes of photosynthetic parameters, total soluble sugar and sugar components contents, Ca2+and NO contents, hexokinase activity, transcript levels of sucrose nonfermenting-1(SNF1)-related protein kinases 3 (SnRK3s) and calcitonin B-like (CBL) of the functional leaves in rice lines were measured. Agronomic traits of the wild type (WT) and PC were recorded in the mature period. In pot experiment, the treatment of 3% glucose with drought during tillering stage had no significant effect on agronomic traits of the tested rice. During the booting stage, the plant height, panicle number per plant, filled grain number per panicle and grain yield per plant in PC were significantly higher than in WT (< 0.05). In the hydroponics experiment with 1% glucose combined with 12% (m/v) polyethylene glycol 6000 (PEG-6000) to simulate drought stress, the photosynthetic parameters such as net photosynthetic rate (n), stomatal conductance (s) and carboxylation efficiency (CE) significantly increased in PC than in WT. Similarly, the contents of sucrose and fructose of leaves in PC lines were significantly higher than those in WT. It was noteworthy that hexokinase (HXK) activity and the relative gene expression ofandin PC lines under the treatment with 1% glucose and 12% PEG were significantly lower than those under 12% PEG treatment alone. Intriguingly, the NO contents of PC under the corresponding treatments were significantly increased (< 0.05). In addition, the photosynthetic parameters were significantly correlated with the glucose content, HXK activity andtranscript level respectively in PC lines. It is suggested that PC can decrease the expression ofandgene by increasing glucose, participate the stomatal regulation via NO, maintain relative water content, keep stable photosynthetic capacity, and therefore confer drought tolerance.
rice; glucose; phosphate phosphoenolpyruvate carboxylase; stomatal conductance; drought
2017-03-28;
2017-09-10;
2017-09-28.
10.3724/SP.J.1006.2018.00082
通信作者(Corresponding author): 李霞, E-mail: jspplx@jaas.ac.cn
E-mail: 820788317@qq.com
本研究由国家自然科学基金项目(31571585), 江苏省农业科学院基本科研业务专项(ZX[16]2002)和江苏省农业科学院粮食作物研究所基金(LZS17-9)资助。
This study was supported by the National Natural Science Foundation of China (31571585), the Jiangsu Provincial Academy of Agricultural Sciences Basic Research Business Special Project (ZX[16]2002), and the Grant from the Institute of Food Crops of Jiangsu Academy of Agricultural Sciences (LZS17-9).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20170928.1842.022.htm
