Mg掺杂对LiNi0.56Co0.19Mn0.24Al0.01O2性能的影响
2018-01-17张广泉韩恩山朱令之
张广泉,韩恩山,朱令之,芦 敏
(河北工业大学化工学院,天津300130)
多元素协同复合材料 LiNi1-x-yCoxMnyO2(0<x<0.5,0<y<0.5)具有电化学性能优、成本低、热稳定性好等优点,在便携式电池、动力电池等领域有良好的应用前景。但该材料在循环过程中容量衰减较快,通过掺杂与过渡金属离子半径接近的惰性金属离子,对提高材料的电化学性能有很大作用[1]。Kim等[1]对 Li[Ni(1/3-x)Co(1/3-x)Mn(1/3-x)Mgx]O2进行了研究,结果表明镁元素替代其他元素减少了阳离子混排,提高了热稳定性。Mg价格低、毒性小且不参与电化学反应,Mg2+掺杂能够降低成本、提高结构稳定性。
研究者先合成前驱体,再用固相法[2]合成掺杂型正极材料,然而当掺杂量很低时,简单的机械法难以将前驱体、锂源和掺杂源混合均匀,采用溶胶-凝胶法[3]虽然能将各原料达到原子级别的混合,但成本高、工业化难度大。因此,采用共沉淀法先将掺杂离子与其他金属离子一起形成前驱体,再与锂源球磨煅烧制备正极材料,显然这种方法更容易使材料混合均匀。本文对一种新的复合材料LiNi0.56Co0.19Mn0.24Al0.01O2(0.8 LiNi0.5Co0.2-Mn0.3O2·0.2 LiNi0.8Co0.15Al0.05O2)进行了 Mg2+掺杂,与 LiNi1/3Co1/3-Mn1/3O2相比,该材料中Ni的含量高、Co的含量低,因此具有理论比容量高、成本低、对环境友好等优势。本文先合成掺杂型前驱体,再结合固相法合成了正极材料Li[Ni0.56Co0.19Mn0.24](1-x)Mgx-Al0.01O2(x=0,0.025,0.05和0.075),重点探讨了Mg2+掺杂对Li-Ni0.56Co0.19Mn0.24Al0.01O2结构及电化学性能的影响。
1 实验
1.1 材料的制备
按化学计量比将NiSO4·6 H2O、MnSO4·H2O、CoSO4·7 H2O、Al2(SO)3·18 H2O、MgSO4·7 H2O 配置成总金属离子浓度为 1 mol/L的溶液作为反应液,碳酸钠为沉淀剂,氨水为络合剂,将三种溶液并流加入反应器中,pH值控制在8.5,反应温度为60℃,合成过渡金属碳酸盐前驱体。将所得前驱体与Li2CO3·H2O按物质的量之比为1.00∶1.05球磨均匀,经预烧后,在空气气氛中800℃煅烧18 h,得到正极材料Li[Ni0.56Co0.19Mn0.24](1-x)-MgxAl0.01O2(x=0,0.025,0.05,0.075)。
1.2 电池的组装
将正极材料、乙炔黑与PVDF按质量比8∶1∶1混匀,涂覆于直径16 μm的铝箔上,烘干、压片,再冲成直径约为10 mm的圆形电极片。以锂片为负极,Celgard2400型聚丙烯膜为隔膜,电解液为1 mol/L LiPF6/(EC+DMC+EMC)(体积比1∶1∶1),在干燥的手套箱中组装模拟电池。
1.3 材料的物理性能表征及电化学性能测试
采用扫描电子显微镜进行材料形貌分析;采用X多晶射线衍射仪进行样品物相表征,CuKα,管流40 mA,管压40 kV。在CT2001A型电化学测试仪上进行充放电性能测试,电压为2.75~4.4 V。在CHI660C电化学工作站上进行循环伏安(CV)测试和交流阻抗谱测试。循环伏安测试的扫描速率为0.1 mV/s,电压范围为2.5~4.6 V;交流阻抗谱测试频率为10-2~10-4Hz,振幅为 5 mV。
2 结果与讨论
2.1 前驱体与Li2CO3·H2O混合物的热重-差热分析
图1为碳酸盐前驱体和Li2CO3·H2O混合物的热重-差热分析(TG-DTA)曲线,TG曲线有三个质量损失阶段。第一阶段在室温到200℃,TG曲线上出现了一小段失重平台,DTA曲线上出现了一个很大的吸热峰,这主要是前驱体颗粒吸附水挥发和一些杂质分解所致,质量损失大约为9.84%。第二阶段在200~400℃范围内,这一区域出现了一个失重平台,对应DTA曲线出现相应的吸热峰,过渡金属碳酸盐开始分解,质量损失大约为11.67%。第三个阶段在400~700℃范围内,DTA曲线上出现了一个较小的吸热峰,这可能与碳酸锂的分解[4]及过渡金属碳酸盐进一步分解有关,质量损失大约为14.31%。700℃以后,材料的质量基本不发生变化,并伴随着持续的吸热,这是金属离子发生晶格重组形成目标产物晶体的阶段。但在800℃左右,TG曲线出现少量的质量损失,可能是温度过高导致了Li挥发造成的。

图1 前驱体和Li2CO3·H2O混合物的TG-DTA曲线
根据TG-DTA曲线分析结果,前驱体与碳酸锂经450℃预烧,800℃煅烧,最终合成了正极材料Li[Ni0.56Co0.19Mn0.24](1-x)MgxAl0.01O2(x=0,0.025,0.05和0.075),并对其进行了结构、形貌及电化学性能测试。
2.2 结构分析
图2为Li[Ni0.56Co0.19Mn0.24](1-x)MgxAl0.01O2的X射线衍射光谱(XRD)图和最强峰(003)、(104)面衍射峰的局部放大图。由图2(a)可知,各样品均为单一的α-NaFeO2层状结构,无杂峰出现,与标准卡片LiNiO2(PDF卡号09-0063)对应。(006)/(102)和(018)/(110)两组峰分裂不太明显,是由于复合材料中镍含量较高,在800℃空气气氛中Ni2+极难氧化为Ni3+,同时锰离子存在多种氧化价态,因而合成层状结构较为困难。衍射峰的强度随着Mg2+掺杂量的升高而逐渐变低,说明Mg2+已经进入到晶格之中,适量的Mg2+掺杂不会破坏LiNi0.56Co0.19Mn0.24Al0.01O2的晶体结构。由图2(b)和(c)可知,随着Mg2+掺杂量的增加,两个最强峰均向高角度偏移。

图2 Li[Ni0.56Co0.19Mn0.24](1-x)MgxAl0.01O2(x=0,0.025,0.05 和 0.075)的XRD 图(a)及(003)、(104)衍射峰的局部放大图(b)、(c)
由晶格常数不能直接判断阳离子的分布情况,但阳离子的占位直接影响了XRD的衍射峰强度之比,特别是I(003)/I(104)的比值对这种变化更为敏感[1]。I(003)/I(104)值用来衡量材料中阳离子的混排度[5],一般认为其值大于1.2时,阳离子混排现象不明显。c/a值大于理想的立方密堆积结构的c/a值(4.899)时,材料具有较好的层状结构[6]。由表1可知,所有样品I(003)/I(104)值均大于1.2,c/a值均大于4.899,表明材料的阳离子混排度均较低且具有良好的层状结构。Mg2+掺杂后材料的I(003)/I(104)值先增大后减小,产生这种现象的原因可能是:(1)Mg2+半径大于 Co3+和 Mn4+/Mn2+半径(Co3+、Mn4+、Mn2+的半径分别为 54.5、53、61 pm),如果Mg2+占据O-M-O中的M位,形成的Mg-O键键长最长,最不稳定,因此Mg2+更倾向于占据Li位;(2)Mg2+半径(72 pm)比 Ni2+半径(69 pm)更接近 Li+半径(0.076 nm),因此Mg2+比Ni2+更容易进入锂位点,抑制Ni2+在Li+层中的混排位错。Mg2+掺杂量较多时,就会有较多的Li位被占据,反而破坏了结构的有序性,阻碍Li+在正负极间的来回迁移,进而影响材料的电化学性能。因此适量的Mg2+掺杂可以抑制材料的阳离子混排。当x=0.025时,材料的阳离子混排度最小,材料结构稳定,预示其具有良好的电化学性能。
表1 (x=0, 0.025, 0.05和0.075)的晶胞参数
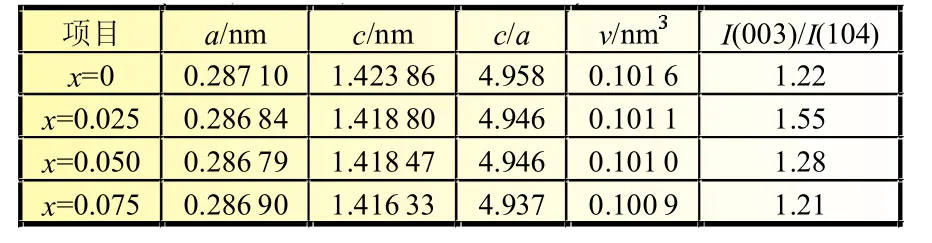
表1 (x=0, 0.025, 0.05和0.075)的晶胞参数
2.3 形貌分析
图3为Li[Ni0.56Co0.19Mn0.24](1-x)MgxAl0.01O2的扫描电子显微镜(SEM)图。由图3可知,各样品中均存在细小的一次颗粒和由一次颗粒团聚而成的二次类球形颗粒。当Mg2+掺杂量较低时(x≤0.05),未掺杂的样品颗粒团聚为较大的异形颗粒,随着Mg2+的掺杂,样品中小颗粒团聚成大小均一,分散性良好的二次颗粒,且颗粒之间空隙较多,有利于电解液的渗透,这可能与Mg2+掺杂提高了前驱体与Li2CO3固相反应的活性有关,从而促进了二次颗粒的形成。当Mg2+掺杂量较高时(x>0.05),样品团聚现象又变得严重。由此可见,少量的Mg2+掺杂能有效抑制较大二次异形颗粒的出现,进一步提高Mg2+掺杂量反而促使这种现象的出现,因此Mg2+掺杂量不宜过高。

图3 Li[Ni0.56Co0.19Mn0.24](1-x)MgxAl0.01O2(x=0,0.025,0.05和0.075)的SEM图
2.4 电化学性能分析
图4为室温条件下,Li[Ni0.56Co0.19Mn0.24](1-x)MgxAl0.01O2样品在不同倍率下的首次充放电曲线。x为0、0.025、0.05和0.075的样品在0.1C下的首次充放电比容量依次为166.8/145.9、216.3/181.0、188.5/155.0、150.4/114.7 mAh/g,首次库仑效率依次为87.5%、83.7%、82.2%、76.3%。随着Mg2+掺杂量的升高,放电比容量先升高后降低,但库仑效率降低,说明一定量Mg2+的加入可以提高材料的容量,但是不能降低不可逆容量的损失。放电比容量先升高后降低的原因是Mg2+抑制了Ni2+与Li+的混排,减少了在充放电过程中因价态变化而引起的晶胞畸变,从而在一定程度上稳定了层状结构;但是随着Mg2+掺杂量的增多,会有更多的Mg2+占据Li+的位点,可能使局部结构扭曲,电化学性能变差,这与XRD分析结果一致。此外,适量的Mg2+掺杂量后,充电平台降低,放电平台升高,说明材料在充放电过程中电压极化减小了。

图4 Li[Ni0.56Co0.19Mn0.24](1-x)MgxAl0.01O2(x=0,0.025,0.05 和 0.075)在不同倍率下的首次充放电曲线
由图5(a)可知,Li[Ni0.56Co0.19Mn0.24](1-x)MgxAl0.01O2(x=0,0.025,0.05和0.075)样品在0.2C下经10次循环后容量保持率分别是98.7%、97.6%、97.7%、92.8%,在1C下经10次循环后容量保持率分别是92.5%、101.6%、101.4%、91.7%。x=0.025的样品在各个倍率下的放电比容量均最高,在小倍率下少量Mg2+掺杂后材料的循环稳定性改变不明显,但在较大倍率下循环稳定性明显增强。为了验证x=0.025样品在较大倍率下的循环稳定性,对样品x=0,0.025进行了以0.1C恒流充电、1C恒流放电的循环性能测试,如图5(b)所示,样品x=0,0.025在1C下循环首次放电比容量分别为100.7、122.3 mAh/g,经30次循环后容量保持率分别为72.7%、98.0%,再次说明了Mg2+掺杂显著改善了LiNi0.56Co0.19Mn0.24Al0.01O2在较大电流放电时的循环性能;图5(c)为x=0.025的样品在1C下第1次、第2次及第30次充放电曲线,曲线重合性很好,说明材料具有良好的循环稳定性。WEST A R[7]认为Mg掺杂提高了材料的导电性,因此提高了材料的倍率性能和循环性能。当Mg2+掺杂量为x=0.025时的倍率性能和循环性能最好,除了与其较低的阳离子混排度及良好的形貌有关外,可能还与Mg2+掺杂提高了材料的导电性有关。

图5 Li[Ni0.56Co0.19Mn0.24](1-x)MgxAl0.01O2的循环性能
为了进一步研究Mg2+掺杂对电化学反应过程的影响,对未掺杂样品与x=0.025样品进行了循环伏安测试和电化学阻抗谱测试,结果如图6和图7所示。
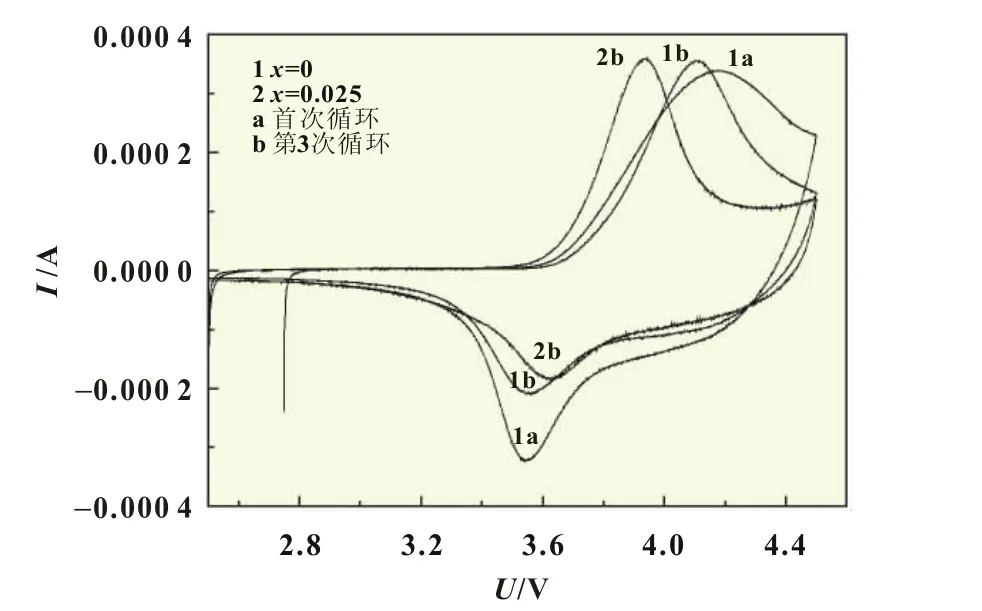
图6 Li[Ni0.56Co0.19Mn0.24](1-x)MgxAl0.01O2(x=0,0.025)样品的CV曲线

图7 Li[Ni0.56Co0.19Mn0.24](1-x)MgxAl0.01O2(x=0,0.025)样品的交流阻抗谱
由图6可知,样品的CV曲线均只出现了一对明显的氧化还原峰,对应的是Ni2+/Ni4+电对的氧化还原反应[8],这就意味着在此区间内没有发生六方相向单斜相的转化[9],该样品在2.5~4.5 V之间结构稳定,没有发生相变。在2.5~4.5 V的工作电压范围内没有Co4+/Co3+的氧化还原峰是因为扫描范围较窄,除此之外也没有其他的氧化还原峰出现,说明Mn、Mg、Al等离子并没有参加反应,主要起到稳定层状结构的作用。在循环伏安曲线中,氧化还原峰电位差越小,Li+在嵌入与脱嵌过程中的可逆性越强,材料的循环性能越好。未掺杂样品在首次循环中的电位差为0.634 V,而x=0.025样品的为0.540 V,经3次循环后的电位差为0.306 V,说明Mg2+掺杂能减弱电极极化,增强反应过程的可逆性。
交流阻抗谱中高频区的半圆弧反映的是正极材料表面形成的固体电解质相界面(SEI)膜的阻抗。由图7分析可知,首次循环谱图中未掺杂样品与掺杂样品固液界面膜阻抗都较小,且掺杂样品的界面膜阻抗半圆有所增大,经过3次循环,样品的界面膜阻抗半圆均增大,可能是随着循环次数的增加,SEI膜增厚导致的,与x=0样品相比,x=0.025样品的SEI膜阻抗增加较少,说明Mg2+掺杂能够抑制LiNi0.56Co0.19Mn0.24Al0.01O2电化学阻抗的增加,有利于提高材料的电化学性能,这与前面的结论一致。
3 结论
用碳酸盐共沉淀法合成了Li[Ni0.56Co0.19Mn0.24](1-x)MgxAl0.01O2(x=0,0.025,0.05和0.075)正极材料。适量Mg2+掺杂不会破坏LiNi0.56Co0.19Mn0.24Al0.01O2的晶体结构,并且可以有效抑制阳离子混排,稳定层状结构;适量Mg2+掺杂一定程度上能抑制二次异形大颗粒的生成,使材料颗粒分布均匀,二者都有利于其容量的发挥。
适量Mg2+掺杂LiNi0.56Co0.19Mn0.24Al0.01O2后,材料的电化学性能明显得到改善。当x=0.025时,LiNi0.546Co0.185Mn0.234Mg0.025-Al0.01O2具有最优的电化学性能,在0.1C下首次放电比容量可达181.0 mAh/g,首次库仑效率为83.7%;在1C下首次放电比容量为122.3 mAh/g,经30次循环后容量保持率为98.0%。
[1]KIM G H,MYUNG S T,KIM H S,et al.Synthesis of spherical Li-[Ni1/3-zCo1/3-zMn1/3-zMgz]O2as positive electrode material for lithium-ion battery[J].Electrochimica Acta,2006,51:2447-2453.
[2]王翠玲.镁含量对LiNi1/3Co1/3Mn1/3-xMgxO2正极材料物理性能的影响[J].电源技术,2014,38(8):1450-1452.
[3]李艳艳,朱令之,韩恩山,等.溶胶-凝胶法合成Li1.016Cr0.103Mn0.464-Ni0.356O2[J].电池,2015,45(2):85-88.
[4]XIANG Y H,YIN Z L,ZHANG Y H,et al.Effects of synthesis condition on the structural and electrochemical properties of the Li-rich material Li[Li0.2Ni0.17Co0.16Mn0.47]O2via the solid-state method[J].Electrochim Acta,2013,91:214-218.
[5]KIM Y,KIM H S,MARTIN S W.Synthesis and electrochemical characteristics of Al2O3-coated LiNi1/3Co1/3Mn1/3O2cathode material for lithium ion batteries[J].Electrochimica Acta,2006,52:1316-1322.
[6]张海郎,刘水香.层状正极材料LiNi1/3Co1/3Mn1/3O2-xClx的合成及性能[J].电池,2013,43(1):31-34.
[7]TUKAMOTO H,WEST A R.Electronic conductivity of LiCoO2and its enhancement by magnesium doping[J].J Electrochem Soc,2009,144:3164.
[8]SHAJU K M,SUBBA R G V,CHOWDARI B V R.Performance of layered LiCo1/3Ni1/3Mn1/3O2as cathode for Li-ion batteries[J].Electrochimica Acta,2002,48(2):145-151.
[9]SUN Y C,OUYANG C Y,WANG Z X,et al.Effect of Co content on rate performance of LiMn0.5xCo2xNi0.5-xO2cathode materials for lithium-ion batteries[J].J Electrochem Soc,2004,151(4):A504-A508.
