慢性阻塞性肺疾病与幽门螺杆菌感染关系探讨
2018-01-17何静江王晓莉李海龙金丽娟
何静江,王晓莉,杨 伟,李海龙,金丽娟
慢性阻塞性肺病(COPD)是呼吸系统常见慢性疾病,病程长,严重影响患者的劳动力和生活质量,给社会和家庭带来巨大损失。研究发现消化性溃疡患者COPD发病率较无溃疡者高2~3倍,幽门螺杆菌(Hp)感染与胃肠外疾病的发生密切相关。我国学者研究也认为Hp极有可能是导致COPD的独立危险因素[1]。选取COPD稳定期患者170例,进行Hp检测,同时与健康人群做对照分析,探讨Hp感染与COPD两者的关系。
1 资料与方法
1.1 一般资料:选取2015年3月-2016年11月我院门诊就诊符合标准COPD稳定期患者170例,同时选取门诊健康体检行Hp检查者170例(排除消化系统疾病病例)。所有患者COPD符合GOLD指南的COPD诊断标准[2],行14C呼气试验检测Hp感染,对照观察2组Hp感染状况。选取COPD患者60例,根据COPD气流受限严重程度分级[2]为轻中度病例,除去吸烟因素,1个月内未使用抗生素,选取性别、年龄相匹配病例,分为Hp感染阳性组及阴性组,每组30例。60例患者中男46例,女14例,年龄45~79岁,平均年龄(62±9.3)岁。
1.2 试验方法
1.2.1 14C尿素呼气试验:检查前2周停用抗生素及影响Hp活性的药物,采用幽门螺杆菌检测仪(安徽养和医疗器械设备公司)。测试前禁食2 h以上,用10 mL温开水送服14C胶囊一粒后静坐,20 min后取呼气卡一张,往卡内呼气3 min完成采样。将呼气卡插入仪器进行检测,时间为4 min,结果判定为阳性及阴性。14C尿素呼气试验由于准确率达95%以上,以及无痛、无创、无交叉感染的优点,被国内专家推荐为诊断Hp的“金标准”[3]。
1.2.2 肺呼吸功能检测:经14C尿素呼气试验筛选入组患者,根除Hp之前使用肺功能仪(日本捷斯特)行肺功能检测,检测第1秒最大呼气量(FEV1.0)用力肺活量(FVC)及(FEV1.0/FVC)值。
1.2.3 血气分析:入组患者检测肺功能同时抽取血气分析检查,检测PaO2、PaCO2和SaO2值。
1.3 统计学方法:采用SPSS 15.0统计软件,率的比较采用χ2检验,计量资料组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 健康组Hp感染与COPD组Hp感染情况比较:健康组170例,经14C尿素呼气试验证实Hp阳性89例(52.35%);COPD组170例,经14C尿素呼气试验证实Hp阳性116例(68.23%),健康组Hp感染率明显低于COPD组,Hp感染率比较差异有统计学意义(P<0.05)。
2.2 Hp感染对COPD患者肺呼吸功能影响的比较:Hp感染阳性组FEV1.0/FVC值为(49.2±4.1)%,Hp感染阴性组FEV1.0/FVC为(60.7±7.2)%,2组患者比较差异有统计学意义(P<0.05),见表1。
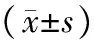
表1 Hp感染对COPD患者肺功能影响的比较
2.3 Hp感染对COPD患者血气分析影响的比较:Hp感染阳性组PaO2、SaO2明显低于Hp感染阴性组(P<0.05),PaCO2明显高于Hp感染阴性组,2组比较差异有统计学意义(P<0.05),见表2。
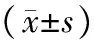
表2 Hp感染对COPD患者血气分析影响的比较
3 讨论
Hp是一种革兰氏阴性螺旋状杆菌,在胃的上皮细胞定居繁殖,感染在儿童期即可出现。感染Hp后,机体难以自身清除之,往往造成终身感染。Hp通过其独特的螺旋型带鞭毛的形态结构,以及产生的适应性酶和蛋白,可以在胃腔酸性环境中定植和生存。定植后Hp可产生多种毒素和有毒性作用的酶直接破坏胃十二指肠黏膜屏障,引起胃十二指肠黏膜损害,同时刺激机体产生炎症和免疫应答反应[3]。除已知Hp对胃部疾病影响外,还具有胃外作用,Hp仅定植于胃黏膜,对其他疾病的致病有以下特点:Hp感染如未行根除治疗,慢性持续性感染可导致炎症因子进入血液循环,诱导全身的慢性炎症反应,导致胃部和胃外远处脏器的损伤[4];它还可以引起自身免疫反应和营养物质的吸收及代谢障碍。本组研究着重探讨Hp感染与COPD的关系,Hp感染可能是导致COPD反复发作、迁延不愈的致病因素之一。
COPD是一组以气流受限为特征、肺功能进行性恶化为特点的肺部疾病,气流受限为不完全可逆,气流受限通常为进行性加重,与气道慢性炎性刺激相关,是可以预防和治疗的疾病。王静等成功建立动物模型证实[5],Hp感染明显使COPD模型大鼠肺功能恶化,对肺组织产生损害,Hp感染在COPD发病机制中发挥重要的协同致病作用,Hp持续感染是慢性炎症与全身免疫反应导致气道和肺脏功能损害的病理进程之一。另一方面,Hp或者其分泌的毒素长期损害胃食管黏膜造成胃食管返流病,返流物微吸或误入呼吸道,引发反复持续的呼吸道感染,加重支气管黏膜炎症反应[6]。Hp通过吸入途径,直接进入肺组织,损伤支气管肺上皮细胞,诱发局部炎症反应[7]。COPD患者长期使用激素、抗生素易感染Hp,造成Hp耐药菌株生长,导致肺功能进一步恶化。本组研究COPD组170例患者经与健康人群对照,健康人群Hp感染率(52.35%)明显低于COPD组(68.23%)。COPD组Hp阴性组患者肺功能、血气分析PaO2、SaO2水平指标明显高于Hp阳性组,肺功能恶化程度明显相关。本研究与文献报道一致[8],Hp感染可能诱发加重COPD疾病进展[9],毒素作用直接或间接对患者支气管黏膜造成破坏,进一步加重肺功能损害。结果表明Hp感染是导致COPD独立的危险因素,且可能是使COPD患者肺功能恶化血氧饱和度降低的因素之一。研究Hp感染与COPD的关系,对COPD的预防、诊治等具有重要意义。应进一步对COPD患者行根除Hp治疗,对比治疗前后患者肺呼吸功能改善状况,证实Hp感染是COPD的独立危险因素。临床治疗COPD患者合并Hp感染者,经抗感染及改善肺功能治疗后效果不佳者,常规积极给予根除Hp治疗,可以延缓疾病进展。
[1] 胡伏莲,王蔚红,张万岱,等.幽门螺杆菌感染诊疗指南[M].第2版.北京:人民卫生出版社,2013:56-67.
[2] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中华结核呼吸杂志,2013,36(4):255-264.
[3] 苏青,徐三平.幽门螺旋杆菌的研究进展[J].临床消化病杂志,2014,26(3):132-133.
[4] 薛旗山,闫春良,雷芸,等.慢性阻塞性肺病患者幽门螺杆菌感染的研究[J].国际呼吸杂志,2014,34(15):1145-1147.
[5] 王静,季尚玮,李岩,等.幽门螺杆菌感染慢性阻塞性肺病模型的建立及特征分析[J].中华消化杂志,2011,31(11):757-760.
[6] 刘青,冯世兵,李颖,等.慢性阻塞性肺病患者胃酸、幽门、胃食管返流的相关性研究[J].中华现代内科学杂志,2005,2(8):730-731.
[7] 宋宁,段林.幽门螺杆菌感染与慢性阻塞性肺疾病研究进展[J].临床荟萃,2015,30(5):956-960.
[8] 白莉,刘湘,李亚斐.幽门螺杆菌与呼吸系统疾病研究进展[J].成都医学院学报,2013,8(1):8-11.
[9] 刘军,易群.幽门螺杆菌感染与慢性阻塞性肺疾病关系的Mata分析[J].临床肺科杂志,2014,19(1):1-4.
