2种雀稗属牧草种子休眠机理及其破除方法研究
2018-01-17王文娟赵丽丽王普昶
王文娟,赵丽丽,王普昶,陈 超
(1.贵州大学动物科学学院草业科学系,贵阳550025; 2.贵州省草业研究所,贵阳550006)
雀稗属牧草(Paspalum)为禾本科黍亚科多年生或一年生植物,广泛分布于热带与亚热带,是黍亚科内有较高经济价值的种类[1]。其中,宽叶雀稗(Paspazum wettsteiniiHaekel)营养丰富,再生能力强,鲜嫩多汁,草食性家畜均喜食[2]。巴哈雀稗(Paspalum notatum)又称百喜草,适应性广,生长迅速,根系发达,常用于边坡绿化和水土保持[34]。但雀稗属种子有籽粒小,发芽率低且成熟度不一致等问题,严重限制了其在实际生产中的运用[5]。
关于雀稗属牧草的研究报道相对较少,宽叶雀稗主要集中在繁殖方式及产量方面,巴哈雀稗已有的研究主要是种子萌发与实践应用。李式镜对宽叶雀稗的繁殖方法及播种地形进行研究,发现宽叶雀稗适合穴播于半阳坡的水平梯面[6]。胡宏友等研究发现,宽叶雀稗在8月份产量达到最高,表明产量与降水量呈正相关[7]。孟军江等认为,巴哈雀稗的种壳坚硬又富含蜡质,阻碍了水分的渗透和种子的生长[8]。使用60℃水和浓硫酸浸泡可软化种皮,提高巴哈雀稗的发芽率。虽然,已有物理方法可以打破巴哈雀稗种子休眠,但对于巴哈雀稗的种子休眠机理研究尚不深入。而对于宽叶雀稗种子休眠特性研究方面尚处于空白阶段。本试验以2种雀稗属牧草种子为研究对象,较为系统地研究雀稗属牧草种子休眠的原因及破除方法,为雀稗属牧草在生产中快速推广提供理论依据和技术支持。
1 材料与方法
1.1 材 料
宽叶雀稗种子由贵州众智恒生态科技有限公司提供,巴哈雀稗种子由宿迁市绿草地种业有限公司提供,白菜种子由贵州力合农业科技有限公司提供。
1.2 方 法
1.2.1 种子千粒重和生活力测定
选择颗粒饱满,大小均匀的2种雀稗属牧草种子,随机抽取供试种子1 000粒,用万分之一电子天平测定种子千粒重,8次重复。
用2%高锰酸钾溶液消毒8~10 min,用蒸馏水冲洗干净后,晾干备用。参照景彦彪[9]的方法,将种子置于25℃恒温箱内吸胀12 h后,将雀稗种子沿胚纵切,浸在盛有0.1%TTC溶液的培养皿中,在35℃黑暗条件下染色24 h后统计有活力的种胚。每个培养皿放置100粒种子,3次重复。
1.2.2 种子吸水性测定
将破皮种子(用解剖刀切去种子顶端一角)和完整种子各取100粒均匀播于装有蒸馏水的培养皿中,在25℃恒温培养箱内进行吸胀,每隔一定时间取出种子,用吸水纸吸干表面水分后称重,计算种子的吸水率,重复3次:
吸水率(%)=(吸胀后种子的重量-吸胀前种子的重量)/吸胀前种子的重量×100%。
1.2.3 种子萌发抑制物的提取和生物测定
采用水浸提液法,参考赵敏等[10]的方法。称取2种雀稗属牧草种子各20 g在研钵中研碎,将粉碎的种子放入三角瓶中,加入2倍体积蒸馏水,用塑料薄膜将瓶口封严,置于56℃的恒温箱中浸提24 h。过滤后残渣再浸提2次,每次浸提24 h,合并3次浸提液,在56℃下浓缩成100 m L,即为0.2 g/m L种子水提液。设置水浸提液浓度依次为:0(对照),0.02,0.04,0.08,0.12 g/m L和0.16 g/m L。
1)浸提液对白菜种子萌发的影响:取100粒白菜种子置于垫有2层滤纸的培养皿中,向培养皿中各加入不同浓度的浸提液10 m L,每处理3个重复,25℃恒温黑暗培养。24 h测定发芽率,72 h测量根长、苗长,并计算抑制率:
抑制率(%)=(对照组-处理组)/对照组×100%。
2)浸提液对自身种子萌发的影响:各取100粒雀稗种子置于垫有2层滤纸的培养皿中,向培养皿中各加入不同浓度的浸提液10 m L,每处理3个重复。培养14 d后统计种子发芽率,测量根长、苗长,并计算抑制率。
1.2.4 激素处理
设置浓度为0,150,300,450,600 mg/L的乙烯利(ETH)溶液和吲哚乙酸(IAA)溶液以及0,50,100,200,300,400 mg/L的赤霉素(GA3)溶液,浸泡雀稗种子24 h,以蒸馏水浸种作为对照。为防止激素挥发,将所有培养皿用封口膜封上。取100粒种子置于垫有2层滤纸的培养皿中,每处理3个重复,25℃恒温培养。
1.2.5 复合处理
将雀稗种子先用浓硫酸处理,设置浸泡时间分别为2.5,5,10 min,用蒸馏水冲洗干净,晾干备用。再用GA3溶液浸泡种子24 h,浓度分别为50,100,200,300,400 mg/L,以蒸馏水浸种作为对照。取100粒种子置于垫有2层滤纸的培养皿中,每处理3个重复,25℃恒温培养。
1.2.6 萌发指标
发芽势(%)=第7天发芽的种子数/供试种子总数×100%;
发芽率(%)=第14天发芽的种子数/供试种子总数×100%;
发芽指数(GI)=∑Gt/Dt;
活力指数(VI)=GI×S(式中,Gt为逐日内的发芽数,Dt为相应的发芽天数,S为根的平均长度)。
1.2.7 数据处理
数据的分析采用SPSS 17.0统计软件进行统计分析,采用Duncan方法进行显著性分析。用Microsoft Excel 2010及SigmaPlot 10.0进行数据的制图。
2 结果与分析
2.1 种子生活力测定
宽叶雀稗种子千粒重为1.36 g,生活力达到92.2%。巴哈雀稗种子千粒重为2.01 g,生活力达到97.7%。说明2种雀稗属牧草种子都具有较高的萌发潜力。
2.2 种子吸水性测定
2种雀稗属牧草种子浸水后立即吸胀,浸种3 h内吸水速度最快(图1)。宽叶雀稗种子浸泡12 h趋于饱和,巴哈雀稗种子浸泡18 h趋于饱和。巴哈雀稗种子较宽叶雀稗种子籽粒略大,吸胀饱和所需时间较长。完整种子和破皮种子的吸水率相差较小(p>0.05),说明2种雀稗属牧草种子的种皮均不限制种子吸水。
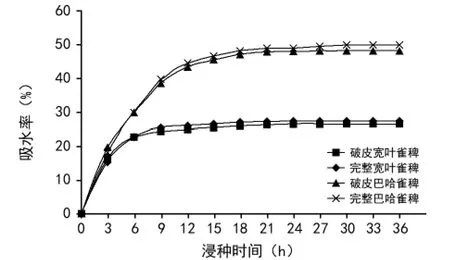
图1 2种雀稗属牧草破皮种子和完整种子的吸水曲线
2.3 种子萌发抑制物的生物鉴定
2.3.1 浸提液对白菜种子萌发的影响
随着2种雀稗属牧草种子浸提液浓度的增大,白菜种子萌发和幼苗生长受到的抑制越大(表1)。当2种雀稗属牧草种子浸提液浓度达到0.16 g/m L 时,白菜种子发芽率、苗长和根长的抑制率与对照相比分别显著增加了32.7%、0.3%和0.6%以上。说明在2种雀稗属牧草种子中含有抑制种子萌发的内源物质。
2.3.2 浸提液对自身种子萌发的影响
2种雀稗属牧草种子浸提液对自身萌发也有明显的抑制作用(表2)。随着2种雀稗属牧草种子浸提液浓度的增大,对自身种子发芽和幼苗生长的抑制率越大。当2种雀稗属牧草种子浸提液浓度达0.16 g/m L时,发芽率、苗长和根长的抑制率与对照相比分别显著增加了17.6%、33.2%和52.0%以上。2种雀稗属牧草中巴哈雀稗种子浸提液对自身萌发的抑制作用更强。进一步说明,在2种雀稗属牧草种子中存在影响自身萌发的内源抑制物。
2.4 激素处理
2.4.1 GA3处理
GA3对宽叶雀稗种子发芽势、发芽率和发芽指数的影响较小,对活力指数的影响较大(图2)。宽叶雀稗的发芽势、发芽率和发芽指数均在GA3浓度为200 mg/L时达到最大值,在GA3浓度为400 mg/L时降低为最小值,但与对照间均无显著差异。宽叶雀稗的活力指数随GA3浓度增加呈显著降低趋势,在GA3浓度为400 mg/L时降低为最小值。GA3对巴哈雀稗种子萌发有一定的促进作用。GA3浓度为300 mg/L时,巴哈雀稗种子发芽势、发芽率、发芽指数和活力指数分别为8%、16%、2.5、3.7,显著高于对照组(p<0.05)。因此,300 mg/L GA3处理对巴哈雀稗种子萌发最佳。
2.4.2 ETH 处理
ETH对2种雀稗属牧草种子均有抑制作用(图3)。随着ETH浓度的增大,2种雀稗属牧草种子的各项指标呈下降趋势。当ETH浓度为450 mg/L时,宽叶雀稗的发芽势、发芽率和发芽指数显著低于对照,依次下降了36%、42%、19.3;当 ETH 浓度为300 mg/L时,巴哈雀稗的发芽势、发芽率、发芽指数和活力指数显著低于对照,依次下降了4%、6.3%、0.8、0.5。
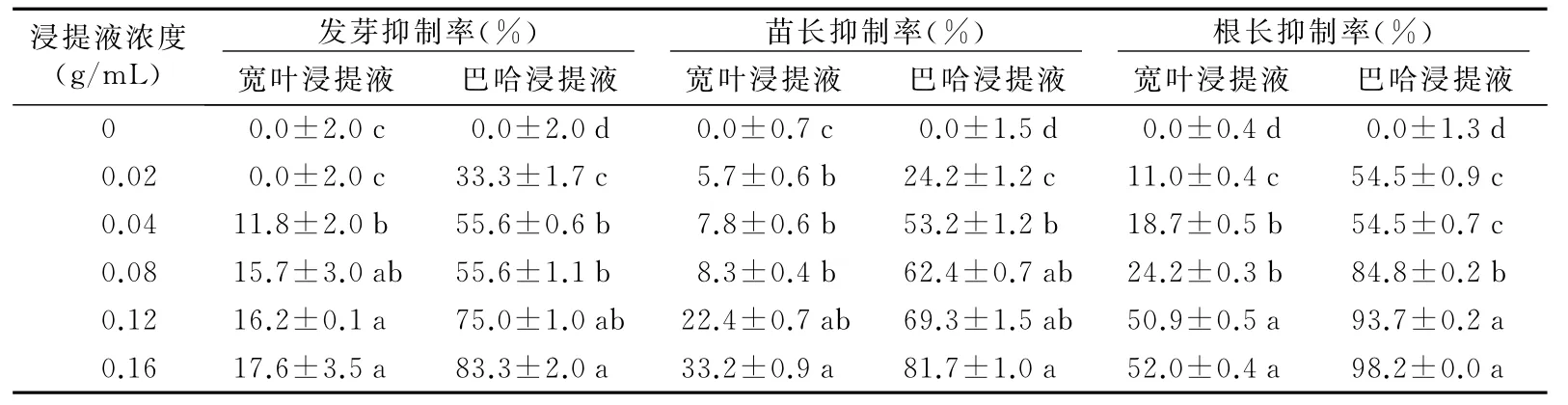
表2 2种雀稗属牧草种子浸提液对自身萌发及幼苗的抑制作用
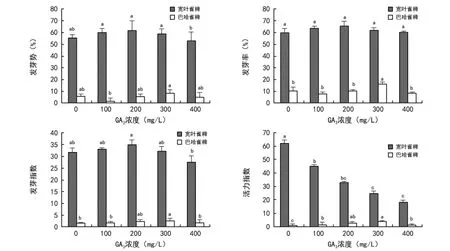
图2 GA 3对2种雀稗属牧草种子萌发的影响
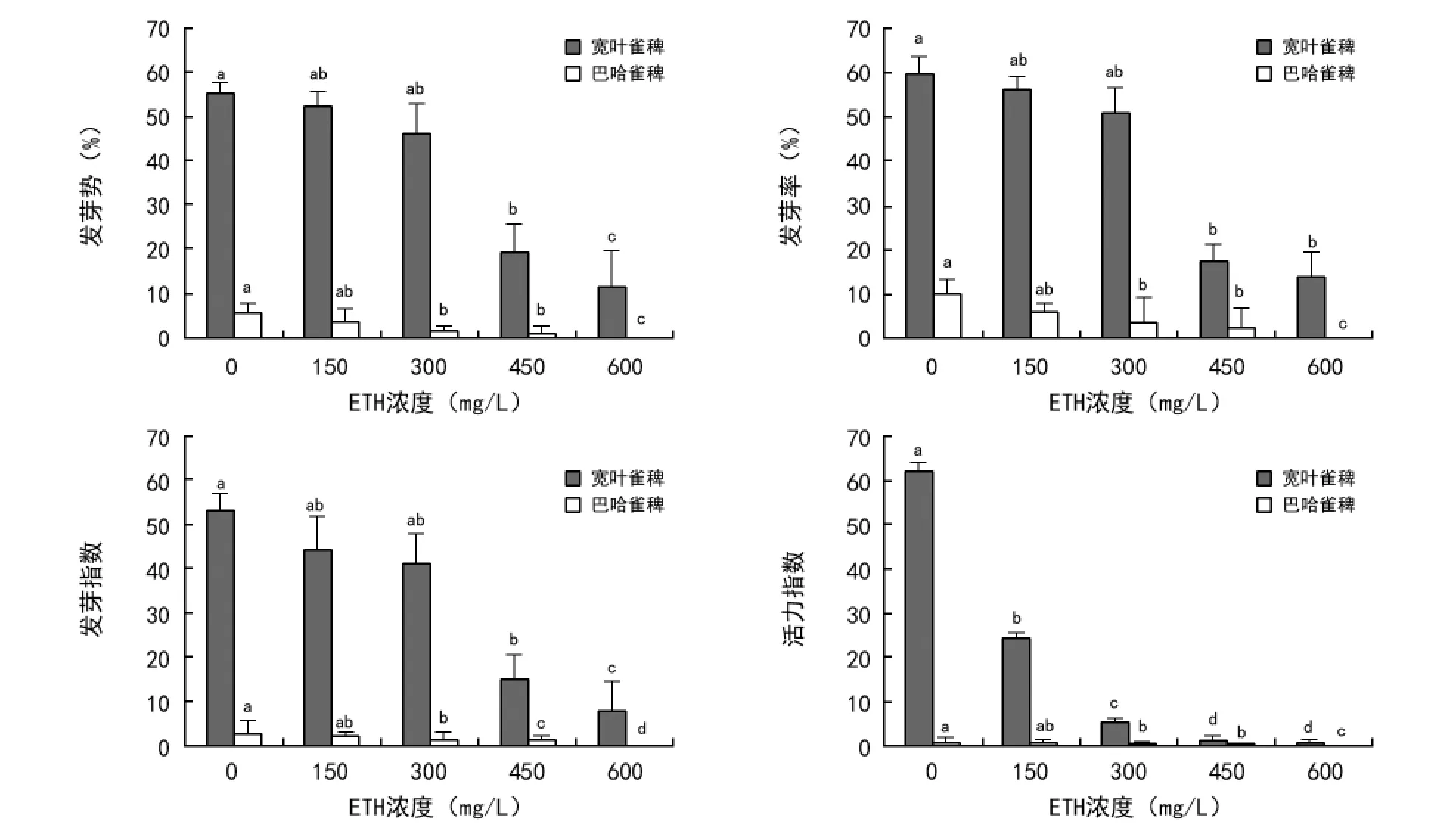
图3 ETH对2种雀稗属牧草种子萌发的影响
2.4.3 IAA处理
IAA对2种雀稗属牧草种子萌发有明显的抑制作用(图4)。2种雀稗属牧草种子的各项指标与对照组相比较差异显著(p<0.05)。当IAA浓度为150 mg/L时,宽叶雀稗的发芽势、发芽率、发芽指数和活力指数依次显著下降了20.6%、9.3%、13、38。当IAA浓度为300 mg/L时,巴哈雀稗的发芽率和活力指数依次显著下降了5.3%、0.6。
2.5 复合处理
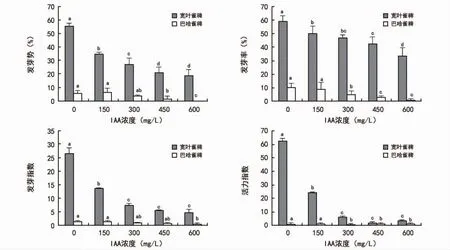
图4 IAA对2种雀稗属牧草种子萌发的影响
复合处理对宽叶雀稗种子萌发有抑制作用,对巴哈雀稗种子萌发有促进作用(表3)。随着H2SO4处理时间增长及GA3浓度增大,宽叶雀稗种子各项指标均呈下降的趋势,与对照组相比较差异显著(p<0.05)。适当的复合处理使巴哈雀稗种子萌发各项指标呈上升趋势,与对照组相比较差异显著(p<0.05)。经2.5,5 min和10 min的H2SO4处理均能显著提高巴哈雀稗种子的发芽势、发芽率、发芽指数和活力指数,其中5 min H2SO4处理,促使巴哈雀稗种子的发芽势、发芽率、发芽指数和活力指数达到最大值,依次显著增加了37.4%、35.3%、11.4、12.6。5 min H2SO4+各浓度的GA3、10 min H2SO4+各浓度的GA3(除400 mg/L)浸种处理能显著提高巴哈雀稗的发芽指数。2.5 min H2SO4+200 mg/L GA3浸种处理、5 min H2SO4+400 mg/L GA3、10 min H2SO4+100 mg/L GA3和10 min H2SO4+200 mg/L GA3浸种处理能显著提高巴哈雀稗的活力指数。因此,适宜的H2SO4+GA3的复合处理组合仅能提高巴哈雀稗的发芽指数和活力指数,而5 min H2SO4处理对巴哈雀稗种子萌发效果最佳。
3 讨 论
种子休眠是种子在不适宜萌发条件下的自我保护行为,也是植物在进化过程中对恶劣环境的适应性策略[1112]。但实际生产中,种子休眠带来发芽率低、萌发速度慢、长势不一致等诸多不利因素。打破种子休眠是植物得以推广的重要前提,而了解种子的休眠机理是打破种子休眠的必要条件。本研究发现,2种雀稗属牧草种子生活力强且种子吸水性均不受种皮影响。但2种雀稗属牧草种子的发芽率分别为59.3%、10.0%,都具有明显的休眠现象。造成种子休眠的因素很多,如不利的环境、种皮的机械障碍、内源激素的抑制等。有研究表明,浓硫酸有强烈的腐蚀性,浸种后可使种皮角质变薄,增加种皮的通透性,减轻种皮对于种子萌发的阻力[1315]。经浓 H2SO4处理后,宽叶雀稗的种子萌发指标均不同程度降低,说明浓H2SO4对宽叶雀稗不影响,并且浓H2SO4对种子萌发和幼苗生长造成了损伤。浓H2SO4处理后巴哈雀稗种子发芽势、发芽率、发芽指数和活力指数提高,在5 min H2SO4处理后4个指标均达到最大值,显著高于对照,说明巴哈雀稗种皮存在机械障碍,限制了胚根突破种皮。2种雀稗属牧草种子内均含有较强的萌发抑制物。2种雀稗属牧草种子浸提液浓度达到0.16 g/m L时,宽叶雀稗种子发芽抑制率达17.6%,巴哈雀稗种子发芽抑制率达83.3%。这与李兵兵等[16]对于麻花秦艽种子研究结果一致,麻花秦艽种子内也含有抑制白菜及自身的种子萌发的抑制物质。慕小倩等的研究也指出,曼陀罗种子中存在水溶性萌发抑制物[17]。
根据Baskin[18]的理论可将种子休眠分为形态休眠、生理休眠、物理休眠、形态生理休眠和综合休眠5种类型。种子内胚发育完成但生长较弱,种皮能不限制水分吸收称为生理休眠(physiological dormancy,PD)。综合休眠(combinational dormancy,PY+PD)是指种子种皮具有机械障碍,同时有生理休眠的特点。以上结果表明,内源抑制物是2种雀稗属牧草种子休眠的原因之一,浓H2SO4处理可以解除巴哈雀稗种子的休眠。由此可知,宽叶雀稗种子休眠属于生理休眠,巴哈雀稗种子休眠属于综合休眠。
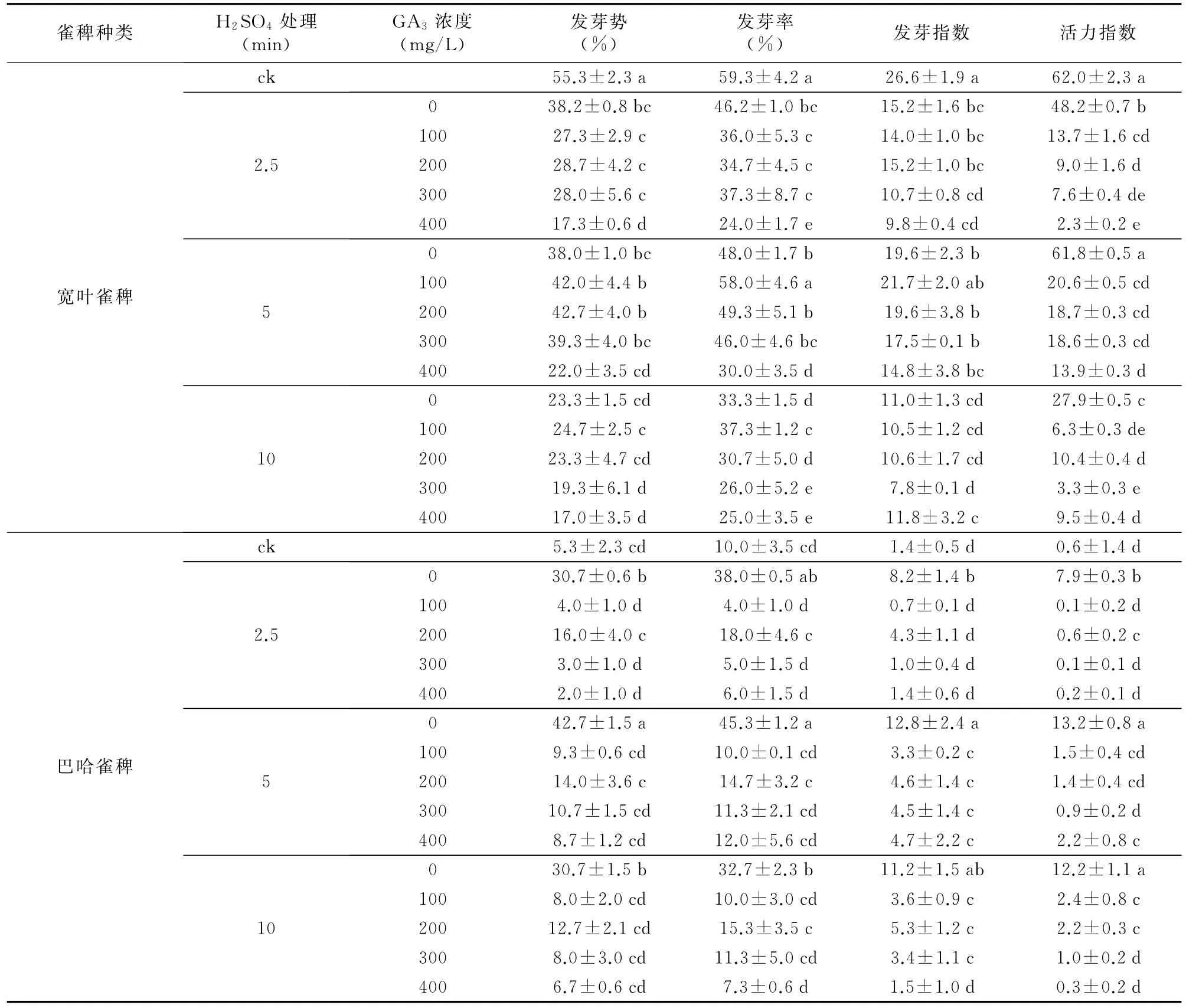
表3 复合处理对2种雀稗属牧草种子萌发的影响
为打破2种雀稗属牧草种子休眠,可采用激素浸种的方法来破除种子休眠[1920]。本研究发现,GA3、H2SO4以及复合处理对于巴哈雀稗种子萌发有促进作用。而GA3、IAA、ETH、H2SO4以及复合处理对于宽叶雀稗种子萌发均有抑制作用,IAA、ETH对巴哈雀稗种子萌发也产生抑制作用。这与陈梅等[21]研究结果一致,IAA、GA3浸种显著降低了蓖麻种子萌发率和发芽势。潘春柳等[22]GA3浸种处理对于绞股蓝种子萌发未起到促进作用。2种雀稗属牧草种子对相同的H2SO4处理、激素浸种,发芽效果不同。巴哈雀稗种子通过5 min H2SO4处理可以一定程度上打破因种皮机械障碍造成的休眠,而如何打破其生理休眠及宽叶雀稗种子的生理休眠还有待进一步的研究。
[1]中国科学院中国植物志编辑委员会.中国植物志(第十卷第一分册)[M].北京:科学出版社,1990.
[2]沈林洪,陈晶萍,黄炎和,等.宽叶雀稗的性状研究[J].福建热作科技,2001,26(2):18.
[3]马国华,赵南先.雀稗属细胞学和繁殖生物学研究[J].亚热带植物科学,2003,32(3):59.
[4]刘华荣,龙忠富,邓蓉,等.百喜草在退耕坡地种植中的水土保持效应及养羊效果[J].贵州农业科学,2012,40(7):145148.
[5]刘华荣,卢敏,龙忠富,等.水引发对百喜草萌发与幼苗生长的影响[J].种子,2012,31(5):9597.
[6]李式镜.繁殖方法、地表类型、坡向对宽叶雀稗的影响[J].亚热带水土保持,2014,26(4):2326.
[7]胡宏友,林鹏,杨志伟,等.宽叶雀稗群落生物量和生长规律的研究[J].福建农业学报,2002,17(4):226230.
[8]孟军江,刘正书,龙忠富.提高百喜草种子发芽率试验[J].贵州农业科学,2006,34(1):8081.
[9]景彦彪.种子生活力的四唑测定在质检中的运用[J].种子科技,2006(2):5758.
[10]赵敏,王炎.膜荚黄芪种子萌发抑制物质特性的初步研究[J].中草药,2001,32(7):643646.
[11]Birgit K,Marc A C,LeubnerMetzger G.Plant hormone interactions during seed dormancy release and germination[J].Seed Science Research,2005,15:281307.
[12]杨荣超,张海军,王倩,等.植物激素对种子休眠和萌发调控机理的研究进展[J].草地学报,2012,20(1):945946.
[13]周芝琴,李廷山,胡小文.莎草科4种植物种子休眠与萌发特性的研究[J].西北植物学报,2013,33(9):1 8851 890.
[14]宋超,王跃华,赵钢,等.不同酸处理对苦荞种子萌发和幼苗生长的影响[J].种子,2015,34(8):7982.
[15]Ayumi TanakaOda,Tanaka Kenzo,Kenji Fukuda.Optimal germination condition by sulfuric acid pretreatment to improve seed germination ofSabina vulgaris Ant[J].Journal of Forest Research,2009,14:251256.
[16]李兵兵,魏小红,徐严.麻花秦艽种子休眠机理及其破除方法[J].生态学报,2013,33(15):4 6314 638.
[17]慕小倩,史雷,赵云青,等.曼陀罗种子休眠机理与破眠方法研究[J].西北植物学报,2011,31(4):683689.
[18]Baskin J M,Baskin C C.A classification system for seed dormancy[J].Seed Science Research,2004,14:116.
[19]罗富成,郭轶敏,彭健,等.外源激素对纳罗克非洲狗尾草种子休眠的破除效果[J].草业科学,2015,32(3):406412.
[20]Khan M A,Ungar I A.Effect of germinateon promoting compounds onthe release of primary and saltenforced seed dormancy in the halophyte Sporabolus arabicus Boiss[J].Seed Science,2001,29:299306.
[21]陈梅,李培旺,蒋丽娟.外源激素对蓖麻营养生长及花芽分化的影响[J].中南林业科技大学学报,2011,31(7):8690,114.
[22]潘春柳,邓志军,黄燕芬,等.绞股蓝种子休眠机理及其破除方法研究[J].西北植物学报,2013,33(8):1 6581 664.
