贵州糯质小麦的分子标记辅助育种研究
2018-01-17辛智海隋建枢丁延庆何庆才张立异
程 斌, 辛智海, 高 旭, 隋建枢, 曹 宁, 丁延庆, 何庆才, 张立异
(1.贵州省农业科学院旱粮研究所, 贵阳550006; 2.贵州大学生命科学院, 贵阳550025)
在水稻、玉米和高梁等谷类作物中都存在由自然变异形成的糯性类型,并有糯性品种(系)应用于生产。然而,同为谷类作物的普通小麦,迄今为止自然界尚未发现其糯性类型。1993年日本学者发现,在控制小麦的籽粒直链淀粉合成中,有一种酶起着主要作用,这种酶就是颗粒结合淀粉合成酶(Granule-bound starch synthase I,简称GBSSI),也称 Waxy蛋白。直链淀粉含量较高的小麦存在Waxy蛋白,而直链淀粉含量很低的小麦缺少甚至没有 Waxy蛋白,Waxy蛋白的存在与否决定着谷物的糯性和非糯性,编码Waxy蛋白的等位基因被命名为Wx基因。普通六倍体小麦(Triticum aestivumL.,AABBDD)含有3种Wx 蛋白亚基:Wx-A 1、Wx-B 1和 Wx-D 1,分别位于染色体7 AS、4AL和7DS上,它们相应的表达型等位基因为Wx-A1a、Wx-B1a、Wx-D1a,相应的缺失型为 Wx-A1b、Wx-B1b、Wx-D1b[1]。任一种蛋白亚基的缺失或失活可导致直链淀粉含量降低,一方面可能是更多物质参与支链淀粉合成,导致直链淀粉合成的绝对量下降;另一方面可能是直链淀粉含量下降,支链淀粉含量不变,导致直链淀粉相对量的减少。3个蛋白亚基均存在天然缺失,如日本小麦品种关东107缺失Wx-A 1和Wx-B 1蛋白亚基,中国地方品种白火麦缺失 Wx-D 1蛋白亚基,其相应基因被分别命名为Wx-A1b、Wx-B1b和Wx-D1b。Nakamura等[2]在关东107小麦和白火麦杂交后代中选育出了世界上第一个直链淀粉含量在0.6%~0.7%之间的糯小麦。
糯小麦的低直链淀粉含量这一特性使其在面条加工业、淀粉加工业及其它工业上有着重要的用途。比如可以提高面条的品质;低直链淀粉品种穗不易发芽,避免收获前的产量损失,还能避免加工中α-淀粉酶活性升高造成的面粉质量下降;糯小麦的面粉可以用于配粉,提高面条的品质,改善馒头的白度,延长速冻食品的货架寿命;糯小麦还可以用于生产环保塑料、糯米纸类食品包装纸、硬纸板、浓缩剂、浆糊、涂料原料、纺织业的打浆剂等;特别是糯小麦在酿酒方面具有较大利用价值。赵国君等研究表明,在酒厂生产条件下,糯小麦白酒有相对较高的出酒率和杂醇类物质含量、适中的酸类和酯类物质含量、较低的醛类物质含量,糯小麦白酒在气味和口感方面优于其它试验组白酒[3]。贵州是白酒的主产区,对酿酒原料需求大,选育出适应贵州种植的酒用糯小麦,在改善贵州白酒品质的同时,还可以增加农民收益,实现双赢的局面。
分子标记辅助育种技术(Marker Assisted Selection,MAS)是利用与目标性状紧密连锁的DNA分子标记对作物目标性状进行间接选择,在早代就能够对目标基因的转移进行准确、稳定的选择,而且克服隐性基因再度利用时识别的困难,从而加速育种进程,提高育种效率,选育抗病、优质、高产的新品种。MAS技术在小麦的分子育种中得到了广泛应用。在糯小麦的 MAS中,舒守贵等[4]以中国春糯性位点全套近等基因系为研究材料,用小麦Wx基因的6个STS标记和1个CAPS标记进行了筛选;张晶等[5]对173份小麦的蛋白质亚基进行分子标记扫描并构建了多重 PCR;王亮等[6]利用 Wx-A 1、Wx-B 1和 Wx-D 1位点的3个STS标记对250份新疆小麦品种Wx基因的组成进行了鉴定,同时测试了185份冬、春小麦品种的淀粉糊化特性。
为了提高适应贵州生产的抗病糯小麦的育种效率,本实验采用 Wx-B1、Wx-A1、Wx-D1基因的分子标记[7-8],对本地优良品系与糯小麦的杂交后代进行Wx基因鉴定与筛选,评估分子标记在糯质小麦MAS育种中的应用,为加快糯性小麦新品种的选育奠定基础。
1 材料与方法
1.1 材 料
本实验采用小麦品系俞糯麦、自育品系0117以及杂交F2代的56个单株为试验材料。俞糯麦为不携带任何3个Wx基因的全糯质小麦材料,由重庆地区农科所提供。自育品系0117是一个综合性状较好并具有良好抗性的完全非糯质小麦品系,由贵州省农业科学院旱粮研究所选育并提供。
1.2 Wx基因检测标记
实验中使用的3对Wx基因分子标记中,与等位基因Wx-A1a/b和Wx-D1a/b连锁的标记是SSR标记,而与Wx-B1a/b连锁的标记是STS标记。它们名称、序列信息及扩增片段大小如表1所示。
1.3 DNA提取及PCR分析
亲本及群体种子发芽,幼苗培养至一叶一心,基因组DNA的提取采用CTAB法[9],略做改动,将DNA样品稀释到50ng/μL备用。
PCR 扩增SSR 引物根据http://www.graingenes.org公布的引物序列,由上海捷瑞生物工程有限公司合成。在 MJ Research PTC-200型PCR仪上进行扩增反应。PCR反应体系(15μL):DNA 模板5.0 μL;10×Buffer 2.0μL;MgCl21.2μL;2.5mmol/L dNTP 0.4μL;10mmol/L 引物各0.8μL;2.5U/μL Taq酶0.2μL;ddH2O 4.6μL。
基本反应条件:94℃3min;94℃2min,58℃/61℃1min(视引物退火温度而定),72℃2min,35个循环;72℃延伸10min;10℃保存。取3μL扩增产物在6%非变性连续PAGE上恒压(130~150V),电泳2~2.5h,银染,凝胶自动成像系统观察、照相。或者取12.5μL扩增产物在0.8%的琼脂糖胶上100V,电泳30min,EB染色,凝胶自动成像系统观察、照相。
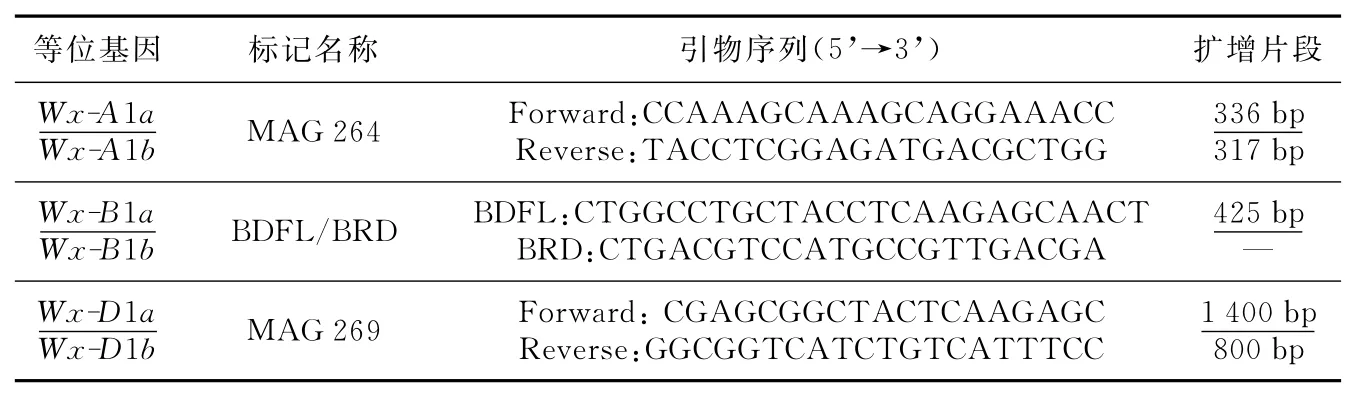
表1 Wx基因的分子标记
1.4 统计学分析
本研究利用Excel软件对实验数据进行统计和卡方验证分析。卡方验证是将实际比数与理论比数进行比较,以确定二者的符合程度,从而确定某一分离比例是否能用某种遗传规律去解释。计算公式为:
卡方值(X2)=(观测值-理论值)2/理论值。
2 结果与分析
2.1 Wx基因标记扫描结果
自育品系0117是完全非糯质小麦,其基因型为Wx-A1a、 Wx-A1a/Wx-B1a、 Wx-B1a/Wx-D1a、Wx-D1a,而俞糯麦是全糯质小麦,其基因型Wx-A1b、Wx-A1b/Wx-B1b、Wx-B1b/Wx-D1b、Wx-D1b。利用与3个糯质基因Wx-A1、Wx-B1和Wx-D1紧密连锁的分子标记 Mag 264、BDFL/BRD和 Mag 269扫描2个亲本以及56个F2代的单株,结果如图1所示。
Mag 264为共显性标记(SSR),获得2个扩增片段分别为336bp和317bp,其中317bp片段与糯质等位基因位点Wx-A1b连锁。56个F2后代中,10个单株携带非糯质的等位基因位点Wx-A1a,基因型为Wax-A1a、Wax-A1a,为非糯质小麦;14个单株携带糯质的等位基因位点Wax-A1b,基因型为Wax-A1b、Wax-A1b,为糯质小麦;其余25个单株是杂合体,基因型为Wax-A1a、Wax-A1b,为非糯质小麦,另外有7个单株未检测到条带。利用卡方检验,在显著水平p>0.05时,X2=0.714,说明该位点在F2代群体分离比符合AA∶Aa∶aa=1∶2∶1的分离比(图1,表2)。
BDFL/BR为显性标记(STS),PCR扩增产生一个425bp片段,与非糯质的等位基因Wx-B1a紧密连锁。56个F2后代中,32个单株携带此片段,说明它们的 基因型 为Wx-B1a、Wx-B1a 或Wx-B1a、Wx-B1b,应为非糯性小麦;24个单株没有此位点,说明其基因型为Wx-B1b、Wx-B1b,为糯性小麦。利用卡方检验,在p>0.05时,X2=0.002,说明F2代分离比符合(BB+Bb)∶bb=3∶1(图2,表2)。
Mag 269为共显性标记(SSR),但是在PCR扩增产物结果中却表现为显性标记,可能是Wx-D1基因3’端大片段缺失的杂合体DNA结构会影响PCR的扩增[8],PCR 扩增获得2个片段分别为1 400bp和800bp,其中800bp片段与糯质基因Wx-D1b连锁。56个F2后代中,22个单株携带非糯质的等位基因位点Wx-D1a,为非糯质小麦;34个单株携带糯质的等位基因位点Wx-D1b。该位点在F2代的分离符合DD∶(Dd+dd)=1∶3的分离比(X2=0.136,p>0.05)(图3,表2)。
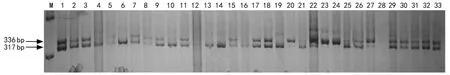
图1 标记Mag 264在品系0117和俞糯麦的F2代群体部分单株的PCR扩增产物

图2 标记BDFL/BR在品系0117和俞糯麦的F2代群体部分单株的PCR扩增产物

图3 标记Mag269在品系0117和俞糯麦的F2代群体部分单株的PCR扩增产物

表2 F2后代Wx基因位点扫描结果

续表2
2.2 F2代群体中糯质小麦出现的频率
对3个标记的扫描结果进行统计分析发现,在56个F2代分离群体中,3个基因位点都存在的材料有4株(7.14%);单缺失 Wx-A1a 或 Wx-B1a 或 Wx-D1a基因位点的材料编号分别为5(8.93%)、8(14.29%)和19(33.93%);Wx-A1a 和Wx-B1a 基因位点同时缺失的材料为5株(8.93%);Wx-A1a 和 Wx-D1a 基因 位点 同 时 缺 失 的 材 料 为 4 株 (7.14%);Wx-B1a 和Wx-D1a基因位点同时缺失材料为11株(19.64%);3个基因位点都缺失的全糯质单株未发现。
3 讨 论
贵州酿酒的历史悠久,糯小麦具有良好的酿酒特性,但是贵州省内缺乏具有推广价值的糯性小麦,省外引进的糯质小麦品种易感条锈病、白粉病和赤霉病等病害,无法适应贵州的生态气候环境,因此选育综合性状优良、产量高的糯性小麦新材料拥有巨大市场前景和科研价值。糯性小麦鉴定方法很多,比如利用半粒种子可以进行碘染色检测,但只能鉴定糯与非糯,无法鉴定部分糯小麦类型。改良的Waxy蛋白SDS-PAGE电泳方法虽简化了步骤,降低了成本,但Wx-B1和Wx-D1迁移率非常接近,仍难以区分,且该方法需要破坏种子,在大量筛选和分离后代检测中的应用也受到限制。Wx-A1b、Wx-B1b和Wx-D1b都是隐性基因,利用传统育种通常需要较长的育种年限;并且当只有1~2个隐性基因存在时,即使纯合体也很难根据表型对其进行直接选择。因此,分子标记辅助选择是培育不同支链淀粉含量小麦品种的最有效方法。
近年来,根据Wx基因的已知序列,相继开发出了3个位点的分子标记[7-11]和这些分子标记在基因型鉴定中具有快速、准确和简单等诸多优点,在植株整个发育时期和任何部位均可取材检测。段军[12]利用糯质基因分子标记鉴定出12个株系的全糯蓝粒小麦;马红勃[13]以扬麦17(红皮)和扬麦01-2(白皮)2个背景的wx基因近等基因系,对不同遗传背景和栽培环境下材料的品质特性进行了研究;许立奎等[14]利用多重PCR技术鉴定F2代群体内的糯质基因;杨芳萍等[15]利用糯质基因分子标记对甘肃小麦糯质蛋白分布进行研究,结果表明Wx-B1b基因从西向东南部逐渐降低;普布卓玛[16]通过杂交、回交以及自交等方法将3个糯蛋白缺失基因聚合在一个小麦遗传背景中。
本研究利用糯质基因特异分子标记,在F2代分离群体内发现单个缺失Wx基因材料的数目依次为Wx-D1a最 多、Wx-B1a 其 次、Wx-A1a 最 少,但 是 未能发现同时缺失3个Wx基因的全糯质小麦株系,这应该与分离群体较小有关。根据孟德尔分离定律,位于不同染色体上3个等位基因(Aa/Bb/Dd)的分离情况中,3个隐形等位基因同时出现的频率为1.56%(1/64)。由于F2代分离群体只有56个,3个隐形基因同时出现的理论值应该等于0.875,所以在群体中没有检测到同时缺失3个Wx基因的株系也属正常。理论上1 000个F2代群体只能获得16株全糯小麦,如果还需要考虑抗病和高产等其他性状,F2代群体还需要进一步增加。因此,为了选育具有较好综合性状的抗病全糯质小麦,需要扩大候选群体大小(>2 000),或者利用部分糯性小麦品系间的杂交,比如F2代群体内单缺失wx-A1a的5个单株与缺失wx-B1a+wx-D1a的11个单株杂家,再利用回交、聚合杂交等方法提高全糯质小麦的选育效率。
4 结 论
本次实验采用自育品系0117和俞糯麦作为亲本,对他们的杂交后代利用Wx基因分子标记筛选糯质小麦。在显著水平p>0.05时,3个糯质基因在F2代中的分离比例符合预期比例,并检出了不同Wx基因组合的小麦单株,但是未能检测出3个基因都缺失的全糯质小麦单株。本研究结果表明,在生产实践中利用标记辅助选择技术,结合传统的育种经验,可以加快贵州省高产、糯质小麦的创新及应用。
[1]Murai J,Taira T,Ohta D.Isolation and characterization of the three Waxy genes encoding the granule-bound starch synthase in hexaploid wheat[J].Gene,1999,234(1):71-79.
[2]Nakamura T,Yamamori M,Hirano H,Hidaka S,Nagamine T..Production of waxy(amylose-free)wheats[J].Molecular Genetics and Genomics,1995,248(3):253-259.
[3]赵国君,徐智斌,冯波,等.糯小麦的酿酒特性研究[J].中国农业科学,2013,46(6):1 127-1 135.
[4]舒守贵,王涛.利用回交法与Wx基因分子标记辅助选择培育糯性小麦[J].遗传,2006,28(5):563-570.
[5]张晶,张晓科,梁强,等.基于173份小麦评价糯蛋白亚基基因(Wx)的分子标记和构建其多重PCR体系[J].农业生物技术学报,2011,19(3):417-426.
[6]王亮,穆培源,徐红军,等.新疆小麦品种Wx基因组成及其淀粉糊化特性研究[J].麦类作物学报,2010,30(6):1 017-1 022.
[7]Nakamura T,Vrinten P,Saito M,Konda M.Rapid classification of partial waxy wheat using PCR-based markers[J].Genome,2002,45(6):1 150-1 156.
[8]刘迎春,朱惠兰,程顺和,等.小麦 Wx-A1和 Wx-D1位点的PCR分子标记[J].麦类作物学报,2005,25(1):1-5.
[9]Dellaporta SL,Wood J,Hicks JB.A plant DNA mini-preparation:Version II[J].Plant Molecular Biology Reporter,1983,1(4):19-21.
[10]Shariflou MR,Sharp PJ.A polymorphic microsatellite in the 3’end of‘waxy’genes of wheat,Triticum aestivum[J].Plant Breeding,1999,118(3):275-277.
[11]Shariflou MR,Hassani ME,Sharp PJ.A PCR-based DNA marker for detection of mutant and normal alleles of the Wx-D1gene wheat[J].Plant Breeding,2001,120(120):121-124.
[12]段军.蓝糯小麦资源筛选及农艺性状分析[D].山西农业大学,2014.
[13]马红勃.小麦wx基因近等基因系的评价及品质特性研究[D].南京农业大学,2013.
[14]许立奎,潘彬荣,岳高红,等.抗白粉病糯性小麦的多重PCR分子鉴定技术[J].核农学报,2014,28(7):1 203-1 207.
[15]杨芳萍,杨莉,郭莹,等.甘肃小麦品种(系)面筋强度和糯蛋白基因分布规律研究[J].麦类作物学报,2015,35(7):933-939.
[16]普布卓玛.利用分子育种选育西藏糯小麦[J].西藏农业科技,2015(4):36-40.
