栀子苷磷脂复合物的制备及评价
2018-01-17余小
, ,,,余小, ,,
(浙江工业大学 药学院,浙江 杭州 310014)
栀子苷(geniposide, GE)是茜草科植物栀子(Gardenia jasminoides Ellis)干燥成熟果实中提取精制而得的环烯醚萜苷类化合物,目前已证实栀子花根中也存在该物质[1].药理研究表明:其具有降血糖[2]、抗炎镇痛[3]、抗哮喘、防辐射及抗肿瘤[4-5]等功效.虽然栀子苷水溶性强,但是脂溶性弱,膜渗透性差,导致口服生物利用度低,限制了其药效的发挥.磷脂复合物是从上世纪发展起来的一种新型制剂技术,是通过磷脂分子与活性成分在适宜的环境中发生相互作用,形成一种不同与原化合物的复合物.药物形成复合物之后理化性质和生物学特性都会发生改变,脂溶性增强并显著提高与生物膜的相容性,促进吸收,改善生物利用度[6].早前郑琴等[7]虽然对栀子苷磷脂复合物也进行了研究,但仅仅着重于体外表征,体内并未作出评价.本实验将栀子苷制备成磷脂复合物,优化了制备工艺,并进行了鉴别、理化性质和大鼠模型口服生物利用度考察.
1 仪器与材料
1.1 仪器与试剂
仪器:BS224S型电子分析天平(北京赛多利斯仪器系统有限公司);85-2型磁力搅拌器(上海志威电器有限公司);Agilent 1200 高效液相色谱仪(美国安捷伦科技有限公司);17R型高速低温离心机(美国Thermo公司).
试剂:栀子苷原料药(质量分数为95%,宝鸡市方晟生物开发有限公司);大豆磷脂(质量分数为60%,北京源华美磷脂科技有限公司,口服级);栀子苷对照品(批号110749201115,中国药品生物制品检定所);甲醇、乙腈为色谱纯,其余试剂均为分析纯.
1.2 实验动物
SD大鼠,180~200g,雄性,购于浙江省医学科学院,许可证SCXK(浙)2008-1033.
2 方法与结果
2.1 磷脂复合物的制备
称取一定量的磷脂,用溶剂充分溶解后,加入栀子苷,磁力搅拌,反应一定时间后,减压蒸发回收溶剂,真空干燥至呈淡黄色蜡状固体即得.
将磷脂复合物加入适量氯仿,使其中的磷脂和磷脂复合物充分溶解,过滤,滤渣用少量氯仿润洗后挥干,滤渣中残留栀子苷即为未复合部分,测定未复合栀子苷质量浓度,复合率[8]计算公式为

式中:M0为初始投料量;Mt为未复合量.
2.2 磷脂复合物制备工艺条件优化
2.2.1 磷脂复合物中栀子苷的质量浓度测定
色谱条件:色谱柱为Welchrom-C18(4.6×250 mm,5 μm);流动相为20%乙腈水溶液;流速为1.0 mL/min;检测波长为238 nm;柱温为25 ℃;进样量为10 μL.
线性范围:用甲醇配制质量浓度为5.75,11.5,23,46,92,184,368 μg/mL栀子苷对照品溶液,以质量浓度为横坐标(X),峰面积为纵坐标(Y)进行线性回归,得回归方程Y=13.823X+9.681,R2=1,栀子苷在5.75~368 μg/mL范围内线性关系好.
2.2.2 磷脂复合物工艺条件优化
以复合率为评价指标,单因素考察确定栀子苷磷脂复合物制备工艺为:以无水乙醇为反应溶剂,m(栀子苷)∶m(磷脂)=1∶4,栀子苷质量浓度为16.7 mg/mL,40 ℃条件下反应1.5 h.三批验证试验平均复合率为99.19%,RSD为0.4%,表明按所优化工艺制备的磷脂复合物复合率高,且工艺稳定.
2.3 磷脂复合物的表征
2.3.1 紫外(UV)分析
将栀子苷、磷脂和栀子苷磷脂复合物分别溶于甲醇,进行紫外扫描,结果显示,栀子苷与其复合物的紫外吸收曲线相同,均包含栀子苷和磷脂的特征吸收峰,表明栀子苷与磷脂形成复合物后发色团未发生变化,见图1.
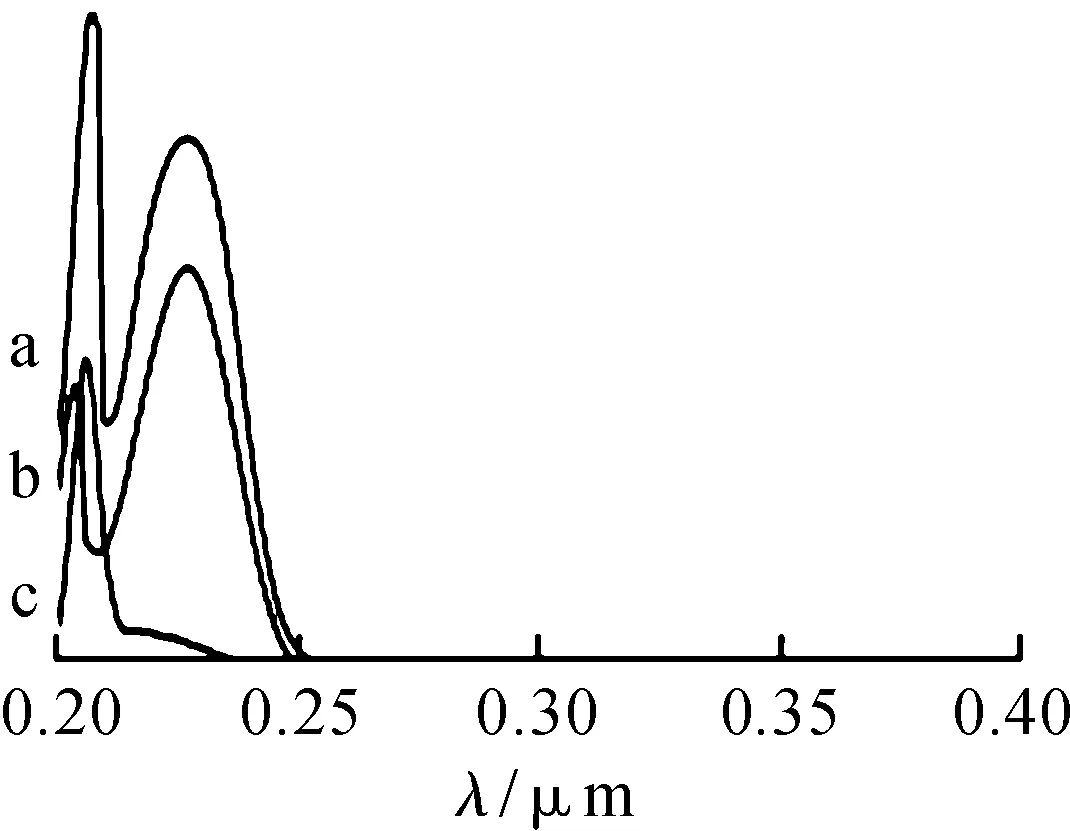
a—栀子苷磷脂复合物;b—栀子苷;c—磷脂图1 各物质的的UV图Fig.1 UV absorption spectra of different substances
2.3.2 红外光谱(IR)特性
分别取栀子苷、磷脂、物理混合物、栀子苷磷脂复合物适量,采用KBr压片法在400~4 000 cm-1的波长范围内进行IR扫描分析,结果显示,栀子苷的特征吸收峰为3 527.22 cm-1和3 437.98 cm-1(OH),磷脂特征吸收峰为3 309.46 cm-1(OH),2 925.9 cm-1和2 854.19 cm-1(CH),1 736.27 cm-1(C=O),1 220.55 cm-1(P=O),磷脂与栀子苷混合物红外吸收峰基本为磷脂和栀子苷的叠加,而磷脂复合物在3 341.46 cm-1处形成较宽大的OH吸收峰且与栀子苷相比向低场方向移动,推测栀子苷与磷脂分子间有氢键形成,见图2.
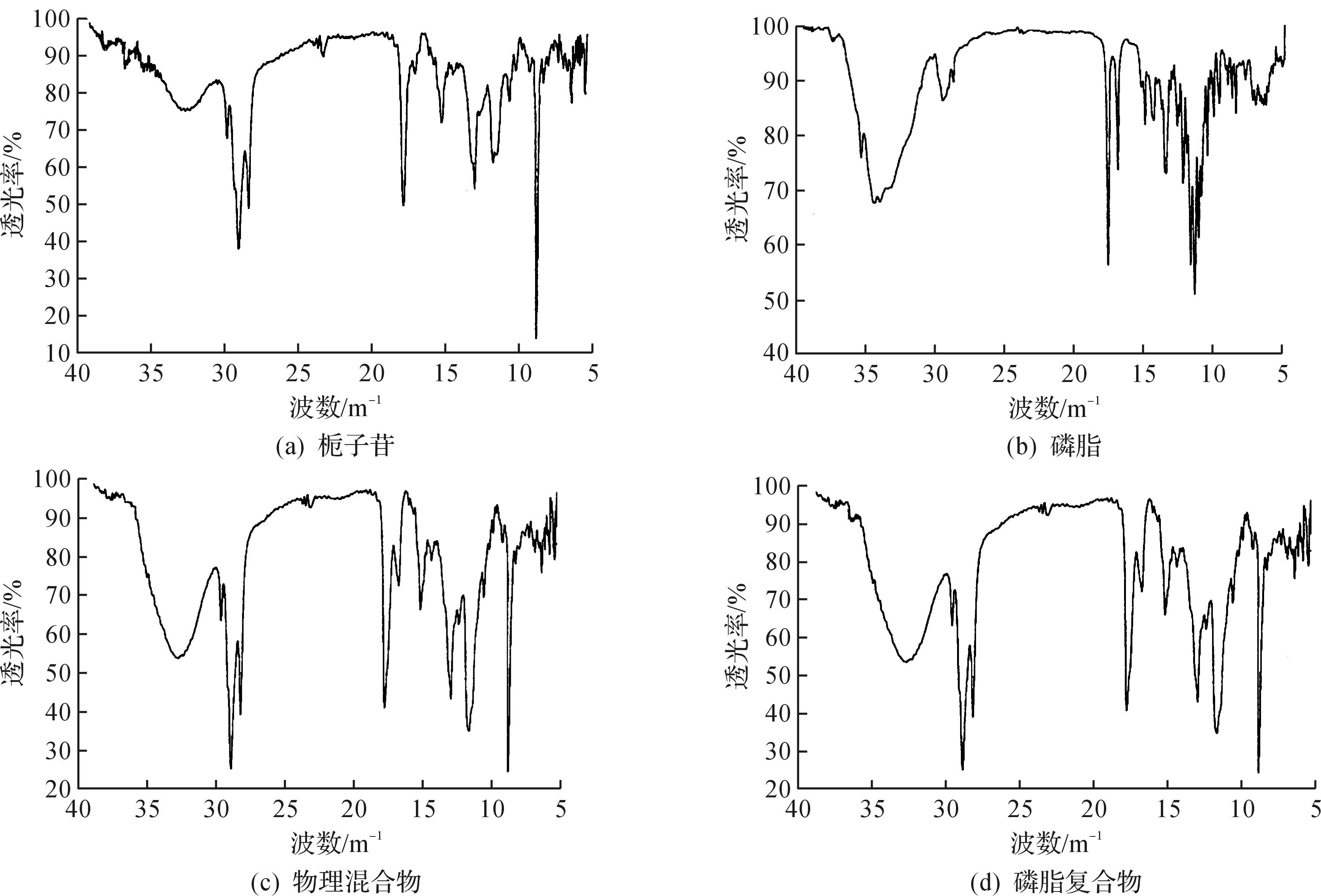
图2 各物质的红外谱图Fig.2 IR absorption spectra of different substances
2.3.3 差示扫描量热法(DSC)
称取适量栀子苷、磷脂和处方比例的物理混合物和复合物进行DSC扫描分析,扫描范围为室温至200 ℃,升温速度为10 ℃/min,N2流速为100 mL/min,结果显示栀子苷在162 ℃有特征吸热峰,混合物中仍可见栀子苷以及磷脂的特征吸热峰,复合物中栀子苷特征峰消失,但是在108 ℃下出现一明显吸热峰,推测栀子苷与磷脂形成了复合物过程中发生了相互作用,其热力学性质发生了改变,见图3.
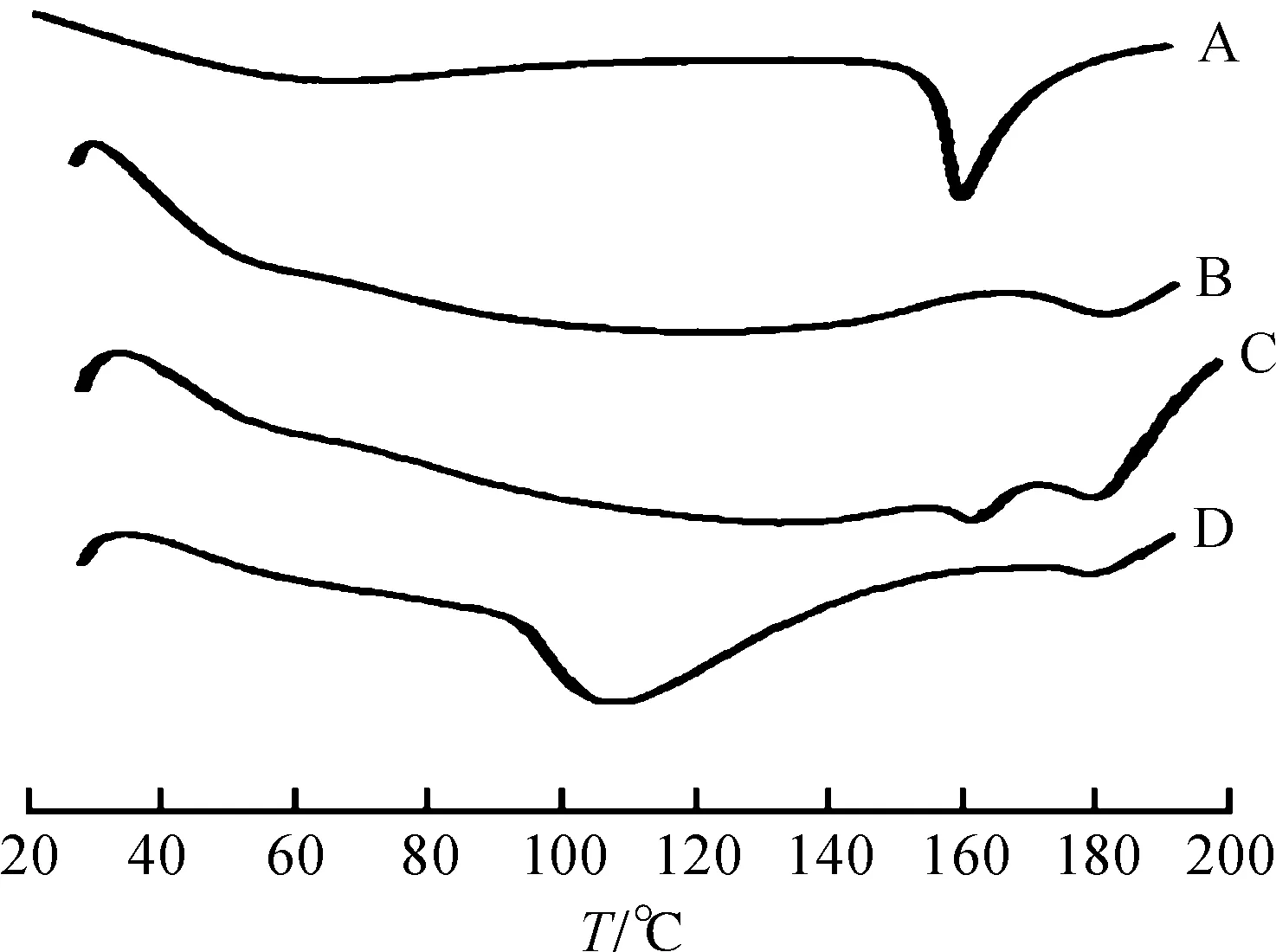
A—栀子苷;B—磷脂;C—物理混合物;D—磷脂复合物图3 各物质的DSC图谱Fig.3 DSC spectra of different substances
2.3.4 脂溶性考察
取过量栀子苷、物理混合物及复合物,加入适量正辛醇,超声30 min,得到栀子苷、混合物及复合物的正辛醇过饱和溶液,以3 000 r/min离心10 min,测定上清液中栀子苷含量并计算溶解度.各物质在正辛醇溶解度:栀子苷为4.5 mg/mL,磷脂复合物为66.38 mg/mL,物理混合物为25.61 mg/mL.结果表明栀子苷在形成复合物之后在正辛醇中溶解度明显提高,物理混合物中磷脂有一定的增溶作用但效果不如复合物,可见栀子苷与磷脂形成复合物之后脂溶性有较大提升,约为栀子苷的15倍.
2.4 栀子苷大鼠口服生物利用度考察
2.4.1 药动学样品制备
雄性SD大鼠24只,随机分为4组,每组6只,实验前禁食12 h,分别按100 mg/kg(以栀子苷计)灌胃给予栀子苷、栀子苷磷脂复合物,于给药后10,20,30 min,1,1.5,2.5,4,6,8,12 h经眼底静脉取血0.5 mL于肝素化离心管中,5 000 r/min离心10 min,取血浆200 μL于1.5 mL离心管中,加入800 μL甲醇,涡旋3 min,5 000 r/min离心5 min,取上清液,氮气吹干,100 μL甲醇复溶,10 000 r/min离心10 min,取上清液测栀子苷的质量浓度.
2.4.2 大鼠血浆样品中栀子苷质量浓度测定
色谱条件:色谱柱为Welchrom-C18(4.6×250 mm,5 μm);流动相为12%乙腈水溶液;流速1.0 mL/min;检测波长238 nm;柱温25 ℃;进样量20 μL.在选定色谱条件下,溶剂及空白血浆对测定无干扰,见图4.

图4 栀子苷在血浆中的HPLC色谱图Fig.4 HPLC chromatograms of GE in plasma
方法学考察[9]:用甲醇配制质量浓度分别为0.32,0.8,1.6,4,8,20,40,100,200 μg/mL的系列栀子苷对照品溶液.取口服给药组空白血浆200 μL,分别加入0.32,0.8,1.6,4,8,20 μg/mL栀子苷对照品溶液各50 μL,以血浆中栀子苷对照品质量浓度为横坐标(X),峰面积为纵坐标(Y),得回归方程Y=52.77X+4.177 6,R2=0.999 5,表明血浆药物质量浓度在0.08~5 μg/mL范围内线性关系良好.取4,40,200 μg/mL质量浓度的对照品溶液加入空白血浆中,于一日内连续测定5次,连续测定5日,计算得日内和日间RSD均小于8.2%.另分别精密量取高、中、低质量浓度的对照品溶液加入空白血浆中,每组3份,测定栀子苷的质量浓度,结果显示平均回收率分别为98.78%,104.76%,106.73%;RSD分别为4.51%,7.05%,1.44%.结果表明:该方法专属性强,适用于大鼠血浆样品中栀子苷质量浓度测定.
2.4.3 药动学结果
两组血药质量浓度—时间曲线经DAS2.0统计拟合后,其结果见图5,药动学参数见表2.结果表明了栀子苷及复合物在大鼠体内符合一室模型.通过比较药动学参数可知栀子苷形成复合物之后口服吸收最大浓度明显提高、达峰时间明显缩短,说明栀子苷形成磷脂复合物之后由于其脂溶性提高,吸收速率显著提高,生物利用度为栀子苷的1.63倍.

图5 口服给药后大鼠平均血药质量浓度—时间曲线图Fig.5 Concentration-time curves of GE after ig adiministration of GE and GE-PLC
Table2Mainpharmacokineticparametersafterigadministrationinrats

药动学参数1)栀子苷栀子苷磷脂复合物2)Ka/min-10.038±0.0390.199±0.191t1/2/min69.32±8.8363.66±9.24MRT/min121.10±18.9594.53±16.07Cmax/(mg·L-1)0.822±0.1481.79±0.26**tmax/min67.5±18.7227.5±45*AUC/(mg·L-1·min-1)137.80±34.88225.28±94.26*
注:1)Ka为吸收速率常数;t1/2为末端消除半衰期;MRT为平均滞留时间;Cmax为药峰质量浓度;tmax为达峰时间;AUC为曲线下面积;2) 与栀子苷比较:*为P<0.05,**为P<0.01.
3 结 论
笔者在前人研究的基础上,对栀子苷磷脂复合物的制备进行了工艺优化,还利用大鼠模型进行了体内药动学研究.采用溶剂挥发法制备栀子苷磷脂复合物,UV和IR分析结果均显示出复合过程中并没有新物质形成,DSC显示栀子苷在与磷脂形成复合物之后其特征吸收峰消失,这一现象在混合物中并未出现,说明栀子苷在复合物中以无定型状态存在,热力学性质发生改变.形成复合物后,栀子苷脂溶性提高了约15倍,这可能是由于药物与磷脂发生相互作用,屏蔽了药物的极性基团,表现出脂溶性[10].药动学研究表明:形成磷脂复合物后栀子苷的口服吸收明显得到改善,tmax缩短、Cmax提高,这与其本身脂溶性提高的同时磷脂促进了栀子苷与细胞膜的结合密切相关[11].由此可见,栀子苷磷脂复合物的研究可为栀子苷高效口服制剂的开发提供研究基础,同时磷脂复合物也可为生物药剂学第三类药物(水溶性好、膜渗透差)提供一种新的技术手段.本试验中栀子苷磷脂复合物的在体肠吸收情况还有待进一步探索.
[1] 施湘君,于海宁,占扎君,等.畲药山里黄根的苷类成分研究[J].浙江工业大学学报,2010,38(2):142-144.
[2] KIMURA Y, OKUDA H, ARICHI S. Effects of geniposide isolated from gardenia jasminoides on metabolic alterations in high sugar diet-fed rats[J]. Chemical and pharmaceutical bulletin,1982,30(12):4444-4447.
[3] 方尚玲,刘源才,张庆华,等.栀子苷镇痛和抗炎作用的研究[J].时珍国医国药,2008,19(6):1374-1376.
[4] HSU H Y, YANG J J, LIN S Y, et al. Comparisons of geniposidic acid and geniposide on antitumor and radioprotection after sublethal irradiation[J]. Cancer letters,1997,113(1):31-37.
[5] HUANG H P, SHIH Y W, WU C H, et al. Inhibitory effect of penta-acetyl geniposide on C6 glioma cells metastasis by inhibiting matrix metalloproteinase-2 expression involved in both the PI3K and ERK signaling pathways[J]. Chemico-biological interactions,2009,181(1):8-14.
[6] 贾东升,赵江丽,施峰,等.淫羊藿苷元磷脂复合物的制备及其固体分散体研究[J].中草药,2010(9):1449-1453.
[7] 郑琴,岳鹏飞,王木生,等.栀子苷磷脂复合物的制备及表征[J].中国医药工业杂志,2011(3):198-200.
[8] 吴建梅,陈大为,刘艳丽.黄芩苷磷脂复合物制备工艺的研究[J].中国中药杂志,2001,26(3):166-169.
[9] 单伟光,陶蓉,宋必卫.α-倒稔子素亚微乳在大鼠体内的药动学及血浆蛋白结合率研究[J].浙江工业大学学报,2013,41(3):237-240.
[10] 万露,肖云芝,程玲,等.葫芦素B磷脂复合物制备,表征及体外抗肿瘤活性研究[J].中草药,2015,46(1):48-54.
[11] 吴慧仪,龙晓英,陈莉,等.磷脂复合物及其对中药活性成分透过生物膜的影响[J].中草药,2012,43(2):393-398.
