西红花花瓣不同烘干工艺提取物HPLC指纹图谱研究
2018-01-17,,
, ,
(浙江工业大学 药学院,浙江 杭州 310014)
西红花是鸢尾科(Iridaceae)番红花属(Crocus)植物番红花(Crocus sativus L.)干燥的柱头[1],又名藏红花、咱夫兰.元朝时由“天方国”传到西藏再传入中原,最早见于元朝饮膳太医忽思慧所著《饮膳正要》:“咱夫兰,味甘,平,无毒.主心忧郁积,气闷不散,久食令人心喜.”其入药部位花柱的产量极低,价格昂贵,被誉为“植物黄金”.西红花花瓣是制药工业中的副产物,含有许多的活性成分,已有学者从中分离得到黄酮、多糖、皂甙等物质[2-3],现代药理药效显示,西红花花瓣具有抗氧化、抗抑郁和抑制酪氨酸酶等[4-6]多种药理活性.目前已经分离得到了以山奈酚为苷元的黄酮苷类化合物、单萜类以及单苯环类化合物共35个.指纹图谱技术是国际公认的控制中药质量的最常用手段[7].相似度评价、主成分分析与聚类分析在中药指纹图谱研究中最常使用[8],通过聚类分析可以将对象集合中相近或者相似的对象聚集到同一个类中,最后得到几个不同的类划分[9].西红花花瓣不易储存,目前尚没有对西红花花瓣的烘干的统一标准,不同的烘干方法对西红花花瓣中主要化学成分影响的研究未见报道.本实验基于西红花花瓣的HPLC指纹图谱技术,探讨烘干工艺对对西红花花瓣化学成分的影响,并寻找最优烘干工艺.
1 仪器与试药
Agilent 1260 HPLC液相色谱仪(美国Agilent公司);KQ-100DE超声清洗器(昆山超声仪器有限公司);冷冻干燥机(北京博医康实验仪器有限公司);DHG-9240A电热恒温鼓风干燥箱(上海精宏实验设备有限公司);DZF-6050真空干燥箱(上海精宏实验设备有限公司);WD700微波炉(乐金电子电器有限公司);0.45 μm有机针孔过滤器(上海兴亚净化材料厂);乙腈、甲醇为色谱纯(美国Tedia公司);哇哈哈纯净水.
新鲜西红花花瓣(产地浙江省建德市三都镇和村,批次:2016年),经浙江工业大学大学王平教授鉴定为CrocussativusL.的新鲜花瓣;对照品山奈酚3-O-槐糖苷、异鼠李素3,4’-二-O-β-葡萄糖苷为实验室分离制得,经1H-NMR、13C-NMR鉴定结构.
2 试验方法
2.1 西红花花瓣的烘干方法
取新鲜西红花花瓣约10 g,精密称定,置于不同烘干设备中,按照表1的烘干参数进行干燥,取出,再次精密称定,然后将样品放置在干燥器中,备用,一式三份.测定样品脱水率,制作指纹图谱.新鲜西红花花瓣的脱水率公式为
脱水率=[(M1-M2)/M1]×100%
式中:M1,M2分别为脱水前后样品质量.

表1 样品参数及脱水率Table 1 Parameter and dehydration rate of samples
注:1) P1~P8为恒温鼓风干燥法;Z1~Z6为真空干燥法;L1为冷冻干燥法;W1~W8为微波干燥法.
2.2 待测液的制备
供试品溶液的制备:取西红花花瓣约100 mg,精密称定,置具塞锥形瓶中,加入70%甲醇溶液10 mL,称重,在40 ℃下超声提取40 min,采用70%甲醇溶液补足重量,摇匀,过滤,滤液再用0.45 μm有机微孔滤膜过滤,在4 ℃冰箱保存备用.
对照品溶液的制备:分别取山奈酚3-O-槐糖苷和异鼠李素3,4’-二-O-β-葡萄糖苷约10 mg,精密称定,置10 mL容量瓶中,加甲醇定容至刻度,摇匀,溶液用0.45 μm有机微孔滤膜过滤,在4 ℃冰箱保存备用.
2.3 色谱条件
Agilent ZORBAX SB-C18色谱柱(250 mm×4.6 mm,4 μm);流速0.5 mL/min;检测波长260 nm;柱温35 ℃;进样量20 μL;流动相为乙腈(A)和0.05%三氟乙酸(B);梯度洗脱时A和B的比例为0~5 min,5∶95;5~10 min,20∶80;10~25 min,20∶80;25~30 min,50∶50;30~40 min,70∶30.
2.4 方法学考察
1) 精密度的考察.取同一份供试液,按2.3项下的色谱条件,连续进样5次,结果各特征色谱峰峰面积和保留时间的相对标准偏差(Relative standard deviation RSD)分别小于2.36%和1.01%.采用“中药色谱指纹图谱相似度评价系统A版”软件计算相似度为1,说明仪器的精密度较好.
2) 重复性的考察.取同一批花瓣样品5份,分别按照2.2项下的方法制备成供试液,依次进样,结果各特征色谱峰峰面积和保留时间的RSD值分别小于2.69%和1.34%,采用“中药色谱指纹图谱相似度评价系统A版”软件计算相似度均高于0.99,说明该方法的重复性较好.
3) 稳定性的考察.取同一份供试液,分别于0,4,8,12,16 h分别进样,结果各特征色谱峰峰面积和保留时间的RSD值分别小于3.68%和0.96%,采用“中药色谱指纹图谱相似度评价系统A版”软件计算相似度均高于0.99,说明供试液在16 h之内稳定性较好[10].
2.5 指纹图谱的建立
以鲜花瓣为参照,取新鲜西红花花瓣500 mg,按2.2项下方法制备供试液,供试液指纹图谱共标识9个共有特征峰(图1).其中,6和7号峰分别对应山奈酚3-O-槐糖苷和异鼠李素3,4’-二-O-β-葡萄糖苷(17.02,19.01 min).
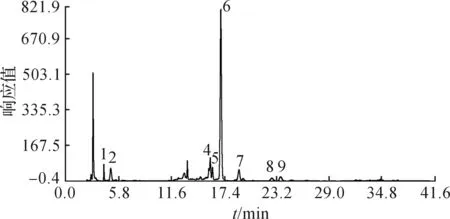
图1 新鲜西红花花瓣指纹图谱Fig.1 The fingerprint of fresh petals of Crocus sativu
3 试验结果
3.1 西红花花瓣脱水率
不同参数下西红花花瓣脱水率如表1所示,普通恒温鼓风干燥箱在70,80 ℃下干燥45 min、真空干燥箱在70,80 ℃下干燥45 min、冷冻干燥和微波干燥,脱水率均高于80%,冷冻干燥较为费时,不利于工业生产,而微波干燥效率较高.4种干燥方法的脱水速率为,微波干燥>普通干燥、真空干燥>冷冻干燥.
3.2 干燥工艺对西红花花瓣指纹图谱特征峰的影响
西红花花瓣中含有大量黄酮类成分,在260 nm(带Ⅱ)处有较强的紫外吸收,且该波长下指纹图谱中的色谱峰个数较多,分离度良好,故设260 nm为检测波长.由于编号P1,P2,P3,Z1,4批样品含水量较多,很快发生霉变,故没有进一步分析,其余的19批不同干燥条件下的花瓣样品(S2~S20)和新鲜花瓣样品(S1)的指纹图谱色谱峰叠加图如图2所示.采用“中药色谱指纹图谱相似度评价系统A版软件”[11]进行相似度分析,以鲜花瓣图谱为参照谱[12],结果各谱图相似度大于0.97(表2),说明不同烘干方法和烘干工艺的样品化学成分种类差异性较小,物质基础没有变.共有的9个特征峰峰面积除以样品干重的RSD值计算结果显示,峰2,3,5,8的RSD值均大于50%,其中峰8高达92.70%(表3),说明不同样品虽然化学成分种类差异较小,但化学成分含量差异性明显,因此烘干方法和烘干工艺主要对西红花花瓣中化学成分含量造成较大影响.图2显示,整体上烘干后的样品各色谱峰强度均有所减弱,尤其是2,3,6,8号色谱峰.普通干燥P7(S6)、真空干燥Z3(S9)样品在该浓度下无法检测到2号峰,且普通干燥条件下所有的3号峰强度大幅度减弱.另外,普通干燥、真空干燥和冷冻干燥条件下所有的8号色谱峰强度也大幅度减弱,但微波干燥对该峰的保留较佳.通过计算,W6色谱峰峰面积/干重的合计值最高,说明中高火微波8 min可以较好的保留西红花花瓣的化学成分,该烘干方法为干燥花瓣的较佳方法.

表2 不同样品HPLC指纹图谱相似度Table 2 Similarity of fingerprint from different samples

表3 9个共有峰的峰面积/干重的RSDTable 3 RSD of peak area/ dry weight from 9 common peaks

S1—鲜花瓣样品;S2~S6—P4~P8;S7~S11—Z2~Z6;S12—L1;S13~S20—W1~W8图2 20批样品HPLC指纹图谱Fig.2 HPLC fingerprint of 20 samples
3.3 聚类分析
将上述19批西红花花瓣烘干样品的峰面积/干重的值导入SPSS 19.0软件,如图3所示,可将样品大致分为2大类,分别为W7,W2,W4,W5,W3,Z4,W8,P7,W6,Z6和Z5聚为一类,这些样品中9个特征峰的峰面积/干重的合计值排在前11位;另外一些样品聚为一类.说明通过工艺优化,微波干燥法、真空干燥法和普通干燥法均能有效保留样品中有效成分的含量,样品之间的指纹图谱相似度良好.除了W1,微波干燥均属于第一类,说明微波干燥对西红花花瓣化学成分影响较稳定,且微波干燥法的烘干时间远少于其他方法,有利于节约能源,说明微波干燥法是一种良好的西红花花瓣干燥方法.

图3 19批西红花花瓣样品平均连接树状图Fig.3 Dendrogram clustering of 19 petals of Crocus sativu
4 结 论
研究了普通鼓风干燥、真空干燥、微波干燥和冷冻干燥法对西红花花瓣的脱水效率和化学成分含量的影响,通过比较这些样品的HPLC指纹图谱,发现烘干方法和烘干参数主要是对化学成分的含量影响较大,而对化学成分的种类影响较小.结合脱水效率值,发现微波干燥法是一种良好的西红花花瓣干燥方法,当用中高火微波烘干8 min时,样品中有效成分含量最高,该方法可应用于工业化生产.此外,笔者建立的西红花花瓣HPLC指纹图谱也为该品种质量评价与控制提供了科学依据.
[1] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出社,2010:129-130.
[2] 高文远,朱大元.番红花的化学及药理研究概况[J].中草药,1999,30(5):389-391.
[3] 宋纯清,徐任生,黄哲天,等.西红花花被化学成分研究[J].中药材,1985(4):17-19.
[4] KETI Z, KETAN C, RUPARELIA, et al. Petals ofCrocussativusL. as a potential source of the antioxidants crocin and kaempferol[J]. Fitoterapia,2015,107:128-134.
[5] BASTI A A, MOSHIRI E, NOORBALA A A, et al. Comparison of petal ofCrocussativusL. and fluoxetine in the treatment of depressed outpatients: a pilot double-blind randomized trial[J]. Neuro-psychopharmacol biol,2007(31):439-442.
[6] 李佳颖.番紅花与狭叶白藓皮之成分、活性研究及Phenanthraquinones之合成[D].台南:国立成功大学,1991.
[7] 郝志龙,金心怡,江丽萍,等.化学指纹图谱在茶叶品质鉴定与控制上的应用[J].亚热带农业研究,2009,5(1):60-63.
[8] 梁现蕊,肖钦钦.静态顶空-气相色谱法用于柳叶蜡梅挥发油指纹图谱研究[J].浙江工业大学学报,2015,43(5):567-572.
[9] 陆亿红,翁纯佳.基于三角模糊数的不确定性数据聚类算法[J].浙江工业大学学报,2016,44(4):405-409.
[10] 李行诺,马旭,楚楚,等.泽泻指纹图谱研究[J].浙江工业大学学报,2013,41(2):143-146.
[11] 韩燕全,洪艳,左冬,等.不同干燥工艺干姜的UPLC特征指纹图谱比较研究[J].中成药,2012,34(6):987-990.
[12] 韦熹苑,俞洁东,卢小玲.不同干燥工艺虎杖提取物UPLC指纹图谱的研究[J].广东化工,2016,43(6):26-27.
