2型糖尿病患者骨代谢指标与体质量指数、胰岛β细胞功能及骨密度相关性研究
2018-01-17叶斌
叶 斌
1948年Albright等[1]发现糖尿病与骨质疏松相关,初次提出了糖尿病性骨质疏松的概念。流行病学调查发现糖尿病性骨质疏松及继发骨质疏松性骨折比普通人群显著升高[2],糖尿病患者骨质疏松的发病率高达20%~60%,且骨折的危险性明显高于普通人群[3]。糖尿病并发骨质疏松是骨骼系统出现的严重慢性并发症,是引起持久严重疼痛和功能障碍的主要因素,通常早期无明显症状,以骨量减少、骨质微观结构变化为特征,常常在轻微外力导致骨折后才被发现[4]。1型糖尿病引起的骨密度下降而导致骨质疏松的结论已较为肯定[5],主要与胰岛β细胞功能衰竭有关,而2型糖尿病(T2DM)患者骨量变化可能受多种因素影响引起。本研究探讨2型糖尿病骨转换指标与体质量指数、骨密度、胰岛β细胞功能之间的关系。
1 临床资料
1.1 一般资料 2013年3月—2015年3月在浙江省丽水市人民医院内分泌科住院的2型糖尿病(T2DM)患者120例,根据2000年WHO推荐的亚洲成年人肥胖诊断标准[6],根据不同体质量指数(BMI)分为三组:BMI≥24kg/m2为肥胖组,18.5Kg/m2≤BMI<24kg/m2为体质量正常组,BMI<18.5g/m2为体质量不足组。其中肥胖组40例,男20例,女20例,平均年龄(60.57±9.23)岁,平均病程(6.6±1.24年);体质量正常组39例,男21例,女18例,平均年龄(61.32±9.78)岁,平均病程(6.8±1.46)年;体质量不足组 41例,男 20例,女 21例,平均年龄(59.86±8.96)岁,平均病程(6.4±1.36)年。同时收集118名在我院体检健康人群为健康对照组,男60名,女58名,平均年龄(60.32±9.22)岁。各组性别、年龄比较差异无统计学意义(P>0.05)。本研究获得我院伦理委员会批准,所有受试者均签署知情同意书。
1.2 纳入及排除标准 纳入标准:所有患者均符合1999年WHO糖尿病诊断标准[7],均应用二甲双胍片(格华止)口服控制血糖,均未使用其它口服降糖药物及胰岛素控制血糖。排除标准:1型糖尿病、甲状腺功能亢进症、甲状旁腺功能亢进症、继发性糖尿病、继发性肥胖、激素应用史、维生素D及抗骨质疏松药物使用史、影响骨代谢药物使用史、脆性骨折病史、急慢性感染炎症、严重肝肾功能不全、妊娠、哺乳、口服避孕药物史。
表1 各组研究对象生化指标比较(±s)

表1 各组研究对象生化指标比较(±s)
注:与健康对照组比较,*P<0.05;BMI:体质量指数;HbA1c:糖化血红蛋白;Ca:钙;P:磷;FPG:空腹血糖;FINS:空腹胰岛素;HOMA-β:稳态模型评估的胰岛β细胞功能
组别肥胖组体质量正常组体质量不足组健康对照组例数403941118BMI(kg/m2)28.32±4.31*21.22±2.5017.63±0.86*21.21±2.52HbA1c(%)8.9±2.3*9.0±1.9*8.8±2.1*5.1±1.4Ca(mmol/L)2.19±0.092.18±0.082.17±0.092.22±0.08P(mmol/L)1.28±0.241.30±0.271.31±0.221.25±0.18FPG(mmol/L)7.45±1.81*7.81±2.90*7.34±2.60*5.38±2.22FINS(mIU/L)7.65±1.925.21±1.68*3.74±1.83*6.66±1.78HOMA-β 84.66±12.8752.50±11.76*44.38±12.14*88.52±10.23
表2 各组研究对象骨代谢指标比较(±s)
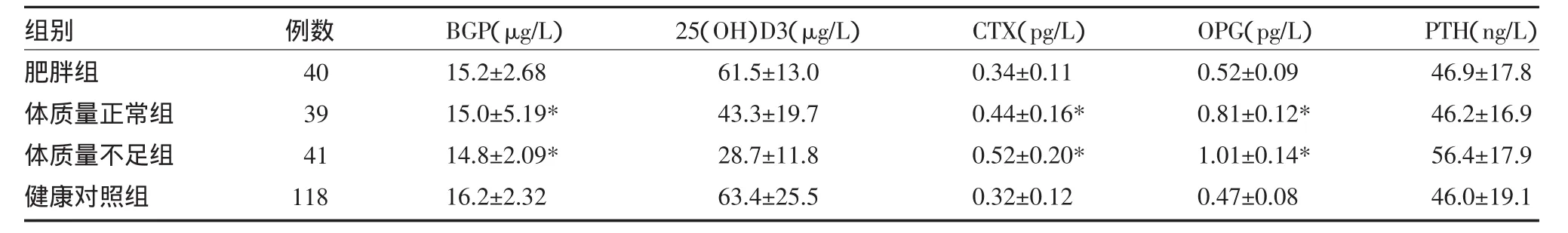
表2 各组研究对象骨代谢指标比较(±s)
注:与健康对照组比较,*P<0.05;BGP:骨钙素;25(OH)D3:25羟维生素 D3;CTX:Ⅰ型胶原羧基末端肽;OPG:骨保护素;PTH:甲状旁腺激素
组别肥胖组体质量正常组体质量不足组健康对照组例数403941118BGP(μg/L)15.2±2.6815.0±5.19*14.8±2.09*16.2±2.3225(OH)D3(μg/L)61.5±13.043.3±19.728.7±11.863.4±25.5CTX(pg/L)0.34±0.110.44±0.16*0.52±0.20*0.32±0.12OPG(pg/L)0.52±0.090.81±0.12*1.01±0.14*0.47±0.08PTH(ng/L)46.9±17.846.2±16.956.4±17.946.0±19.1
2 方法
2.1 BMI及生化指标检测 统一由专人使用同一测量工具测定身高、体质量,并计算BMI,BMI=体质量(kg)/身高2(m2)。所有受试者清晨空腹(禁食禁饮8h)抽静脉血,采用美国贝克曼公司AU5821全自动生化仪测定空腹血糖(FPG)、血钙(Ca)、血磷(P),采用爱尔兰Trinity Biotech公司Hb9210分析仪检测糖化血红蛋白(HbA1c),采用美国贝克曼公司DXI800分析仪仪测定甲状旁腺激素(PTH),采用德国西门子公司ADVIA Centaur XP全自动免疫分析仪检测空腹胰岛素(FINS),采用德国罗氏公司Cobas e411分析仪检测 25羟维生素 D3(25-(OH)D3)、Ⅰ型胶原羧基末端肽(CTX)、骨钙素(BGP)、骨保护素(OPG)。
2.2 评估胰岛β细胞功能 应用稳态模型[8]评估胰岛 β细胞功能(HOMA-β)。β 细胞功能=20×FINS(mU/L)/[FPG(mmol/L)-3.5]。
2.3 骨密度测定 应用美国通用GE公司的双能X线骨密度仪测定受试者,腰2椎体(L2)正位腰椎骨密度及股骨颈(FN)骨密度,单位g/m2,并自动计算T值评分,按照1998年WHO骨质疏松诊断标准[9],T≤-2.5SD为骨质疏松,T>-2.5SD为非骨质疏松。
2.4 统计学方法 应用SPSS19.0统计软件,计量数据均值用平均数±标准差(±s) 表示。非正态分布数据经对数转化为正态分布后进行分析,采用t检验,相关分析采用Pearson相关分析,P<0.05为差异有统计学意义。
3 结 果
3.1 各组生化指标比较 体质量不足组、体质量正常组及肥胖组FPG、HbA1c均高于健康对照组(P<0.05),而体质量不足组及体质量正常组HOMA-β指数、FINS均低于健康对照组(P<0.05)。肥胖组HOMA-β指数、FINS与健康对照组比较无明显差异(P>0.05)。体质量不足组、体质量正常组及肥胖组Ca、P与健康对照组比较差异无统计学意义(P>均0.05)。见表1。
3.2 各组骨代谢指标比较 体质量不足组及体质量正常组CTX、OPG均高于健康对照组(P均<0.05),而体质量不足组及体质量正常组BGP均低于健康对照组(P 均<0.05)。肥胖组 CTX、OPG、BGP 与健康对照组比较无明显差异(P均>0.05)。见表2。
3.3 各组骨密度比较 体质量不足组和体质量正常组L2及股骨颈骨密度均显著低于健康对照组(P均<0.05),而肥胖组L2及股骨颈骨密度与健康对照组比较,差异无统计学意义(P>均0.05)。见表3。
表3 各组研究对象骨密度比较(g/m2,±s)

表3 各组研究对象骨密度比较(g/m2,±s)
注:与健康对照组比较,*P<0.05;L2:第 2腰椎;FN:股骨颈
组别肥胖组体质量正常组体质量不足组健康对照组例数403941118L21.28±0.131.22±0.13*0.80±0.11*1.30±0.12FN 1.03±0.080.91±0.09*0.75±0.14*1.02±0.10
3.4 骨代谢指标与骨密度、体质量指数及胰岛β细胞功能相关因素分析 Pearson相关分析表明,CTX与 HOMA-β呈负相关(P<0.05),CTX 与 BMD呈负相关(P<0.05),CTX 与 BMI呈负相关(P<0.05),OPG与 HOMA-β 呈负相关(P<0.05),OPG 与 BMD呈负相关(P<0.05),OPG 与 BMI呈负相关(P<0.05),BGP与 HOMA-β 呈正相关(P<0.05),BGP与 BMD呈正相关(P<0.05),BGP 与 BMI呈正相关(P<0.05),PTH及 25(OH)D3与 BMD、BMI及 HOMA-β 均无明显相关性(P值均>0.05)。见表 4。
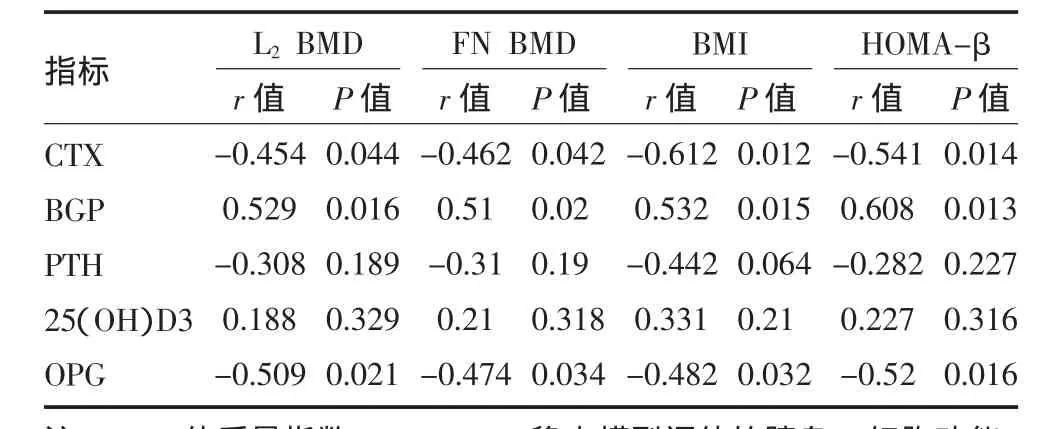
表4 各组研究对象骨代谢指标与骨密度、体质量指数及胰岛β细胞功能相关因素分析
4 讨论
研究显示,约50%糖尿病可并发骨质疏松,随着患者的寿命和病程逐渐延长,糖尿病骨质疏松呈上升趋势[10-11],已经成为严重社会健康问题。一项入选93例老年男性T2DM患者和125名健康老年男性对照者的研究显示,两组之间年龄、腰臀比、血压、BMI和睾酮水平差异无统计学意义,但T2DM组骨量减少或骨质疏松的发生率明显高于对照组(59.14%比24%,P<0.01)[12]。我们研究表明体质量不足及体质量正常T2DM患者的骨密度、HOMA-β指数明显低于健康对照组(P<0.05),与上述研究认为T2DM患者骨量减少及骨质疏松发生率相对增高有相似之处,但肥胖组T2DM患者的骨密度、HOMA-β指数与健康对照组比较无明显差异(P>0.05),提示肥胖组骨密度相对较高。进一步作相关因素分析显示BGP与HOMA-β指数呈正相关,故我们推测肥胖似乎对骨有保护作用,可能是由于肥胖者外周脂肪组织中的睾酮向雌二醇转化及雄烯二酮向雌酮转化较多的缘故,肥胖使骨负荷增加,对骨形成有利刺激作用。肥胖和胰岛素抵抗患者常伴有血浆性激素结合球蛋白降低,导致游离雌激素和睾酮升高,有利于对抗骨量丢失,从而保持或使骨密度增加。更重要的是,胰岛素对骨生成有促进作用,它通过与成骨细胞表面的胰岛素样生长因子-1受体结合,刺激骨细胞增殖,刺激骨形成。而体质量下降组及体质量正常胰岛β细胞功能相对下降,致使胰岛素相对减少,当胰岛素不足时,其对骨组织内的糖蛋白和Ⅰ型胶原合成作用减弱,相对分解增多,导致骨基质减少,引起骨矿物质无处沉积而丢失;胰岛素具有抑制cAMP合成作用,可刺激骨吸收作相对增强,骨质丢失;同时胰岛素缺乏时,对成骨细胞合成骨钙素有抑制作用,使骨的转换率下降,骨形成减少;胰岛素对25-羟化酶有兴奋作用,可协同甲状旁腺激素调节α-羟化酶活性,当胰岛素缺乏时,该酶活性降低,从而影响肠对钙的吸收,引起骨量降低;成骨细胞表面有胰岛素受体,胰岛素缺乏时,促进骨细胞内氨基酸蓄积,骨胶原合成作用减弱,成骨细胞数量减少,活性降低[10-11]。糖尿病的高尿糖形成高渗透性利尿作用,导致对钙、磷、镁等重吸收显著下降,使尿钙、磷、镁过量丢失,致使血钙、磷、镁下降,低血钙及低血镁继发甲状旁腺功能亢进,引起甲状旁腺激素分泌增多,从而激活破骨细胞,使骨钙动员,骨质脱钙,骨密度下降[10-11,13]。长期高血糖,导致过多的糖基化终末产物形成,可影响蛋白质的理化性质,引起成骨作用降低,可刺激破骨细胞吸收因子肿瘤坏死因子-α、白细胞介素-6的形成增多,使骨吸收增加,导致骨量丢失[10,13]。
在骨质疏松发生过程中,BMD的改变较慢,这给骨质疏松的早期诊断和治疗带来了一定困难。而骨代谢标志物的变化相对骨密度变化要提早很多,可早期发现骨代谢异常,对早期诊断骨质疏松有重要价值。另外,骨代谢指标具有及时、敏感、特异等优点[14-15]。Dobnig等[16]研究发现T2DM患者具有较低PTH和BGP水平。BGP由成骨细胞生成,是评估骨转换率及骨形成的特异性标志之一。一项横断面研究发现,血清BGP水平与血糖和躯体体脂含量呈负相关,与胰岛素敏感性以及分泌呈正相关[17]。血清BGP通过增强胰岛素对体内葡萄糖稳态其调节作用。动物实验结果表明,缺乏BGP的小鼠表现胰岛β细胞增殖能力减退、胰岛素抵抗以及内脏脂肪含量异常[18]。一项对日本老年男性的研究表明,血清非羧基的BGP的含量与研究人群的血糖指数以及胰岛素抵抗水平呈负相关(γ=-0.159,P<0.001;γ=-0.113,P<0.0001)[19]。临床观察 T2DM 患者血清总 BGP 浓度和非羧化BGP可能影响胰岛素的分泌以及体内葡萄糖耐受性[20]。OPG和核因子κΒ受体活化子配体(RANKL)是骨代谢过程中起调节作用的生物活性物质,OPG通过与RANKL竞争结合其受体核因子κΒ受体活化子而减弱破骨细胞的分化及成熟[21]。体内外研究均显示骨量的丢失与RANKL的上调及OPG的下调有关[22]。国内外研究均发现男性T2DM患者的OPG水平升高[23-24]。同样,女性T2DM患者的OPG水平也有升高趋势,其机制可能是为对抗糖尿病状态下骨吸收增强,但确切的机制还待进一步研究证实。我们研究发现,在T2DM不同体质量指数组中,其Ca、P、PTH、25(OH)D3水平与健康对照组无明显差异。而T2DM中正常体质量组及低体质量组CTX、OPG高于及健康对照组,BGP、HOMA-β指数前者低于后者(P<0.05),肥胖组 CTX、OPG、BGP、HOMA-β指数与健康对照组比较无明显差异。进一步相关因素分析显示 CTX、OPG与 BMI呈负相关,BGP与BMI呈正相关,CTX与HOMA-β指数呈负相关,BGP与HOMA-β指数呈正相关(P<0.05)。既往研究表明,常规临床化学检测虽可反应映体内激素状况及其对骨骼的刺激情况[25],但无法客观及时反映反应此时的骨转换状态,更无法预测骨密度的改变。但我们研究结果表明T2DM患者骨代谢指标CTX、BGP、OPG变化差异不仅在一定程度上反应体质量指数及胰岛β细胞功能的差异,而且同时也反映骨密度差异,故我们推测骨代谢指标可作为骨质疏松早期预测强有力指标。在欧美国家,已有大量流行病学调查表明,骨转换标志物有利于提供骨折风险信息,但仍需要循证医学证据进一步支持。另外,本研究不足之处在于未将性激素及不同性别纳入研究中,不能排除性别及性激素水平差异对上述研究结果的干扰,在今后研究中应将其纳入研究范畴中。
[1]Albright F,Reifenstein EC.The parathyroid glands and metabolic bone disease:selected studies[M].Philadelphia Baltimore:Williams&Wilkins Co,1948:188.
[2] SSaller A,Maggi S,Romanato G,et al.Diabetes and osteoporosis[J].Aging Clin Exp Res,2008,20(4):280-289.
[3] Schwartz AV,Sellmeyer DE,Strotmeyer ES,et al.Diabetes and bone loss at the hip in older black and white adults[J].J Bone Miner Res,2005,20(4):596-603.
[4]邱明才,戴晨琳.代谢性骨病学[M].北京:人民卫生出版社,2012:295.
[5] Hofbauer LC,Brueck CC,Singh SK,et al.Osteoporosis in patients with diabetes mellitus[J].J Bone Miner Res,2007,22(9):1317-1328.
[6]Obesity:preventing and managing the global epidemic.Report of a WHO consultation[J].World Health Organ Tech Rep Ser,2000,894(1):1-253.
[7]Alberti KG,Zimmet PZ.Definition,diagnosis and classification of diabetes mellitus and its complications.Part 1:diagnosis and classification of diabetes mellitus provisional report of a WHO consultation[J].Diabet Med,1998,15(7):539-553.
[8] Matthews DR,Hosker JP,Rudenski AS,et al.Homeostasis model assessment:insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man[J].Diabetologia,1985,28(7):412-419.
[9] WHO:Guideline for Preclinical evaluation and Clinical trials in Osteoporosis[S].1998,eneva.
[10]黄国良,张莹.糖尿病性骨质疏松的评价与对策[J].实用糖尿病杂志,2006,2(4):4-6.
[11]刘国良,刘英.糖尿病性骨质疏松及其治疗操作与评价[J].实用糖尿病杂志,2006,2(4):3-4.
[12] Chen HL,Deng LL,Li JF.Prevalence of Osteoporosis and Its Associated Factors among Older Men with Type 2Diabetes[J].Int J Endocrinol,2013,2013:285729.
[13]朱翔,章秋.糖尿病性骨质疏松及其影响因素[J].实用糖尿病杂志,2006,2(4):6-8.
[14]Clowes Jackie A,Peel Nicola FA,Eastell Richard.The impact of monitoring on adherence and persistence with antiresorptive treatment for postmenopausal osteoporosis:a randomized controlled trial[J].The Journal of clinical endocrinology and metabolism,2004,89(3):1117-1123.
[15] Clowes JA,Eastell R.The role of bone turnover markers and risk factors in the assessment of osteoporosis and fracture risk[J].Baillieres Best Pract Res Clin Endocrinol Metab,2000,14(2):213-232.
[16] Dobnig H,Piswanger-Solkner JC,Roth M,et al.Type 2diabetes mellitus in nursing home patients:effects on bone turnover,bone mass,and fracture risk[J].J Clin Endocrinol Metab,2006,91(9):3355-3363.
[17]Kanazawa I,Yamaguchi T,Tada Y,et al.Serum osteocalcin level is positively associated with insulin sensitivity and secretion in patients with type 2diabetes[J].Bone,2011,48(4):720-725.
[18] Lee NK,Sowa H,Hinoi E,et al.Endocrine regulation of energy metabolism by the skeleton[J].Cell,2007,130(3):456-469.
[19] Iki M,Tamaki J,Fujita Y,et al.Serum undercarboxylated osteocalcin levels are inversely associated with glycemic status and insulin resistance in an elderly Japanese male population:Fujiwara-kyo Osteoporosis Risk in Men(FORMEN)Study[J].Osteoporos Int,2012,23(2):761-770.
[20]Pittas AG,Harris SS,Eliades M,et al.Association between serum osteocalcin and markers of metabolic phenotype[J].J Clin Endocrinol Metab,2009,94(3):827-832.
[21] Lacey DL,Timms E,Tan HL,et al.Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation[J].Cell,1998,93(2):165-176.
[22] Shevde NK,Bendixen AC,Dienger KM,et al.Estrogens suppress RANK ligand-induced osteoclast differentiation via a stromal cell independent mechanism involving c-Jun repression[J].Proc Natl Acad Sci USA,2000,97(14):7829-7834.
[23]Rozas MP,Reyes GR,Garcia-Martin A,et al.Serum osteoprotegerin:bone or cardiovascular marker in Type 2diabetes males[J].J Endocrinol Invest,2013,36(1):16-20.
[24]陈陵霞,苗德,刘杰,等.2型糖尿病男性骨代谢生化指标与骨密度的变化[J].中国组织工程研究与临床康复,2010,14(50):9329-9332.
[25] Burshell AL,Moricke R,Correa-Rotter R,et al.Correlations between biochemical markers of bone turnover and bone density responses in patients with glucocorticoid-induced osteoporosis treated with teriparatide or alendronate[J].Bone,2010,46(4):935-939.
