马尾松不同叶型幼苗对干旱及复水的生长及生理响应1)
2018-01-15王好运吴峰吴昌明于淞朱小坤谢维斌
王好运 吴峰 吴昌明 于淞 朱小坤 谢维斌
(贵州大学,贵阳,550025) (贵州都匀国家马尾松良种基地)
水分亏缺严重制约着植物生长发育和生理活动,随着全球气候变化的加剧,我国干旱地区、半干旱地区的水分短缺问题日益严重[1]。通过研究不同干旱胁迫处理下植物生长状况及生理生化反应,分析其对干旱逆境的响应规律及适应能力,选育出适合不同土壤条件的树种幼苗,对提高造林成活率及旱区林木生产力具有重要的意义。大量的研究表明,不同干旱胁迫程度下植物生长及生物量分配发生了适应性改变[2-3],植物通过提高渗透调节物质积累量、增强保护酶活性等生理变化来减少渗透胁迫和氧自由基的危害[4-6]。因此,需要综合多项与抗旱性相关的生理指标,评价植物对不同干旱胁迫处理下的响应和适应能力。
马尾松(PinusmassonianaLamb)系松科松属,是我国分布较广泛的乡土造林树种,具有适应性强、生长快、生产力高等特点,是我国南方最主要的经济树种之一[7]。马尾松在其漫长的个体发育过程中,由于受到不同环境因子的影响,幼苗在形态、生理及其生长上均出现了变异,这种变异往往同林木经济性状和生理性状密切相关[8]。有研究发现,在马尾松1年生幼苗出圃时,会出现全初生条叶、全次生针叶及中间型等3种叶型幼苗[9],且3种叶型幼苗均达到出圃标准[10]。幼苗苗木活力的大小直接决定后期造林的成败,而苗木生理抗性是苗木活力的重要体现。目前,有关马尾松抗旱性的研究多集中在干旱胁迫下种子萌发、不同种源幼苗抗旱性及接种外生菌根条件抗性变化等方面[11-14],而不同叶型幼苗对干旱胁迫环境响应能力及适应机制的研究尚未见报道。为此,本试验采用盆栽法模拟自然干旱环境,分析持续干旱胁迫及复水条件下对不同叶型幼苗生长、生理反应及酶系统的影响,并利用隶属函数法对3种叶型幼苗进行抗旱性评价,旨在为叶形变异在马尾松苗木质量评价中的应用以及不同水分条件地区造林幼苗的选择提供理论和实践依据。
1 材料与方法
1.1 试验材料
本研究供试材料取自贵州省都匀市马鞍山林场国家马尾松良种基地,地处北纬26°169′~26°170′,东经107°623′~107°624′,海拔920 m左右,为中亚热带湿润气候,年均温15.8 ℃,年平均降水量1 400 mm。采用良种基地内1.5代种子园种子进行容器育苗,基质为马尾松林地表土,2016年4月初开始播种育苗,具体育苗及管理方法参考周政贤[8]总结的方法。
1.2 试验设计及处理
于2017年2月份,参照国家苗木质量评定标准[10],随机选择出圃合格的幼苗盆栽至贵州大学林学院苗圃温室内,按照叶型划分为Ⅰ类型(全初生条叶)、Ⅱ类型(中间型)和Ⅲ类型(全次生针叶)。容器规格为28 cm×20 cm,土质选用适合马尾松生长的黄壤土,土壤理化性质为pH值=5.3;有机质、全氮、全磷、全钾、碱解氮、有效磷质量分数分别为76.84、0.78、0.74、11.51、47.81、40.00 g·kg-1,速效钾质量分数为80.00 mg·kg-1。缓苗期间每天漫灌至土壤水分饱和。
待幼苗度过缓苗期正常生长后,选取生长良好、长势一致幼苗进行持续干旱胁迫,每类型苗80株,每次处理取样6株。分别在控水当天(CK)和持续干旱7、14、21、28 d后测定相关指标,各干旱胁迫时间对应的土壤相对含水量分别为77.5%、64.5%、35.2%、27.0%,分属于湿润、轻度干旱、中度干旱、重度干旱;分别在持续干旱14、21、28 d后对部分幼苗复水,并在复水7 d后对相关指标进行测定,复水处理分别用R1、R2、R3表示。每次指标测定重复4次。
1.3 指标测定方法
按照GB 6000-1999[10]标准,用直尺和游标卡尺分别测量幼苗的苗高(cm)和地径(mm),土壤含水率采用烘干法。
苗木质量指数(QI)=苗木总干质量(g)/{[苗高(cm)/地径(mm)]+[茎干质量(g)/根干质量(g)]}。
光合色素质量分数采用丙酮浸提法测定[15];采用酸性茚三酮显色法测定游离脯氨酸;采用蒽酮法测定可溶性糖质量分数;采用考马斯亮蓝法测定可溶性蛋白质量分数;采用硫代巴比妥酸法测定MDA质量摩尔浓度;采用愈创木酚法测定POD酶活性;采用氮蓝四唑光还原法测定SOD酶活性[16]。
1.4 数据处理
各处理间的差异性分析采用SPSS 20.0软件中的One-way ANOVA及Duncan检验法多重比较。抗旱性综合评价采用模糊数学隶属函数值法[17]。
2 结果与分析
2.1 不同叶型马尾松幼苗出圃时苗木质量参数比较
高径比、茎根比和苗木质量指数(QI)是评价苗木质量最基本的形态参数。由表1可知,幼苗的高径比和QI均存在显著差异(P<0.05),其中高径比最大的是Ⅱ类型(5.45),最小的是Ⅲ类型(4.05),前者是后者的1.35倍,类型Ⅰ、Ⅱ之间差异不显著;类型Ⅱ、Ⅲ的QI差异不显著,但均显著高于类型Ⅰ,是后者的2倍左右;3种叶型幼苗之间的茎根比差异不显著。
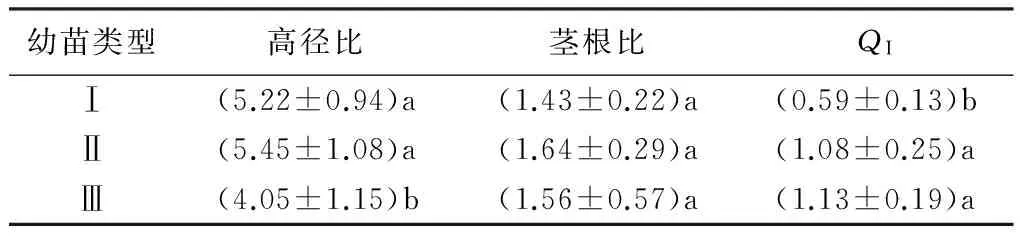
表1 马尾松不同叶型幼苗苗木质量对比
注:表中数据为平均值±标准差;同列不同字母表示差异显著(P<0.05);各类型苗样本量为80株。
2.2 干旱胁迫处理及复水对不同叶型幼苗生长指标的影响
从表2可以看出,不同干旱处理下,各类幼苗生长速率变化幅度不同。土壤湿润阶段(0~7 d),Ⅲ类型苗高增长速率最大,达到31.85%,Ⅰ、Ⅱ类型苗高增长速率分别为16.81%、19.18%;随着胁迫程度的加剧,各类幼苗生长逐渐变缓或几乎不生长,地径和苗高增长趋势表现出一致。分别在持续干旱14、21、28 d后进行复水处理(分别为R1、R2、R3),不同叶型幼苗的苗高和地径较复水前均有不同程度的增加(表3)。其中Ⅰ、Ⅱ类型幼苗各处理之间苗高、地径表现差异显著(P<0.05)。Ⅰ类型幼苗复水后,苗高和地径增长速率逐渐增大,尤其重度水分胁迫后复水,苗高增长速率达到17.25%,分别是Ⅱ、Ⅲ类型幼苗的1.61倍和1.86倍;地径增长速率达到27.18%,为Ⅱ、Ⅲ类型幼苗的4.33倍和7.79倍。Ⅲ类型幼苗复水后生长指标变化不明显,表明其胁迫后恢复能力弱于Ⅰ、Ⅱ类型幼苗。
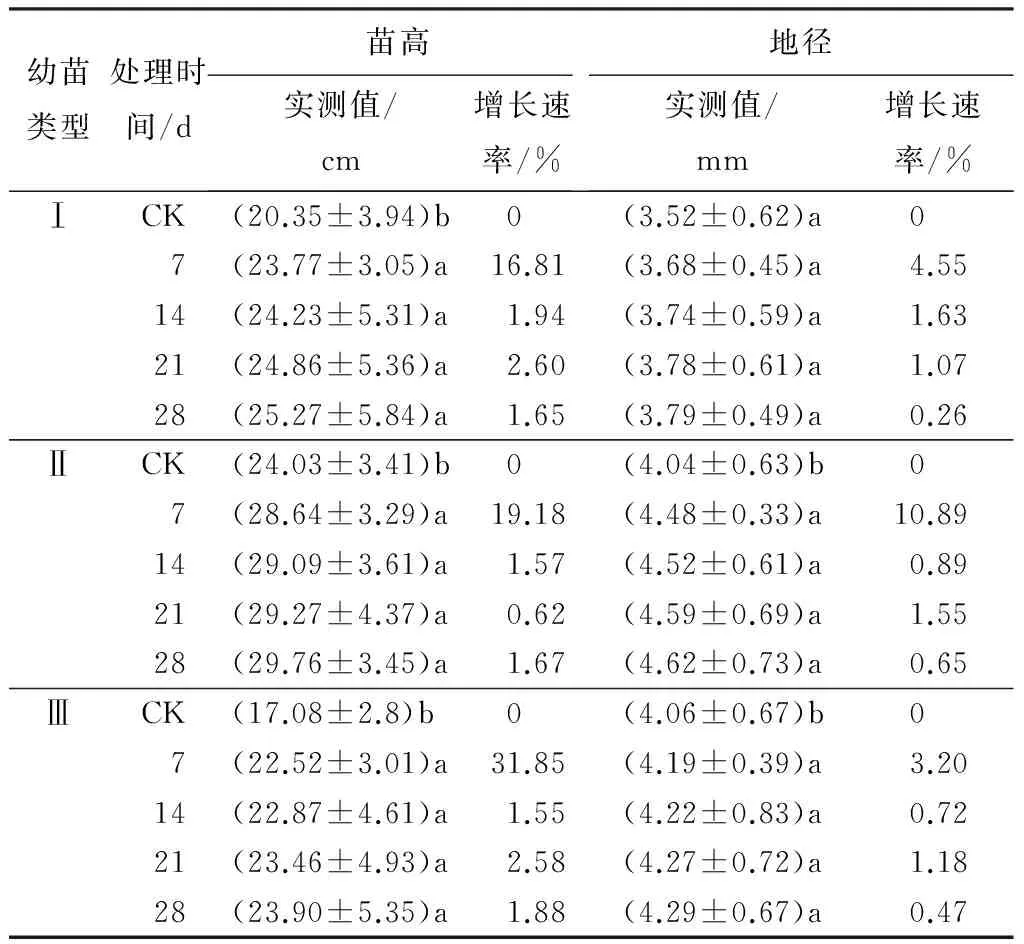
表2 干旱胁迫处理对不同叶型幼苗生长指标的影响
注:表中数据为平均值±标准差;同列不同字母表示差异显著(P<0.05);各类型苗初始样本量80株,每处理取样6株后测剩余量。
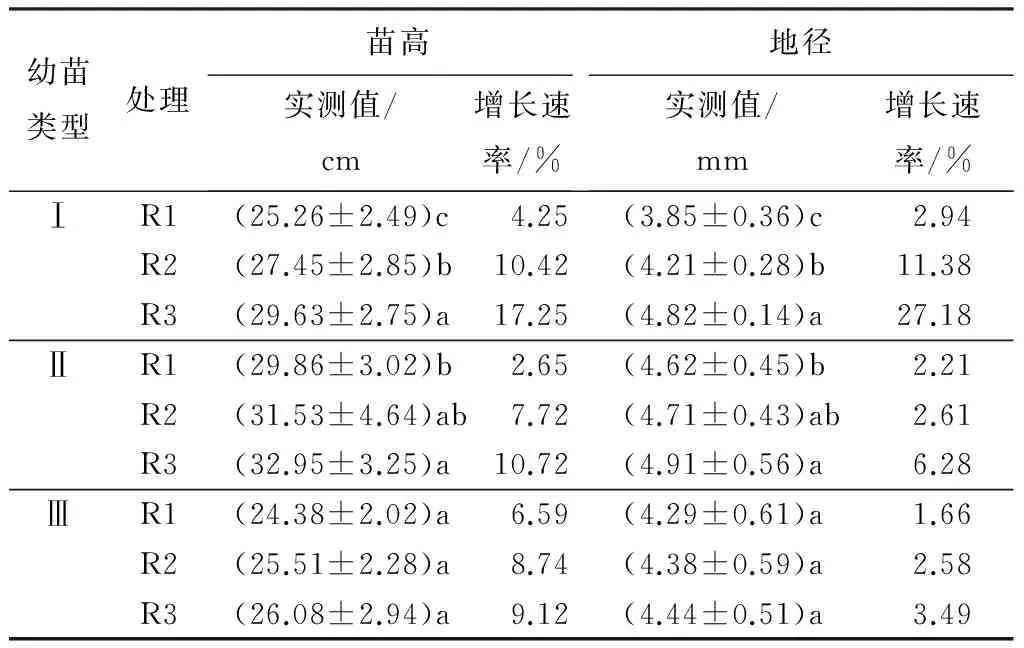
表3 复水对不同叶型幼苗生长指标的影响
注:表中数据为平均值±标准差;同列不同字母表示差异显著(P<0.05);R1、R2、R3分别表示持续干旱14、21、28 d后进行复水;各类型苗初始样本量80株,每处理取样6株后测剩余量。
2.3 干旱胁迫处理及复水对不同叶型幼苗光和色素的影响
由表4可知,3种叶型幼苗光合色素随着干旱胁迫程度的加剧呈现下降趋势,且在不同水分处理下的差异达到显著水平(P<0.05)。其中Ⅰ类型幼苗叶绿素a质量分数降幅最大,达到84.54%;在持续干旱胁迫14、21 d,分别对Ⅰ类型幼苗进行复水(R1、R2),其叶绿素a质量分数迅速回升,较复水前增加1.61倍和2.02倍。持续干旱胁迫28 d后复水(R3),较复水前没有显著变化,表明重度水分胁迫后,Ⅰ类型幼苗叶绿素a质量分数适应能力较轻度、中度胁迫减小;Ⅱ、Ⅲ类型幼苗仅在R1处理下恢复到正常水平,中度、重度水分胁迫后,其叶绿素a质量分数适应能力减弱。3种叶型幼苗叶绿素b、类胡萝卜素、总叶绿素质量分数在干旱胁迫及复水处理后的变化趋势与叶绿素a变化趋势一致。
2.4 干旱胁迫处理及复水对不同叶型幼苗叶片渗透调节物质的影响
由表5可知,在持续干旱条件下,3种叶型幼苗叶片中的游离脯氨酸(Pro)、可溶性糖和可溶性蛋白质量分数均呈现升高的趋势,且达到显著水平(P<0.05)。其中,以游离脯氨酸的增幅最大,Ⅰ、Ⅱ、Ⅲ类型幼苗在重度干旱胁迫下,游离脯氨酸质量分数分别达到647.95、1 062.93和528.01 μg·g-1,分别是对照的7.46倍、5.51倍和3.74倍;可溶性糖质量分数增幅次之,增加幅度分别为2.17倍、2.08倍和2.18倍;可溶性蛋白质量分数增幅最小,增加幅度分别为1.96倍、1.91倍和1.34倍。结果表明,游离脯氨酸是3种不同叶型幼苗抵御干旱胁迫最为敏感的渗透调节物质。
在持续干旱14 d复水后(R1),Ⅰ类型幼苗游离脯氨酸、可溶性糖和可溶性蛋白质量分数恢复程度分别为92.56%、98.97%和90.61%;Ⅱ类型幼苗游离脯氨酸、可溶性糖和可溶性蛋白质量分数恢复程度分别为69.66%、87.09%和144.89%;Ⅲ类型幼苗游离脯氨酸、可溶性糖和可溶性蛋白质量分数恢复程度分别为77.76%、78.44%和103.80%。分别在胁迫21 d和28 d后复水,Ⅰ类型幼苗游离脯氨酸质量分数持续增长,可溶性糖和可溶性蛋白质量分数略有下降,但仍显著高于对照水平;Ⅱ类型幼苗游离脯氨酸质量分数较复水前显著下降,可溶性糖和可溶性蛋白质量分数小幅下降,但均显著高于对照水平;Ⅲ类型幼苗中度干旱胁迫复水(R2)后各指标较复水前差异不显著,但重度胁迫复水(R3)后游离脯氨酸质量分数显著升高,可溶性糖质量分数显著下降,可溶性蛋白质量分数小幅升高。
2.5 干旱胁迫处理及复水对不同叶型幼苗MDA质量摩尔浓度及保护酶活性的影响
由表6可知,在持续干旱胁迫下,各类幼苗丙二醛(MDA)质量摩尔浓度均呈现持续升高的趋势。在重度干旱胁迫条件下,3种叶型幼苗较对照水平分别提高了3.80倍、1.24倍和1.71倍,差异显著(P<0.05),其余处理下仅为小幅上升。复水后,幼苗叶片中MDA质量摩尔浓度恢复能力受到胁迫时间的影响,在持续干旱胁迫14、21 d后复水(R1、R2),不同叶型幼苗均有所下降;但胁迫28 d后复水(R3),幼苗MDA质量摩尔浓度均显著上升,可能是因为长时间的干旱胁迫导致保护机制失效,产生过多的氧自由基,即使复水也不能完全恢复,从而在叶片中积累过多的MDA。

表4 干旱胁迫及复水处理对不同叶型幼苗光合色素的影响
注:表中数据为平均值±标准差;同列不同字母表示差异显著(P<0.05);每处理每类型取样6株。
表5干旱胁迫及复水处理对不同叶型幼苗叶片渗透调节物质的影响

幼苗类型处理时间/d游离脯氨酸质量分数/μg·g-1可溶性糖质量分数/%可溶性蛋白质量分数/mg·g-1ⅠCK(86.88±4.94)e(3.89±0.76)e(1.81±0.31)e7(217.64±24.08)d(4.41±0.63)cd(2.66±0.39)c14(236.77±46.33)d(5.30±0.44)c(3.87±0.20)a21(314.75±50.87)cd(7.25±1.08)b(3.58±0.36)b28(647.95±55.27)b(8.46±0.55)a(3.55±0.46)bR1(80.42±30.77)e(3.85±0.92)d(1.64±0.57)eR2(423.18±67.65)c(4.84±0.35)c(2.21±0.48)dR3(1017.62±74.33)a(5.11±0.71)c(3.41±0.70)bⅡCK(192.97±10.84)d(3.02±0.75)d(1.47±0.42)e7(201.30±5.32)d(3.63±0.32)c(2.27±0.18)bc14(228.77±49.46)d(4.20±0.54)b(2.97±0.35)a21(327.34±68.07)c(4.49±1.02)b(2.77±0.33)ab28(1062.93±118.44)a(6.27±0.31)a(2.81±0.28)abR1(134.43±28.96)d(2.63±0.59)d(2.13±0.18)cdR2(367.25±72.84)c(3.75±0.30)b(2.44±0.55)bR3(645.35±93.07)b(4.08±0.53)b(2.19±0.34)bcⅢCK(141.18±10.27)e(2.69±0.39)c(2.63±0.44)c7(239.86±4.21)de(3.24±0.86)bc(2.55±0.12)c14(347.58±108.18)cd(3.76±0.36)bc(2.95±0.50)bc21(405.22±37.83)bc(4.16±0.57)b(3.20±0.26)ab28(528.01±104.01)b(5.87±0.66)a(3.52±0.37)aR1(109.78±24.71)e(2.11±0.37)d(2.73±0.10)bcR2(431.41±138.64)bc(4.30±1.12)b(2.88±0.33)bcR3(915.57±140.90)a(3.73±0.64)bc(3.08±0.03)abc
注:表中数据为平均值±标准差;同列不同字母表示差异显著(P<0.05);每处理每类型取样6株。
表6干旱胁迫及复水处理对不同叶型幼苗MDA质量摩尔浓度及保护酶活性的影响

幼苗类型处理时间/dMDA质量摩尔浓度/nmol·g-1POD酶活性/U·g-1·min-1SOD酶活性/U·g-1ⅠCK(36.30±3.79)d(22.92±3.61)f (114.58±18.04)f7(41.92±3.51)d(38.41±3.52)ef(192.05±17.59)ef14(56.86±7.97)d(128.12±15.73)b(640.63±78.64)b21(96.63±22.54)c(169.22±24.88)a(896.09±124.37)a28(174.41±12.64)b(90.87±16.72)cd(450.15±68.79)cdR1(30.01±6.33)d(185.01±24.58)a(875.00±122.89)aR2(73.04±13.17)c(115.02±4.56)bc(575.00±22.82)bcR3(299.57±23.33)a(63.13±4.84)de(315.63±24.21)deⅡCK(48.06±2.57)c(27.08±3.61)d(135.42±18.04)d7(55.84±5.56)c(54.20±6.93)cd(271.01±34.66)cd14(64.30±13.50)c(119.79±14.58)b(598.96±72.92)b21(71.33±5.26)c(175.79±24.87)a(876.91±102.41)a28(107.53±13.50)b(82.29±7.12)c(411.46±35.58)cR1(53.81±8.62)c(178.01±20.94)a(890.01±104.70)aR2(51.97±8.64)c(68.85±8.72)c(344.22±43.60)cR3(143.01±22.69)a(56.43±10.71)cd(282.13±53.56)cdⅢCK(45.98±10.15)e(37.51±6.25)e(181.50±31.25)e7(73.14±8.59)d(79.35±8.17)cd(396.73±40.81)cd14(69.38±11.17)d(150.01±27.03)b(750.00±105.02)b21(103.44±14.96)c(183.50±38.27)a(915.51±91.37)a28(124.8±13.18)b(108.54±15.22)c(542.71±76.10)cR1(50.29±12.68)e(187.75±13.62)a(868.75±60.08)aR2(75.47±13.63)d(81.88±12.14)cd(409.38±60.70)cdR3(300.14±45.26)a(61.56±7.09)de(307.81±35.49)de
注:表中数据为平均值±标准差;同列不同字母表示差异显著(P<0.05);每处理每类型取样6株。
随着干旱胁迫程度的加剧,保护酶活性均呈现先升高后降低的变化趋势,在中度干旱胁迫(21 d)时达到最高,经过重度干旱胁迫后保护酶活性显著下降(表6)。这是因为经历长时间的干旱胁迫,幼苗受到持续的伤害,保护酶抵御逆境的能力不断减弱。持续干旱胁迫下,3种叶型幼苗叶片POD酶活性最大为CK的7.38倍、6.49倍和4.89倍,Ⅲ类型幼苗POD酶活性最高,Ⅰ类型幼苗增幅最大;SOD酶活性最大为CK的7.82倍、6.47倍和5.04倍,Ⅲ类型幼苗SOD酶活性表现最强,Ⅰ类型幼苗增幅最大。持续干旱14 d后复水(R1),保护酶活性显著升高(P<0.05)。其中,Ⅰ类型幼苗较复水前POD酶活性升高44.40%,SOD酶活性升高36.58%;Ⅱ类型幼苗保护酶活性增幅为48.60%和48.59%,Ⅲ类型幼苗保护酶活性增幅25.16%和15.83%。分别在持续干旱21 d和28 d后复水(R2、R3),各叶型幼苗保护酶活性均大幅度下降,下降幅度最小的为Ⅰ类型幼苗。
2.6 不同叶型幼苗抗旱性综合评价
植物抗旱性的强弱需要结合各个抗旱性指标综合评价。利用上述9个生理指标隶属函数值对3种叶型幼苗耐旱性进行综合评价,隶属函数平均值越大,抗旱性越强。结果表明(表7),在轻度干旱胁迫下,Ⅰ类型幼苗综合隶属函数值最大(0.56),抗旱性最强;中度干旱胁迫处理后,Ⅱ类型幼苗综合隶属函数值最大(0.55),Ⅲ类型幼苗综合隶属函数值最小(0.42);重度干旱胁迫条件下,Ⅲ类型幼苗表现较佳,综合隶属函数值为0.52。
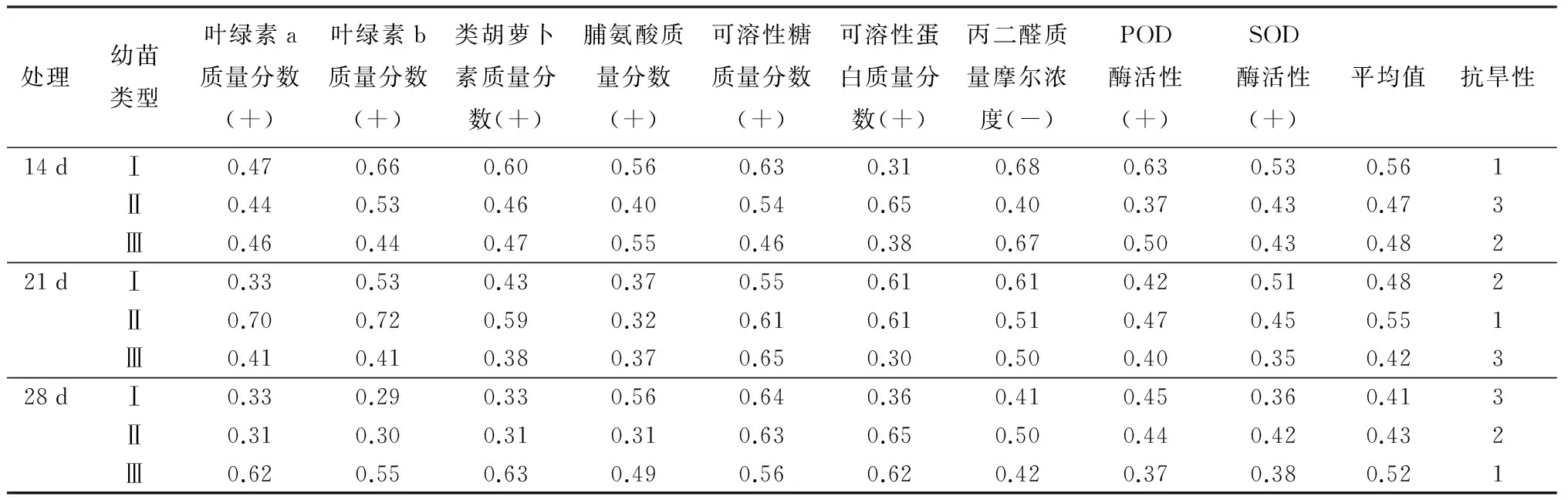
表7 不同干旱胁迫处理下3种叶型幼苗抗旱性隶属函数分析
注:“+”表示该指标与抗旱性呈正相关;“-”表示该指标与抗旱性呈负相关。
3 结论与讨论
苗木活力是由苗木形态、生理、抗性等质量指标综合体现的,幼苗大田表现与造林区立地条件、幼苗形态特征和抗逆境能力密切相关,通过研究在逆境条件下,植物生长生理指标的变化,可以综合评价苗木活力的大小[18]。本研究发现,出圃时Ⅲ类型幼苗表现出较好的苗木质量,在不同干旱胁迫处理下,3种叶型幼苗表现出不同的响应及适应能力。在湿润阶段Ⅲ类型幼苗生长速率最大,且重度干旱胁迫下的适应能力也强于其余两种类型幼苗。由于苗木的抗旱性是受到多种因素影响的复合性状,通过模糊数学隶属函数法对3种叶型幼苗的抗旱性进行综合评价,在轻度干旱胁迫下,3种叶型幼苗抗旱性由强到弱的顺序为Ⅰ类型、Ⅲ类型、Ⅱ类型;中度干旱胁迫下由强到弱的顺序为Ⅱ类型、Ⅰ类型、Ⅲ类型;重度干旱胁迫条件下由强到弱的顺序为Ⅲ类型、Ⅱ类型、Ⅰ类型。研究结果表明,不同叶型幼苗应对不同干旱胁迫处理时表现出抗性差异,这可能与细胞形态结构变化有关系,不同叶形叶肉细胞中的原生质体、细胞膜系统、叶绿体及线粒体等超微结构在应对逆境迫害时可能会表现出不同的响应能力,通过调节其内部生理指标含量的变化来适应干旱环境。
光合色素主要包括叶绿素(叶绿素a、叶绿素b)和类胡萝卜素。大量研究表明,干旱胁迫能够导致植物叶片中的光和色素质量分数下降,过度的水分亏缺能够降解掉叶片中的叶绿素量,若能在适度干旱胁迫下保持光合色素质量分数的稳定,将有利于提高其抗逆境能力[19-21]。邵惠芳等[22]研究发现,随着干旱胁迫程度的加剧,植物光合色素质量分数随之减小,其中抗旱性较强的植物光合色素质量分数降幅较小。本研究中,随着干旱持续,3种叶型幼苗叶片中光合色素质量分数均有显著下降,在重度干旱胁迫下,Ⅲ类型幼苗光和色素质量分数降幅显著低于其他两种类型幼苗,但Ⅰ、Ⅱ类型苗在轻度和中度干旱胁迫时,光合色素质量分数并没有表现出优越性,说明此阶段光合色素不是这两种幼苗抗旱响应的主导因素。干旱胁迫下,植物会通过渗透调节作用在细胞质内合成和积累大量物质如游离脯氨酸、可溶性糖和可溶性蛋白,以降低水势维持膨压,增强植物的保水能力[23-24]。本研究发现,3种叶型幼苗渗透调节物质随着干旱胁迫的持续而增加,且以游离脯氨酸质量分数增幅最大,可溶性蛋白质量分数增幅最小,结果表明,游离脯氨酸是3种不同叶型幼苗抵御干旱胁迫最为敏感的渗透调节物质。在干旱条件下,渗透调节物质的积累有利于提高植物抗逆性[25-26],Ⅰ类型幼苗在持续干旱过程中,可溶性蛋白和可溶性糖质量分数虽然显著高于Ⅱ、Ⅲ类型幼苗,但其呈持续降低的趋势,而Ⅲ类型幼苗却在持续干旱胁迫中激发了可溶性蛋白的积累。在干旱胁迫条件下,植物细胞内由于水分的亏缺导致自由基代谢平衡遭到破坏,诱导膜脂过氧化作用加剧,自由基和丙二醛大量积累,最终使生物膜系统严重损伤,大量研究表明,丙二醛质量摩尔浓度会随着干旱胁迫时间的延长而逐渐升高[27-28];植物保护酶系统主要包括超氧化物歧化酶(SOD)和过氧化物酶(POD),其主要功能是清除自由基,增强植物抗逆性[29]。本研究发现,持续干旱过程中,各叶型幼苗丙二醛质量摩尔浓度均呈现持续升高的趋势,保护酶活性也持续增强,但在重度干旱胁迫条件下,MDA质量摩尔浓度升高的同时SOD、POD活性降低,可能由于干旱胁迫程度加剧,幼苗细胞结构受损,导致大量的过氧化物不能被保护酶有效的清除,使酶蛋白活性下降。结果表明,Ⅰ类型幼苗在轻度胁迫过程中,保护酶活性对其抗旱性影响较大,中度、重度胁迫下作用较弱;Ⅱ、Ⅲ类型幼苗在持续干旱过程中,保护酶活性不起主导作用。王艺等[30]、李嫱[31]研究发现,不同干旱胁迫处理复水对苗木生长生理影响不同。本研究中,分别在持续干旱14、21、28 d后,向3种叶型幼苗复水。结果表明,不同叶型幼苗的生长、光合色素质量分数、渗透调节物质质量分数、丙二醛质量摩尔浓度及保护酶活性均有不同程度的恢复,说明在干旱胁迫-复水模式的处理下,3种叶型幼苗表现出不同的自身调节及恢复能力,这可能由于干旱胁迫的持续,各叶型幼苗叶肉细胞受到损伤程度不同,所以导致复水情况下各叶型幼苗信号传导能力存在差异,从而影响到生理生化的变化不同。
[1] AROCA R. Plant responses to drought stress[M]. Berlin: From Morphological to Molecular Features Springer,2012:460-461.
[2] 欧立军,陈波,邹学.干旱对辣椒光合作用及相关生理特性的影响[J].生态学报,2012,32(8):2612-2619.
[3] 安玉艳,梁宗锁.植物应对干旱胁迫的阶段性策略[J].应用生态学报,2012,23(10):2907-2915.
[4] ANJUM S A, XIE X, WANG L, et al. Morphological, physiological and biochemical responses of plants to drought stress[J]. African Journal of Agricultural Research,2011,6(9):2026-2032.
[5] 罗桑,卓玛,辛福梅,等.干旱胁迫对香柏幼苗生长和生理指标的影响[J].西北农林科技大学学报(自然科学版),2015,43(5):51-57,70.
[6] 武燕奇,郭素娟.5个板栗品种对干旱胁迫的生理响应及抗旱性评价[J].东北林业大学学报,2017,45(1):20-24,29.
[7] 丁贵杰,周志春,王章荣.马尾松纸浆用材林培育与利用[M].北京:中国林业出版社,2006:15-20.
[8] 周政贤.中国马尾松[M].北京:中国林业出版社,2001:10-13.
[9] 秦国峰,周志春.中国马尾松优良种质资源[M].北京:中国林业出版社,2012:47-52.
[10] 国家质量技术监督局.主要造林树种苗木质量分级:GB6000-1999[M].北京:中国标准出版社,1999.
[11] 施积炎,丁贵杰.水分胁迫对不同种源马尾松种子发芽的影响[J].山地农业生物学报,2000,19(5):332-337.
[12] 韩文萍,丁贵杰,鲍斌.不同种源马尾松对干旱胁迫的生理生态响应[J].中南林业科技大学学报,2012,32(5):25-29.
[13] 王艺,丁贵杰.水分胁迫下外生菌根对马尾松幼苗养分吸收的影响[J].林业科学研究,2013,26(2):227-233.
[14] 尹晓阳,朱忠荣.马尾松菌根化苗水分胁迫生理与耐旱性研究[J].林业资源管理,2008,6(3):63-67.
[16] 赵世杰,史国安,董新纯.植物生理实验技术[M].北京:中国农业科学与技术出版社,2002:83-135.
[17] 赵雪,张秀珍,牟洪香,等.干旱胁迫对不同种源文冠果幼苗水分生理特性及渗透调节物质的影响[J].东北林业大学学报,2017,45(6):17-21.
[18] BAYLEY A D, KIETZKA J W. Stock quality and field performance ofPinuspatulaseedlings produced under two nursery growing regimes during seven different nursery production periods[J]. New Forests,1997,13(1/2/3):341-356.
[19] 冯慧芳,薛立,任向荣,等.4种阔叶幼苗对PEG模拟干旱的生理响应[J].生态学报,2011,31(2):371-382.
[20] 李永华,卢琦,吴波,等.干旱区叶片形态特征与植物响应和适应的关系[J].植物生态学报,2012,36(1):88-98.
[21] 李州,王晓娟,彭丹丹,等.Na+对水分胁迫下白三叶抗氧化防御和有机渗透调节物质的影响[J].草业学报,2014,23(5):175-183.
[22] 邵惠芳,陈征,许嘉阳,等.两种烟草幼苗叶片对不同强度干旱胁迫的生理响应比较[J].植物生理学报,2016,52(12):1861-1871.
[23] 范苏鲁,苑兆和,冯立娟,等.干旱胁迫对大丽花生理生化指标的影响[J].应用生态学报,2011,22(3):651-657.
[24] 安玉艳,梁宗锁,郝文芳.杠柳幼苗对不同强度干旱胁迫的生长与生理响应[J].生态学报,2011,31(3):716-725.
[25] 洪震,练发良,刘术新,等.3种乡土园林地被植物对干旱胁迫的生理响应[J].浙江农林大学学报,2016,33(4):636-642.
[26] 胡晓健,欧阳献,喻方圆.干旱胁迫对不同种源马尾松苗木生长及生物量的影响[J].江西农业大学学报,2010,32(3):510-516.
[27] 潘昕,邱权,李吉跃,等.干旱胁迫对青藏高原6种植物生理指标的影响[J].生态学报,2014,34(13):3558-3567.
[28] 宋丽梅,代微然,任健,等.干旱胁迫及复水处理对百脉根叶片丙二醛质量分数及抗氧化酶活性的影响[J].云南农业大学学报(自然科学版),2014,29(1):37-42.
[29] 罗银玲,毕廷菊,苏志龙,等.棒叶落地生根对干旱与复水的生理响应[J].热带亚热带植物学报,2014,22(4):391-398.
[30] 王艺,丁贵杰.马尾松菌根化苗木对干旱的生理响应及抗旱性评价[J].应用生态学报,2013,24(3):639-645.
[31] 李嫱.干旱胁迫和旱后复水对翠菊生长发育影响的研究[D].长春:吉林农业大学,2012.
