大孔吸附树脂分离纯化辣蓼总黄酮研究
2018-01-13宋漫玲陶俊宇杨剑胡庭俊
宋漫玲++陶俊宇++杨剑++胡庭俊
摘要:目的 采用大孔吸附树脂对辣蓼总黄酮进行分离纯化,探讨静态及动态吸附过程中多种因素对吸附及解吸效果的影响,以确定其最佳分离提纯工艺。方法 提取辣蓼总黄酮,测定辣蓼黄酮乙酸乙酯部位(FEA)与辣蓼黄酮正丁醇部位(FNB)黄酮含量,进行大孔吸附树脂对FEA与FNB的吸附试验,采用D101、AB-8、DM130和XDA-8大孔树脂优选最佳分离纯化工艺。结果 选择XDA-8进行辣蓼总黄酮的富集,其最佳工艺为:调节FEA黄酮pH值为6,上样浓度为750 μg/mL,用75%乙醇洗脱,以1 BV/h流速洗脱5 BV;调节FNB黄酮pH值为6.0,上样浓度为1 mg/mL,用60%乙醇洗脱,以1 BV/h流速洗脱5 BV。结论 采用XDA-8大孔吸附树脂通过最佳工艺有利于分离纯化辣蓼总黄酮。
关键词:大孔吸附树脂;辣蓼总黄酮;分离纯化
DOI:10.3969/j.issn.1005-5304.2018.01.016
中图分类号:R284.2 文献标识码:A 文章编号:1005-5304(2018)01-0074-05
Study on Separation and Purification of Total Flavonoids from
Polygonum hydropiper Linn. by Macroporous Resin
SONG Man-ling1, TAO Jun-yu2, YANG Jian1, HU TING-jun1
1. School of Animal Science and Technology, Guangxi University, Nanning 530005, China;
2. School of Preclinical Medicine, Guangxi Medical University, Nanning 530021, China
Abstract: Objective To study the separation and purification of total flavonoids from Polygonum hydropiper Linn. by macroporous adsorption resin; To investigate the effects of various factors in the process of static and dynamic adsorption on effects of adsorption and desorption to determine the optimum capability. Methods The total flavonoids from Polygonum hydropiper Linn. was extracted; the contents of flavonoids of ethyl acetate part (FEA) and flavonoids of n-butanol part (FNB) were detected; the adsorption experiment of FEA and FNB was conducted by macroporous adsorption resin. D101, AB-8, DM130, and XDA-8 macroporous resin were used to optimize the separation and purification process. Results The XDA-8 macroporous resin was selected to enrich total flavonoids from Polygonum hydropiper Linn. The optimum process was: adjusting the pH value of FEA flavonoids to 6, the concentration of sample was 750 g/mL, eluting with 75% ethanol to elute 5 bed volumes at a flow rate of 1 bed per hour; adjusting the pH value of FNB flavonoids to 6, the concentration of sample was 1 mg/mL, eluting with 60% ethanol to elute 5 bed volumes at a flow rate of 1 bed per hour. Conclusion XDA-8 macroporous adsorption resin is helpful to separate and purify the total flavonoids of Polygonum hydropiper Linn. by the best process.
Keywords: macroporous adsorption resin; Polygonum hydropiper Linn.; total flavonoids; separation and purification
辣蓼為蓼科蓼属植物水蓼Polygonum hydropiper L.的全草,其主要成分为鞣质、黄酮和挥发油,其中黄酮类化合物有芦丁、槲皮素、金丝桃苷、山柰酚、异鼠李素[1]。近年研究表明,黄酮类化合物具有良好的抗菌[2]、抗病毒[3]、抗氧化[4]生理活性,还能降血压[5]、
基金项目:国家自然科学基金(31560708)endprint
通讯作者:胡庭俊,E-mail:tingjunhu@126.com.
降血脂[6]和提高机体免疫力[7]。大孔吸附树脂是一类有机高分子聚合物吸附剂,近年来被广泛运用于中草药有效成分的分离及新药的开发与研制,其具有价格便宜、稳定性高、吸附快、吸附容量大、洗脱率高、解吸条件温和、再生简便、使用周期长等优点。本试验应用大孔吸附树脂对辣蓼总黄酮进行分离纯化,探讨静态及动态吸附过程中多种因素对吸附及解吸效果的影响,为开发利用辣蓼提供依据。
1 仪器与试药
R-3旋转蒸发仪(BUCHI),V-700真空泵(BUCHI),超声波清洗机(SB-5200DTDN,宁波新芝生物科技股份有限公司),紫外分光光度计(UV-1750,岛津),纯水仪(CD-UPT-1,成都纯越科技有限公司),分析天平(EL204,METTLER TOLEDO)。D101、DM130、XDA-8、AB-8大孔树脂,西安蓝晓科技。
辣蓼,南宁市山草堂,批号20160519,烘干除杂后粉碎备用。芦丁对照品,中国食品药品检定研究院,批号100080-200707。
2 方法与结果
2.1 辣蓼总黄酮的提取
取辣蓼粉末(过100目筛),按料液比为1∶30与pH 4.8的HAc-NaAc缓冲液混合,加入0.25%纤维素酶与果膠酶,50 ℃超声处理1.5 h,之后用Na2CO3溶液调pH至9.0,于85 ℃水浴15 min使酶灭活。加入纯乙醇使酶解液中醇浓度为60%,浸提24 h,回收浸提液,滤渣按1∶30料液比再加入60%乙醇溶液重复浸提1次,过滤,合并2次滤液,滤液经过石油醚、氯仿、乙酸乙酯及正丁醇萃取。收集辣蓼黄酮乙酸乙酯部位与辣蓼黄酮正丁醇部位,减压蒸干,备用。
2.2 黄酮含量测定
2.2.1 对照品溶液的制备
精密称取120 ℃干燥至恒重的芦丁对照品10 mg,加入60%乙醇溶液,充分溶解,并定容至50 mL容量瓶中,摇匀,即得浓度为0.2 mg/mL的芦丁对照品溶液。
2.2.2 测定波长的选择与标准曲线的绘制
准确移取芦丁对照品溶液(0.2 mg/mL)0、0.4、0.8、1.6、2.4、3.2、3.6 mL分别置于10 mL容量瓶中,加入60%乙醇至5 mL,加5%NaNO2溶液0.5 mL,摇匀静置6 min,再加入10%Al(NO3)3溶液0.5 mL,摇匀后静置5 min,加1 mol/L NaOH溶液4 mL,边滴入边摇匀,以60%乙醇溶液定容至10 mL,摇匀后静置15 min。对芦丁对照品溶液显色后用1 cm比色皿在波长400~700 nm区间扫描,确定最大吸收波长。以第1管溶液作空白,分别测定吸光度,以总黄酮浓度为纵坐标,吸光度为横坐标,绘制标准曲线。
2.2.3 样品测定
将辣蓼黄酮乙酸乙酯部位与正丁醇部位充分溶解,取样品液1 mL,按照标准曲线制作的显色程序各取3份进行平行测定,记录最大吸收下的吸光度值,代入标准曲线方程,计算总黄酮含量。
2.3 大孔吸附树脂吸附试验
2.3.1 大孔吸附树脂的预处理
取一定量树脂,用无水乙醇浸泡24 h充分溶胀后装柱。用95%乙醇冲洗,直到流出液加入等体积去离子水无浑浊后用4 BV去离子水洗净乙醇;用3%盐酸溶液4 BV冲洗,去离子水冲洗至中性;用3%氢氧化钠溶液4 BV冲洗,去离子水冲洗至中性。
2.3.2 静态吸附试验
将预处理好的大孔吸附树脂抽滤至不滴水,各精密称取2.0 g,置于100 mL具塞锥形瓶中,分别准确加入50 mL辣蓼黄酮乙酸乙酯部位与正丁醇部位,于室温以120 r/min在摇床中振摇24 h充分吸附,取上清液,用0.22 ?m滤膜过滤,滤液用分光光度计测定剩余黄酮含量,计算各大孔吸附树脂的静态吸附量。
2.3.3 静态解吸试验
取上述已吸附饱和的树脂,分别加入95%乙醇50 mL,于室温以120 r/min在摇床中振摇24 h,使大孔吸附树脂解吸完全,取上清液,用分光光度计测定其中芦丁和黄酮的含量,计算各树脂的静态吸附量、静态解吸量及静态解吸率。静态吸附量(mg/g)=V药液×(C0-C1)/M,静态解吸量(mg/g)=V洗脱液×C2/M,静态解吸率(%)=静态解析量÷静态吸附量×100%。式中,C0为黄酮初始浓度(mg/mL),C1为黄酮剩余浓度(mg/mL),C2为洗脱液中黄酮浓度(mg/mL),M为树脂质量(g)。
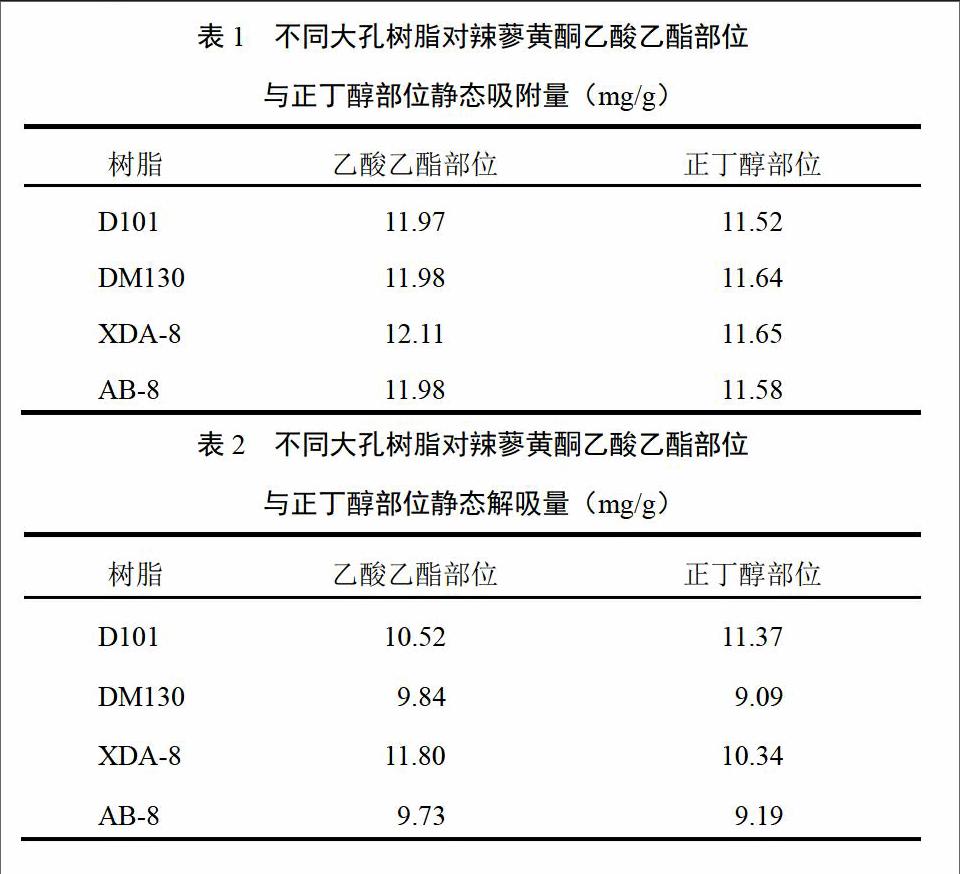
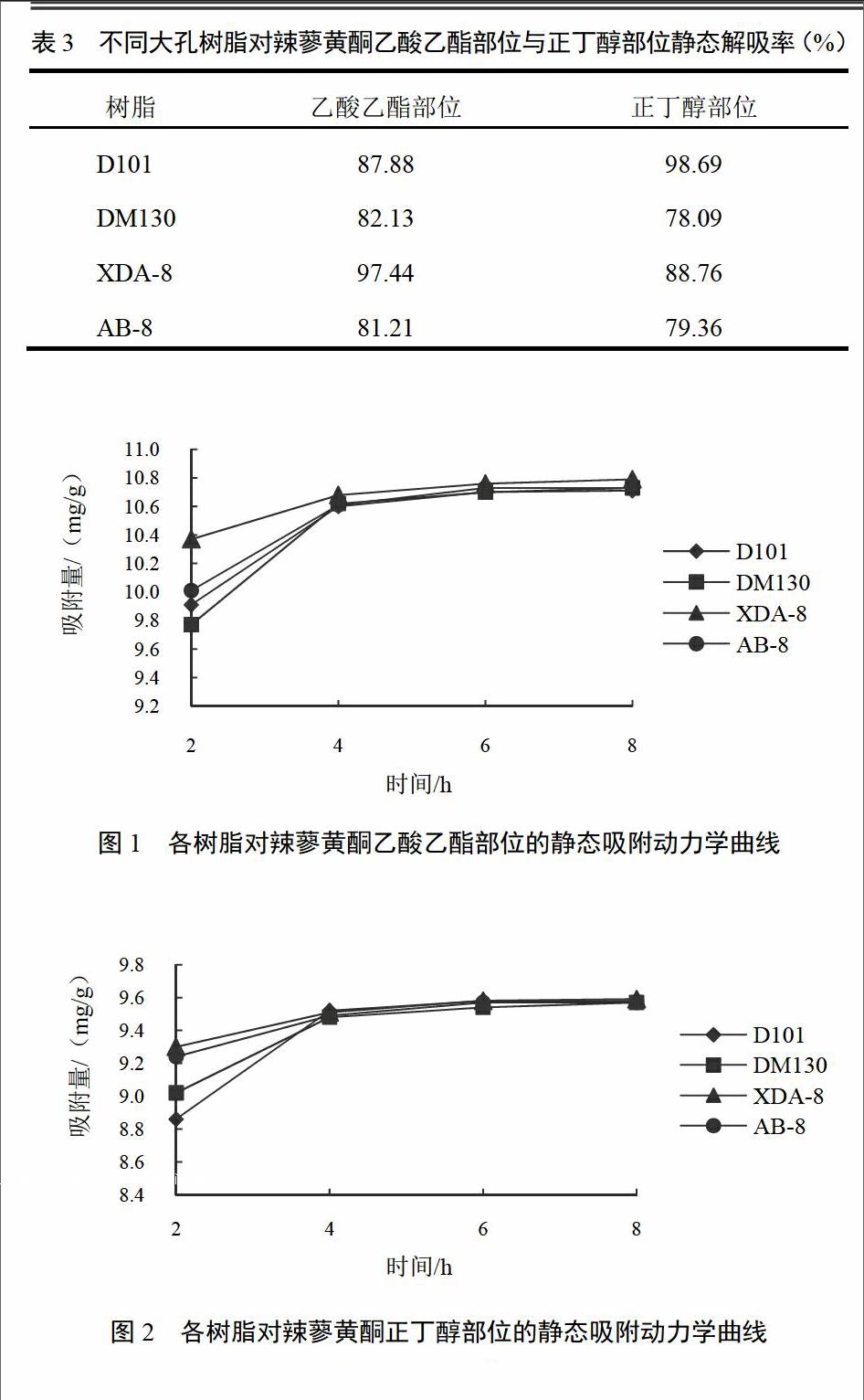
用4种大孔树脂分别对辣蓼黄酮乙酸乙酯部位和正丁醇部位进行吸附与解吸,结果见表1~表3。XDA-8大孔吸附树脂对辣蓼黄酮乙酸乙酯部位与正丁醇部位不仅有较大的静态吸附量,而且有较大的静态解析量。
2.3.4 大孔吸附树脂的静态吸附动力学特性测定
准确移取辣蓼黄酮乙酸乙酯部位与正丁醇部位50 mL,加入盛有4种大孔树脂的锥形瓶内,置恒温振荡器上振荡(30 ℃、120 r/min),每隔一段时间取1 mL溶液测定,连续测定8 h,计算树脂对辣蓼黄酮乙酸乙酯部位与正丁醇部位的吸附量,确定吸附量与时间的关系,绘制吸附动力学曲线(见图1、图2),研究其吸附速率。由图可知,XDA-8大孔吸附树脂对辣蓼乙酸乙酯部位黄酮与正丁醇部位黄酮都有良好的静态吸附动力学特性,能在4 h内达到吸附平衡,与其他大孔吸附树脂相比,更适合进行试验性研究与工业化生产。
2.3.5 大孔吸附树脂对辣蓼黄酮乙酸乙酯部位与正丁醇部位的动态吸附分离特性研究
通过大孔吸附树脂对辣蓼黄酮乙酸乙酯部位与正丁醇部位的静态吸附试验,优选出1种树脂进行上样液浓度、上样液pH值、洗脱液浓度与用量等影响因素的动态吸附试验。将预处理好的大孔吸附树脂装入玻璃层析柱(1.6 cm×40 cm)中,将辣蓼黄酮乙酸乙酯部位与正丁醇部位上柱,控制一定流速,按5 mL为一部分收集流出液,测定流出液中黄酮含量。endprint
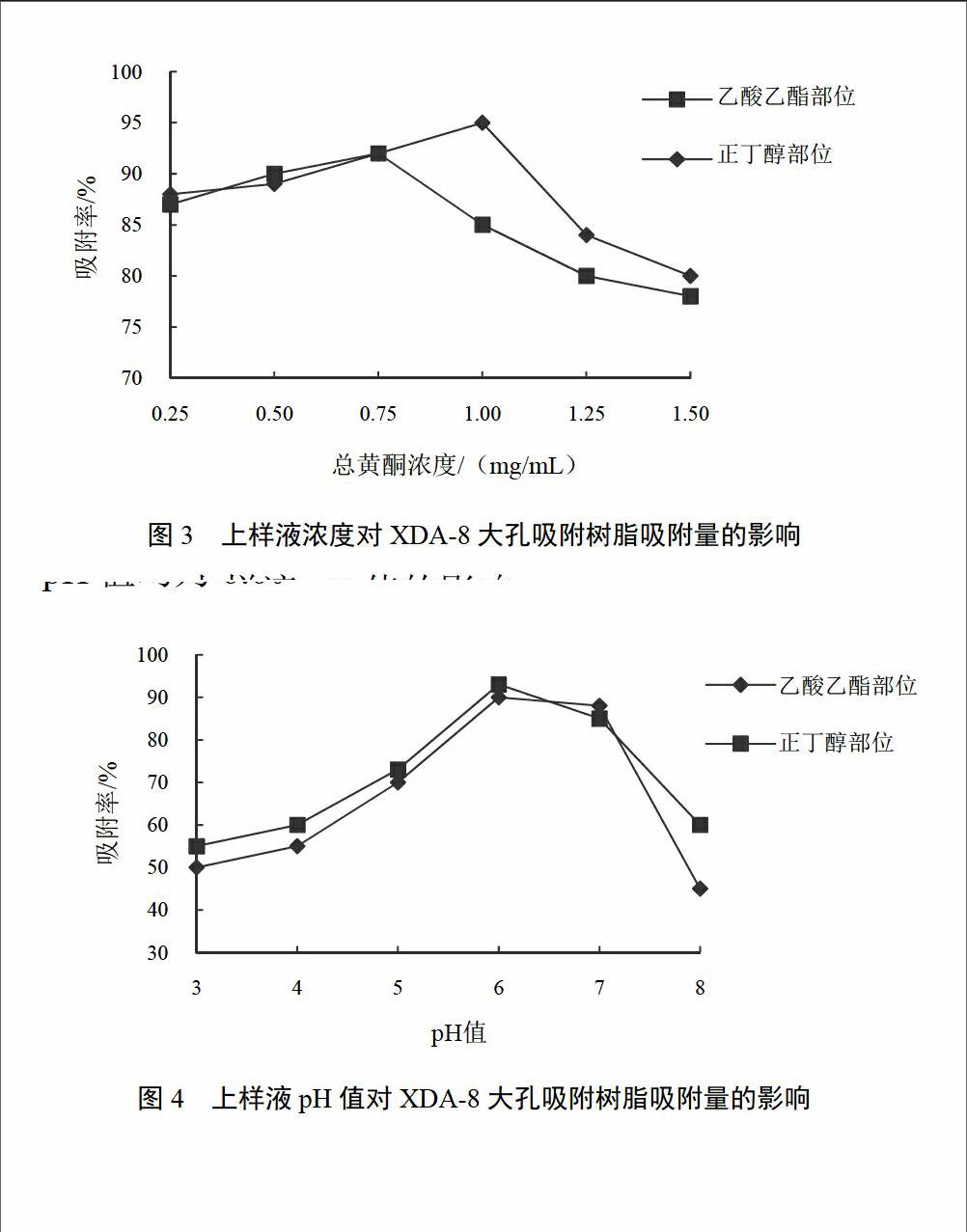
2.3.5.1 上样液浓度的影响
将辣蓼黄酮乙酸乙酯部位黄酮与正丁醇部位黄酮配制成黄酮浓度为0.25、0.5、0.75、1、1.25、1.5 mg/mL待上样溶液25 mL。以1 BV/h速度加入装有180 mL XDA-8树脂的层析柱内(2 cm×60 cm,树脂柱床高约50 cm)进行吸附,静止吸附3 h后,用2 BV蒸馏水除杂,用95%乙醇以2 BV/h速度进行洗脱,计算吸附量。上样量浓度与吸附量的关系见图3。由图可知,用XDA-8大孔树脂分离纯化辣蓼黄酮乙酸乙酯部位的最佳上样浓度为750 μg/mL,正丁醇部位的最佳上样浓度为1.0 mg/mL。
2.3.5.2 上样液pH值的影响
将辣蓼乙酸乙酯部位黄酮与正丁醇部位黄酮(黄酮浓度为0.75 mg/mL)配制成pH值为3.0、4.0、5.0、6.0、7.0、8.0的待上样溶液25 mL,以1 BV/h速度加入加入装有XDA-8树脂180 mL的层析柱内(2 cm×60 cm,树脂柱床高约50 cm)进行吸附,静止吸附3 h后,用2 BV蒸馏水除杂。用95%乙醇100 mL以2 BV/h速度进行洗脱,计算吸附率。上样液pH值与吸附率的关系见图4。由图可知,用XDA-8大孔树脂分离纯化辣蓼黄酮乙酸乙酯和正丁醇部位,其上样液最佳pH值均为6.0。
2.3.5.3 XDA-8大孔吸附树脂动态累积泄漏曲线
将辣蓼黄酮乙酸乙酯部位黄酮与正丁醇部位黄酮(黄酮浓度为0.75 mg/mL)以1 BV/h速度加入装有XDA-8树脂180 mL的层析柱内(2 cm×60 cm,樹脂柱床高约50 cm)进行吸附。收集流出液,测定每份渗出液中总黄酮浓度,以流出液中总黄酮浓度为上样液总黄酮浓度的1/10为泄漏点。以洗脱液体积为横坐标、黄酮浓度为纵坐标绘制曲线,结果见图5。由图可知,用XDA-8大孔吸附树脂分离纯化辣蓼总黄酮,对于乙酸乙酯部位黄酮,5 BV时达到泄漏点,50 BV时达到饱和;对于正丁醇部位黄酮,10 BV时达到泄漏点,50 BV时达到饱和。
2.3.5.4 洗脱剂浓度的影响
将25 mL pH值为6的辣蓼黄酮乙酸乙酯部位黄酮与正丁醇部位黄酮(黄酮浓度为0.75 mg/mL)以1 BV/h速度加入装有XDA-8树脂180 mL的层析柱内(2 cm×60 cm,树脂柱床高约50 cm)进行吸附,分别用蒸馏水(0%)及15%、30%、45%、60%、75%、90%乙醇各10 BV进行洗脱,收集洗脱液并测定其中黄酮含量,计算洗脱率,结果见图6。由图可知,用XDA-8大孔树脂分离纯化辣蓼黄酮,对于乙酸乙酯部位最佳洗脱剂为75%乙醇,洗脱率为92%;对于正丁醇部位最佳洗脱剂为60%乙醇,洗脱率为90%。
2.3.5.5 洗脱曲线的绘制
精密吸取25 mL pH值为6的辣蓼黄酮乙酸乙酯部位黄酮与正丁醇部位黄酮(黄酮浓度为0.75 mg/mL)以1 BV/h速度加入装有XDA-8大孔树脂180 mL的层析柱内(2 cm×60 cm,树脂柱床高约50 cm)进行吸附,静置吸附4 h后,用最佳洗脱浓度乙醇以2 BV/h流速进行洗脱,按柱床体积收集洗脱液,测定洗脱液中总黄酮浓度,绘制洗脱曲线,结果见图7。可见,用XDA-8大孔树脂分离纯化辣蓼黄酮,用75%乙醇洗脱乙酸乙酯部位黄酮,用60%乙醇洗脱正丁醇部位黄酮,5 BV洗脱剂能将辣蓼黄酮基本洗脱下来。
3 讨论
大孔树脂是一种有机高分子吸附材料,其利用氢键和范德华力作用及多孔结构对分子大小不同的物质的选择性吸附作用来达到分离提纯效果。根据树脂的吸附性能和被吸附物质的性质,本试验选用了弱极性的D101、AB-8、DM130和极性的XDA-8树脂进行静态吸解量和静态吸附动力学特性测定,发现极性的XDA-8大孔吸附树脂对辣蓼黄酮乙酸乙酯部位黄酮与正丁醇部位黄酮都有良好的静态解吸效果和静态吸附动力学特性,表明应用XDA-8大孔吸附树脂更有利于分离纯化辣蓼黄酮,其成本低、工艺简单,适合试验和生产。
虽然应用大孔吸附树脂可改变中药传统提取中“黑、大、粗”的缺点,但试验过程中有机溶剂(苯、甲苯、对二甲苯等)残留是不容忽视的问题,需妥善处理。试验前对大孔吸附树脂的处理也非常关键,为避免树脂残留物影响被提取药物的安全性,应将树脂洗脱至中性,保证树脂安全,使后续试验得以顺利进行。其次,在试验中先用石油醚和氯仿萃取除去叶绿素等杂质,可以使后续的大孔吸附树脂分离纯化更容易进行。此外,温度对XDA-8大孔吸附树脂分离纯化辣蓼黄酮也存在一定影响,在一定范围内升高温度,有助于吸附辣蓼黄酮。
运用大孔树脂富集黄酮的报道最早用于银杏叶中,在经过XAD7HP大孔树脂纯化后总黄酮含量显著升高[8]。近年来,有关辣蓼中黄酮类物质的提取工艺鲜有报道,而关于其黄酮化合物的纯化工艺更少。本试验确定了XDA-8大孔吸附树脂分离纯化辣蓼总黄酮的最佳工艺为:调节乙酸乙酯部位黄酮pH值为6.0,上样浓度为750 μg/mL,用75%乙醇洗脱,以1 BV/h流速洗脱5 BV;调节正丁醇部位黄酮pH值为6.0,上样浓度为1 mg/mL,用60%乙醇洗脱,以1 BV/h流速洗脱5 BV。
参考文献:
[1] 张国英,曾韬.辣蓼主要化学成分的研究[J].林产化学与工业,2005, 25(3):21-24.
[2] 常丽新,贾长红,高曼,等.丁香叶黄酮的抑菌作用研究[J].食品工业科技,2010,31(10):126-128.
[3] 张玉清,王帅,景娇,等.5种中药总黄酮成分体外抗病毒作用观察[J].南京农业大学学报,2012,35(4):105-109.
[4] 万利秀,肖更生,徐玉娟,等.柑橘皮黄酮纯化前后抗氧化性比较研究[J].食品科学,2011,32(5):87-91.
[5] 覃斐章,林兴,张绪东,等.柿叶黄酮的降血压作用及其作用机制研究[J].广西科学,2009,16(3):310-313.
[6] 王永红,龙晓莉,何菲,等.槐角总黄酮对高脂血症大鼠降血脂及抗氧化能力的实验研究[J].医学争鸣,2009,30(22):2677-2681.
[7] 郑立,邓红雨,李晓翠,等.大豆黄酮对犊牛生长性能及免疫机能的影响[J].中国奶牛,2011(14):50-51.
[8] LI J, CHASE H A. Characterization and evaluation of a macroporous adsorbent for possible use in the expanded bed adsorption of flavonoids from Ginkgo biloba L[J]. J Chromatogr A,2009,1216(50):8730-8740.
(收稿日期:2017-04-21)
(修回日期:2017-06-26;编辑:陈静)endprint
