尿微量白蛋白/尿肌酐比率与急性缺血性脑卒中早期神经功能恶化的相关性分析
2018-01-13程曦刘康钱云蔡颖源陆小伟陈伟贤
程曦,刘康,钱云,蔡颖源,陆小伟,陈伟贤
肾功能障碍是指出现微量白蛋白尿和肾小球滤过率(GFR)下降,已经被证实是心血管疾病和脑卒中的独立危险因素[1]。荟萃分析[2]显示,微量白蛋白尿和蛋白尿增加脑卒中风险达71%~92%。对急性冠脉综合征患者而言,微量白蛋白尿与不良预后相关。而且,微量白蛋白尿与脑卒中远期不良预后及复发密切相关[3]。
至今为止,肾功能障碍与急性缺血性脑卒中患者早期神经功能恶化(END)的关系仍未阐述清楚。既往研究[4]发现,蛋白尿与缺血性脑卒中患者不良预后独立相关,但这些研究均采用了半定量的浸渍检查法测定尿蛋白。为了探讨急性缺血性脑卒中患者微量白蛋白尿对END发生的影响,本研究采用了尿微量白蛋白/尿肌酐比率(UACR)定量的检测方法进行研究。
1 对象与方法
1.1 对象 本研究回顾性分析了2014年07月~2016月12月于南京医科大学第一附属医院老年医学科和神经内科住院的急性缺血性脑卒中患者216例。入选标准:(1)符合《中国急性期缺血性脑卒中诊治指南2014》中制定的脑卒中疾病诊断的标准,经头颅MRI证实诊断并排除了TIA、脑实质内出血、蛛网膜下腔出血或合并严重的脏器功能不全;(2)72 h内就诊的成年患者;(3)患者于入院当天、第2 d、3 d和第7 d分别完成NIHSS评分和复评;(4)临床及实验室检查资料完整。此外,根据神经系统症状、实验室及影像学检查和危险因素,由两名神经内科副主任医师进一步采用急性卒中Org0172治疗实验(TOAST)分型将缺血性脑卒中患者分为4型[5],分别为大动脉粥样硬化型、心源性栓塞型、小动脉闭塞型和其他原因。
1.2 方法
1.2.1 END的定义 采用NIHSS评分,在入院当天评估患者神经功能缺损情况,并由同一名神经内科医师于入院7 d内多次进行NIHSS复评。入院7 d内NIHSS总分增加≥2分定义为END。根据END发生与否将研究对象分为两组。
1.2.2 资料收集及治疗 所有研究对象在入院后完成人口学特征及脑卒中危险因素的资料采集和UACR测定。采集的资料包括:年龄、性别、高血压史、糖尿病史、冠心病史、心房纤颤(房颤)病史、血脂异常史、TIA或卒中史、吸烟史、饮酒史、入院时收缩压、入院时舒张压和NIHSS评分(入院时、第2 d、第3 d及第7 d)。高血压病定义为既往高血压病史、服用降压药物治疗或入院时收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg。糖尿病定义为既往糖尿病史或入院空腹血糖≥7 mmol/L或餐后2 h血糖≥11.1 mmol/L。血脂异常定义为既往高脂血症史或实验室检查符合以下条件之一:胆固醇>5.72 mmol/L、三酰甘油>1.7 mmol/L、低密度脂蛋白>3.64 mmol/L、高密度脂蛋白<0.91 mmol/L。房颤病史包括既往房颤病史和入院ECG或心电监测提示房颤。所有患者入院后均留取24 h尿液标本检测UACR,正常值为<30 mg/g。患者住院期间,严格按照《中国急性期缺血性脑卒中诊治指南2014》的要求进行抗血小板治疗、他汀调脂治疗及积极控制危险因素。
1.2.3 质量控制方法 (1)UACR检测严格按照《全国临床检验操作规程》第3版操作要求进行;(2)采集患者资料的临床医生均通过统一的培训,严格按照入选标准纳入研究对象;(3)遇到有争议的问题均行集中讨论,至少由2名神经内科专家参与。

2 结 果
2.1 患者一般临床资料 本研究最终共纳入216名符合入选条件的急性缺血性脑卒中患者。其中男141例,女75例;年龄36~93岁,平均(67.13±11.70)岁。所有研究对象中有高血压患者163例(75.6%),糖尿病患者90例(41.9%),血脂异常患者91例(42.1%),既往有卒中史患者74例(34.3%),合并房颤患者27例(12.5%),冠心病患者23例(10.7%)。吸烟患者63例(29.2%),饮酒患者43例(19.9%)。依据NIHSS评分,本组患者含轻度卒中(0~4分)147例,中度卒中(5~15分)66例,中-重度卒中(15~20分)2例,重度卒中(21~42分)1例。所有研究对象的TOAST分型结果、UACR检测结果和详细的NIHSS评分见表1。
2.2 END组和非END组的基本资料比较 在216名急性缺血性脑卒中患者中,42例(19.4%)患者符合END定义,归为END组;174例(80.6%)病情稳定,归为非END组。与非END组相比,END组患者饮酒比例、NIHSS评分和UACR水平显著增高,差异具有统计学意义(均P<0.05)。而两组患者间年龄、性别比例、高血压比例、糖尿病比例、血脂异常比例、冠心病比例、房颤比例、吸烟史、卒中病史和TOAST分型均无统计学差异(均P>0.05)。
2.3 END发生和危险因素关系分析 见表2。为构建稳定的回归模型,将年龄、性别、饮酒史、吸烟史、高血压病史、糖尿病史、UACR水平、NIHSS评分等指标作为自变量进行Logistic回归。矫正混杂因素后结果显示UACR水平是急性缺血性脑卒中患者发生END的独立危险因素(OR=4.54,95%CI:2.08~9.94,P<0.001)。
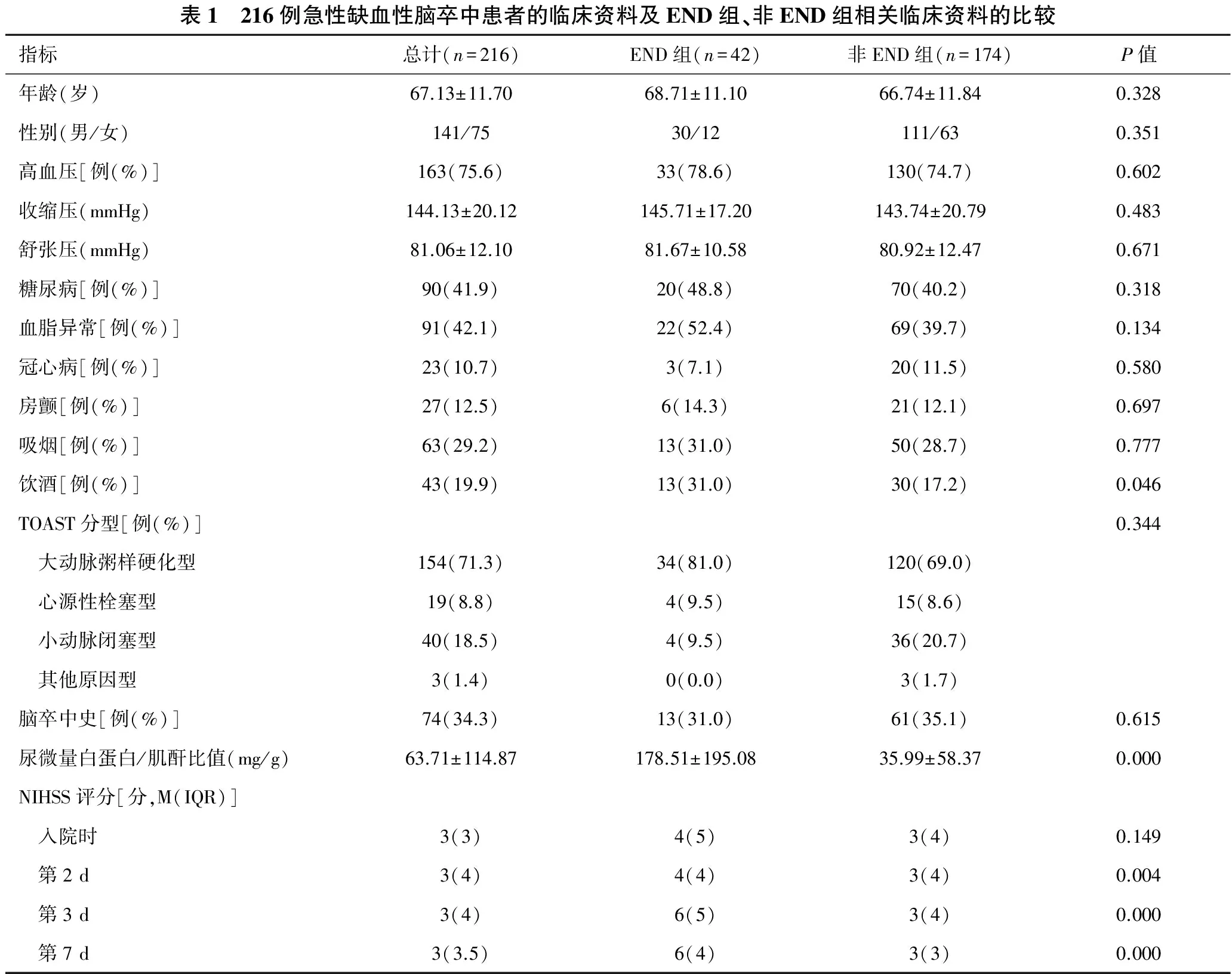
表1 216例急性缺血性脑卒中患者的临床资料及END组、非END组相关临床资料的比较指标总计(n=216)END组(n=42)非END组(n=174)P值年龄(岁)67.13±11.7068.71±11.1066.74±11.840.328性别(男/女)141/7530/12111/630.351高血压[例(%)]163(75.6)33(78.6)130(74.7)0.602收缩压(mmHg)144.13±20.12145.71±17.20143.74±20.790.483舒张压(mmHg)81.06±12.1081.67±10.5880.92±12.470.671糖尿病[例(%)]90(41.9)20(48.8)70(40.2)0.318血脂异常[例(%)]91(42.1)22(52.4)69(39.7)0.134冠心病[例(%)]23(10.7)3(7.1)20(11.5)0.580房颤[例(%)]27(12.5)6(14.3)21(12.1)0.697吸烟[例(%)]63(29.2)13(31.0)50(28.7)0.777饮酒[例(%)]43(19.9)13(31.0)30(17.2)0.046TOAST分型[例(%)]0.344 大动脉粥样硬化型154(71.3)34(81.0)120(69.0) 心源性栓塞型19(8.8)4(9.5)15(8.6) 小动脉闭塞型40(18.5)4(9.5)36(20.7) 其他原因型3(1.4)0(0.0)3(1.7)脑卒中史[例(%)]74(34.3)13(31.0)61(35.1)0.615尿微量白蛋白/肌酐比值(mg/g)63.71±114.87178.51±195.0835.99±58.370.000NIHSS评分[分,M(IQR)] 入院时3(3)4(5)3(4)0.149 第2d3(4)4(4)3(4)0.004 第3d3(4)6(5)3(4)0.000 第7d3(3.5)6(4)3(3)0.000

表2 急性缺血性脑卒中患者END的发生与相关危险因素的关系分析指标Logit回归系数S.E.OR95%CIP值年龄0.0310.0181.031.00~1.070.080性别0.2660.6021.300.53~3.220.564高血压0.2120.5641.240.51~3.020.642糖尿病0.0160.4041.020.47~2.220.968冠心病-0.9990.2600.370.09~1.470.158血脂异常0.5460.6581.730.82~3.640.152脑卒中史-0.1280.3630.880.39~1.970.756饮酒-0.2500.4040.780.28~2.150.629吸烟1.0411.5252.830.99~8.140.053UACR1.5141.8154.542.08~9.940.000NIHSS评分0.0160.0551.020.91~1.130.773
2.4 END发生和UACR水平相关性的分层分析 见表3。进一步对END发生与否和UACR水平相关性进行了分层分析,根据所有研究对象年龄的平均值、NIHSS评分的中位数值和UACR四分位数值进行分组,矫正混杂因素后,结果显示,UACR在年龄>67岁(OR=7.13,95%CI: 2.31~22.0,P=0.001)、男性(OR=4.71,95%CI: 1.80~12.36,P=0.002)、入院NIHSS评分>3分(OR=8.81,95%CI: 2.15~36.02,P=0.002)、合并高血压(OR=4.30,95%CI: 1.80~10.27,P=0.001)、大动脉粥样硬化型(OR=7.44,95%CI: 2.91~19.05,P<0.000)患者中与END的发生独立相关。无论血脂水平、糖尿病与否或既往有无脑卒中病史,UACR均是END发生的独立危险因素(P<0.05)。相对于血脂正常(OR=3.95,95%CI:1.35~11.62,P=0.012)、未合并糖尿病(OR=4.10,95%CI:1.39~12.07,P=0.010)、既往无脑卒中病史(OR=3.26,95%CI:1.27~8.35,P=0.014)的急性缺血性脑卒中患者而言,合并高脂血症(OR=5.91,95%CI:1.70~20.47,P=0.005)、并发糖尿病(OR=6.61,95%CI:1.79~24.42,P=0.005)、既往有脑卒中病史(OR=16.10,95%CI:2.79~92.84,P=0.002)的急性缺血性脑卒中患者发生END的风险有进一步增加趋势。对于UACR不同水平而言,本研究发现高水平的UACR与END的相关趋势更显著。

表3 急性缺血性脑卒中患者END的发生与UACR相关性的分层分析指标OR值95%CIP值年龄 ≤67岁2.700.81~9.030.107 >67岁7.132.31~22.00.001性别 男4.711.80~12.360.002 女4.420.96~20.380.057TOAST分型 大动脉粥样硬化型7.442.91~19.050.000 心源性栓塞型∗0.380.03~4.610.449 小动脉闭塞型∗8.190.65~102.420.103入院NIHSS评分 ≤3分2.670.87~8.240.087 >3分8.812.15~36.020.002脑卒中史 是16.102.79~92.840.002 否3.261.27~8.350.014血脂异常 是5.911.70~20.470.005 否3.951.35~11.620.012高血压 是4.301.80~10.270.001 否4.060.53~31.050.177糖尿病 是6.611.79~24.420.005 否4.101.39~12.070.010UACR(四分位数) Q1Reference Q211.0mg/g1.210.28~5.250.804 Q321.5mg/g3.380.90~12.780.072 Q449.3mg/g14.033.64~54.060.000 注:∗仅矫正了年龄和性别
3 讨 论
急性缺血性脑卒中是一种多因素引起的致残率高、中晚期并发症较多且严重,社会经济负担严重的脑血管疾病。近期日本一项关于微量白蛋白尿和肾小球滤过率估算值(eGFR)对急性缺血性脑卒中END的研究[6]显示,高水平UACR与急性缺血性脑卒中END独立相关,而eGFR减少并非END的独立预测因素。为了验证该研究结论,本研究回顾性分析了近2年收治的急性缺血性脑卒中患者UACR与END的相关性。结果显示,UACR升高可增加急性缺血性脑卒中END发生,考虑到混杂因素,进一步经多因素回归分析后发现结果仍具有显著性。急性缺血性脑卒中发生END的严重程度与UACR值增加呈正相关。
众所周知,急性心肌梗死并发症多发生在病程早期,因此该病死亡率较高。与之相反,急性缺血性脑卒中并发症多于病程中晚期发生,需要长期的康复治疗和护理,故致残率高,家庭及社会经济负担较重,增加了照料者的压力。对急性缺血性脑卒中END预测因素的掌握能够提高急性期的诊疗水平,减少患者住院时间。既往研究[7]发现,糖尿病、高水平的超敏C反应蛋白、入院时NIHSS评分高和血清n-3多不饱和脂肪酸水平下降可预测急性缺血性脑卒中END的发生。然而,这些研究并未关注肾功能损伤与急性缺血性脑卒中END之间可能存在的潜在联系。
最近两项研究[3,8]发现蛋白尿,而不是eGFR,与急性缺血性脑卒中远期预后不良(1年后Barthel指数≤ 75)和死亡率增加(30 d、90 d和1年)独立相关。然而,这些研究采用了浸渍检查法评估了尿蛋白[3]。与UACR检测方法相比,浸渍检查法仅仅是一种半定量方法,用于评估每天尿蛋白水平波动于300~500 mg。而且,浸渍检查法易于产生假阳性和假阴性结果[9]。本研究采用了UACR方法定量测定尿蛋白。Umemura等[10]研究发现,微量白蛋白尿仅与豆状核纹状体动脉区皮质下小梗死患者END相关。本研究结果证实UACR与大动脉粥样硬化型脑卒中END独立相关,比值越高与END发生的风险增加益发明显。
既往研究[11]显示,大脑和肾脏血管床具有相似的血流动力学特征。当考虑到脑梗死和肾功能损害时,这种血流动力学相似性就显得非常重要。有的临床试验[12]建议将微量白蛋白尿作为脑卒中预防的治疗靶点。作为肾功能损害和END的一个指标,微量白蛋白尿可能是全身血管内皮细胞损伤的一种标志。通过作用于非传统的血管危险因素,比如内皮细胞功能障碍、颈动脉重塑、炎性细胞因子、同型半胱氨酸、血管外凝集、内皮释放组织型纤溶酶原激活物受损和氧化应激,微量白蛋白尿可损伤神经系统[13-15]。Umemura等[10]报道,微量白蛋白尿,而不是eGFR减少与急性皮质下小卒中END独立相关。Cho等[16]研究显示,微量白蛋白尿与给予组织型纤溶酶原激活物治疗的急性缺血性脑卒中患者出血转化相关,提示微量白蛋白尿与内皮细胞损伤有关。本研究结果验证了这些假说,微量白蛋白尿可能与急性缺血性脑卒中END患者的脑血管损伤和动脉粥样硬化性改变相关。中国的烟酒文化源远流长,本研究发现饮酒也是急性缺血性脑卒中END的危险因素,提示酒精对神经系统长期轻微损伤后导致应激状态下大脑储备功能减退。
本研究是一个单中心、回顾性研究,样本量相对较少,研究结果需要多中心、大样本、前瞻性研究进一步证实。本研究检测的UACR仅仅是入院后次日清晨单一时间点尿标本。既往研究[17]显示微量白蛋白尿可能是缺血性脑卒中急性期的应激反应,而不是血管病变的生物学标志物。因此,不能排除UACR受到急性缺血性脑卒中后CNS应激影响的可能性。急诊内科医师对患者采取的治疗,比如甘露醇脱水降颅压,可能导致急性肾损伤,继而影响结果。减少微量白蛋白尿是否能够预防急性缺血性脑卒中患者END的发生值得临床医师需要进一步研究。
综上所述,急性缺血性脑卒中END可能由多种因素引起,而专科医师在临床工作中采用临床、实验室指标和影像学数据预测END价值有限。本研究证实了微量白蛋白尿可能与急性缺血性脑卒中END的发生独立相关。微量白蛋白尿的筛查方法简单、成本低,对评估急性缺血性脑卒中END的发生风险具有临床应用价值。目前,本研究组前瞻性研究已经开始启动,有助于阐明微量白蛋白尿在缺血性卒中急性期的确切作用机制。
[1] Nakamura K, Okamura T, Hayakawa T, et al. Chronic kidney disease is a risk factor for cardiovascular death in a community-based population in Japan: NIPPON DATA90[J]. Circ J, 2006,70:954.
[2] Lee M, Saver JL, Chang KH, et al. Impact of microalbuminuria on incident stroke: a meta-analysis[J]. Stroke, 2010,41:2625.
[3] Yahalom G, Schwartz R, Schwammentha Y, et al. Chronic kidney disease and clinical outcome in patients with acute stroke[J]. Stroke, 2009,40:1296.
[4] Kumai Y, Kamouchi M, Hata J, et al. Proteinuria and clinical outcomes after ischemic stroke[J]. Neurology, 2012,78:1909.
[5] Adams HP Jr, Bendixen BH, Kappelle LJ, et al. Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in Acute Stroke Treatment[J]. Stroke, 1993,24:35.
[6] Kanamaru T, Suda S, Muraga K, et al. Albuminuria predicts early neurological deterioration in patients with acute ischemic stroke[J]. J Neurol Sci, 2017,372:417.
[7] Suda S, Katsumata T, Okubo S, et al. Low serumn-3 polyunsaturated fatty acid/n-6 polyunsaturated fatty acid ratio predicts neurological deterioration in Japanese patients with acute ischemic stroke[J]. Cerebrovasc Dis, 2013,:36:388.
[9] Kruyt ND, Biessels GJ, Devries JH, et al. Hyperglycemia in acute ischemic stroke: pathophysiology and clinical management[J]. Nat Rev Neurol, 2010,6:145.
[10] Umemura T, Senda J, Fukami Y, et al. Impact of albuminuria on early neurological deterioration and lesion volume expansion in lenticulostriate small infarcts[J]. Stroke, 2014,45:587.
[11] Toyoda K. The cerebro-renal interaction in stroke neurology[J]. Neurology, 2012, 78:1898.
[12] de Zeeuw D. Albuminuria, not only a cardiovascular/renal risk marker, but also a target for treatment? [J]. Kidney Int Suppl, 2004,Suppl:S2.
[13] Ovbiagele B. Microalbuminuria: risk factor and potential therapeutic target for stroke? [J]. J Neurol Sci, 2008, 271:21.
[14] Satchell S. The role of the glomerular endothelium in albumin handling[J]. Nat Rev Nephrol, 2013,9:717.
[15] Tsuruoka S, Kai H, Usui J, et al. Effects of irbesartan on in?ammatory cytokine concentrations in patients with chronic glomerulonephritis[J]. Intern Med, 2013,52:303.
[16] Cho BH, Kim JT, Chang J, et al. Prediction of hemorrhagic transformation in acute ischaemic stroke by micro- and macroalbuminuria after intravenous thrombolysis[J]. Eur J Neurol, 2013,20:1145.
[17] Keane WF, Eknoyan G. Proteinuria, albuminuria, risk, assessment, detection, elimination (PARADE): a position paper of the National Kidney Foundation[J]. Am J Kidney Dis, 1999,33:1004.
