中药清毒栓对宫颈癌SiHa细胞产生免疫相关细胞因子的影响
2018-01-12楼姣英金哲李洋
楼姣英+金哲+李洋


[摘要] 目的 探讨中药清毒栓含药血清对宫颈癌SiHa细胞产生免疫相关细胞因子的影响。方法 选取SPF级SD大鼠雌性30只[体重(220±10)g],分成两组,分别用纯净水和中药灌胃处理后抽血提取含药血清,设立空白对照组(0%含药大鼠血清)、清毒栓低、中、高剂量组(浓度分别为1%、4%、8%含药大鼠血清),采用q-PCR法检测细胞IL-2、IL-8、TNF-α、IFN-γ的基因表达情况,采用Western Blot法检测SiHa细胞内IL-8、TNF-α的蛋白表达情况。结果 不同剂量的清毒栓含药血清在12 h、24 h、48 h对宫颈癌SiHa细胞免疫相关细胞因子的基因表达均有一定促进表达作用,其中以IL-8、TNF-α在8%浓度含药血清给药后12~24 h内呈现显著上升的趋势(P<0.05);细胞内IL-8、TNF-α蛋白表达量在高剂量组给药后48 h呈现显著上升的趋势。结论 高剂量清毒栓含药血清可显著诱导免疫相关细胞因子IL-8、TNF-α基因的表达,并能够使细胞内IL-8、TNF-α蛋白的表达量增加,其作用机制可能是通过促进相关基因的表达量来增加相应细胞因子蛋白的表达。
[关键词] 免疫相关细胞因子;SiHa细胞;中药清毒栓;含药血清
[中图分类号] R285 [文献标识码] A [文章编号] 1673-9701(2017)30-0033-04
[Abstract] Objective To investigate the effect of traditional Chinese medicine Qingdu suppository-containing serum on immune-related cytokines in SiHa cells of cervical cancer. Methods SPF grade SD rats(body weight of 220±10)g were selected, with 30 female rats, which were divided into two groups. The drug-containing serum was collected by blood drawing after the treatment of pure water and Chinese medicine gavage respectively. The blank control group (0% drug-containing rat serum), low, medium and high dose group of Qingdu suppository (concentrations of 1%, 4%, 8% of drug-containing rat serum) were set. The gene expression of IL-2, IL-8, TNF-α and IFN-γ was detected by q-PCR method, and the protein expression of IL-8 and TNF-α within SiHa cells was detected by Western Blot method. Results Different doses of Qingdu suppository-containing serum all showed a certain effect of expression promotion on the gene expression of immune-related cytokines in SiHa cells of cervical cancer at 12 h, 24 h, 48 h. The level of IL-8 and TNF-α was in a significantly increasing trend within 12 to 24 hours after the administration of 8% drug-containing serum(P<0.05); the protein expression volume of IL-8 and TNF-α in the cells was in a significantly increasing trend within 48 hours after the administration in the high-dose group. Conclusion The Qingdu suppository-containing serum in the high dose group can significantly induce the gene expression of immune-related cytokines IL-8 and TNF-α, and can increase the expression volume of intracellular IL-8 and TNF-α protein. Its mechanism may be by promoting the expression volume of related genes to increase the expression of the corresponding cytokine protein.
[Key words] Immune-related cytokines; SiHa cells; Chinese medicine Qingdu suppository; Drug-containing serum
宮颈癌在女性癌症中位居第二位,其发病率有逐年升高趋势,目前已经明确人乳头瘤病毒(human papilloma virus,HPV)感染是宫颈癌的首要病因[1]。在宫颈癌发生发展过程中,HPV感染后的细胞免疫功能下降是一个重要因素,导致病毒在体内持续存在并向肿瘤发展。临床研究已经证实中药清毒栓具有消除HPV的作用[2-4],前期的实验研究结果也显示,中药清毒栓可通过多种途径参与抗肿瘤作用[5-12]。细胞免疫因子IL-2、IL-8、TNF-α、IFN-γ是影响细胞免疫功能的重要因素。基于以前的研究,我们推测中药清毒栓可以通过促进相关免疫因子基因的表达,进而增加相应细胞因子蛋白的表达来起抗肿瘤作用。本研究以宫颈癌SiHa细胞为研究对象,探讨中药清毒栓对宫颈癌SiHa细胞免疫因子基因及蛋白表达量的影响,从分子水平上探讨中药在宫颈癌细胞中抗肿瘤的机制。endprint
1材料与方法
1.1实验材料
1.1.1 实验动物及分组 选取SD雌性大鼠30只,体重为(220±10)g。购自北京维通利华实验动物技术有限公司[京动许字(2000)第004号总049号]。随机分成空白血清组中药清毒栓组,每组15只。
SiHa细胞培养分组:阴性对照组(不加血清,即正常对照组)、空白对照组(加空白血清,即0%含药大鼠血清)、清毒栓低、中、高剂量组(浓度分别为1%、4%、8%含药大鼠血清)。每组各5例。
1.1.2药物与试剂 中药清毒栓(主要由莪术30 g、黄柏15 g、紫草15 g、金银花15 g等组成),将复方药物分别醇提(紫草)、提油(莪术)、水煎(黄柏)去渣浓缩后配成药液,浓度约为4.2 g/mL,高温消毒后于4℃冰箱密封保存。由中国中医科学院中药研究所制备。
细胞总RNA提取试剂盒,购自北京爱普拜生物技术有限公司;DNase I, Amplification Grade,购自Invitrogen公司;GoScriptTM Reverse Transcription System,购自Promega公司;SsoAdvancedTM SYBR Green Supermix,购自美国Bio-Rad公司。
1.1.3 细胞株 人宫颈癌SiHa細胞,购自中国医学科学院基础医学研究所。
1.1.4 仪器 普通PCR仪(C1000TM Thermal Cycler)、紫外凝胶成像(Bio-Rad Gel Doc XR+)、电泳仪(Powerpac)、微型离心机(Tornado),均购自美国Bio-Rad公司;4℃高速离心机(2-16PK),购自德国Sigma公司;微量分光光度计(NanoQTM),购自博奥生物有限公司。
1.2 方法
1.2.1提取含药血清 每日给药一次(灌胃),每只(220±10)g大鼠灌药量为(4.2±0.1)mL。连续灌服5 d,采血前12 h禁食,末次给药1 h后采集全部血液(尽可能多的采血);采全血后分离含药血清,进行含药血清的无菌处理。
1.2.2 q-PCR法检测 IL-2、IL-8、TNF-α、IFN-γ的基因表达情况:① 总RNA提取SiHa细胞传代后,分别加入3 mL含有不同浓度(8%、4%、1%和0%)含药血清和不含药大鼠血清(1%)的MEM新鲜培养基(含有10%FBS和1g/L青霉素+链霉素),均设2个复孔,分别在37℃、5%CO2培养箱中培养12 h、24 h、48 h,分别提取RNA。具体为:(1)取1 mL RNA提取缓冲液试剂于6-well中,涡旋混匀,室温放置10 min,其间涡旋3~4次;(2)加入200 μL三氯甲烷,涡旋混匀并室温放置10 min,其间涡旋3~4次;(3)4℃,13000 rPm离心15 min;(4)吸500 μL上清,加入500 μL异丙醇,轻柔混匀;(5)上吸附柱。待混合液全部完毕,用700 μL RPW清洗柱子两遍,每遍离心30 s;(6)将柱子空转离心2 min;(7)充分晾干沉淀,用50 μL 65℃预热的RNA Free Water溶解沉淀;(8)取1 μL进行电泳检测。
反转录合成cDNA及q-PCR检测 首先在PCR管中加入总体积为11.5 μL的预混试剂(分别为RNA 5 μg、Oligo(dT)15 Primer 0.5 μg、Nuclease-Free Water 6 μg)。然后,将混合物进行70°C下5 min预变性,完成后取出置于冰上。另外,配制预混试剂RT-Mix(分别为GoScriPtTM 5X Reaction Buffer4 μL、MgCl2 2 μL、PCR Nucleotide Mix1 μL、Recombinant RNasin Ribonuclease Inhibitor 0.4 μL、GoScriPtTM Reverse TranscriPtase 1 μL,共计8.4 μL),向上述预变性完成的每个样品中加入10 μL RT-Mix。设置反转录程序,包括退火、延伸、逆转录酶失活三步,反应条件:25℃:5 min;42℃:60 min;70℃:15 min;4℃:60 min,程序完成后得到cDNA。最后,设计相应引物,进行q-PCR检测。设计引物序列见表1。
1.2.3 Western blot法检测免疫因子的蛋白表达量 选取q-PCR法检测中基因表达显著增加的免疫因子,运用Western blot法检测其蛋白表达量情况,其具体操作步骤如下:(1)蛋白提取及浓度测定:取出SiHa细胞2×105个放入打样管用加入蛋白提取缓冲液进行打磨,将破碎好的样品在冰上放置1 h,用低温离心机离心(4℃,13 000 rPm,20 min);吸取上清放入1.5 mL离心管中再次使用低温离心机离心处理(4℃,13 000 rPm,20 min)后吸取上清备用。之后采用Bradford方法测定蛋白样品的浓度;(2)转膜:完成SDS-PAGE操作后,紫外激发后观察蛋白电泳状况,之后将此蛋白胶进行转膜操作,转膜用的夹子按照海绵-whatman滤纸-胶-PVDF膜-whatman滤纸-海绵-透明夹子部分夹好后用Bio-Rad湿式转膜装置进行转膜操作;将整个装置放置于大的冰盒中,加入TB-transfer buffer(恒流:400 mA)转膜2 h;(3)封闭:转膜完毕后,使用WB Enhancer Solution处理膜10 min,之后用PBS洗净,再用5%的脱脂奶粉(用PBS配置)封闭液进行封闭,室温下2 h或者4℃封闭过夜;(4)加入一抗:每个目标蛋白的一抗的稀释度为1:1000;(5)洗膜:PBST(PBS+0.1%Tween 20)洗5次,每次5 min;(6)加入二抗:每个目标蛋白的二抗的稀释度为1:1000;(7)洗膜:PBST洗5次,每次5 min后,加入超敏化学发光液处理3~5 min后直接仪器观察并照相。endprint
1.3 观察指标
免疫因子IL-2、IL-8、TNF-α、IFN-γ的基因表达和IL-8和TNF-α蛋白的表达。
1.4统计学方法
使用 SPSS 21.0统计学软件对数据进行统计分析,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析。P<0.05为差异具有统计学意义。
2 结果
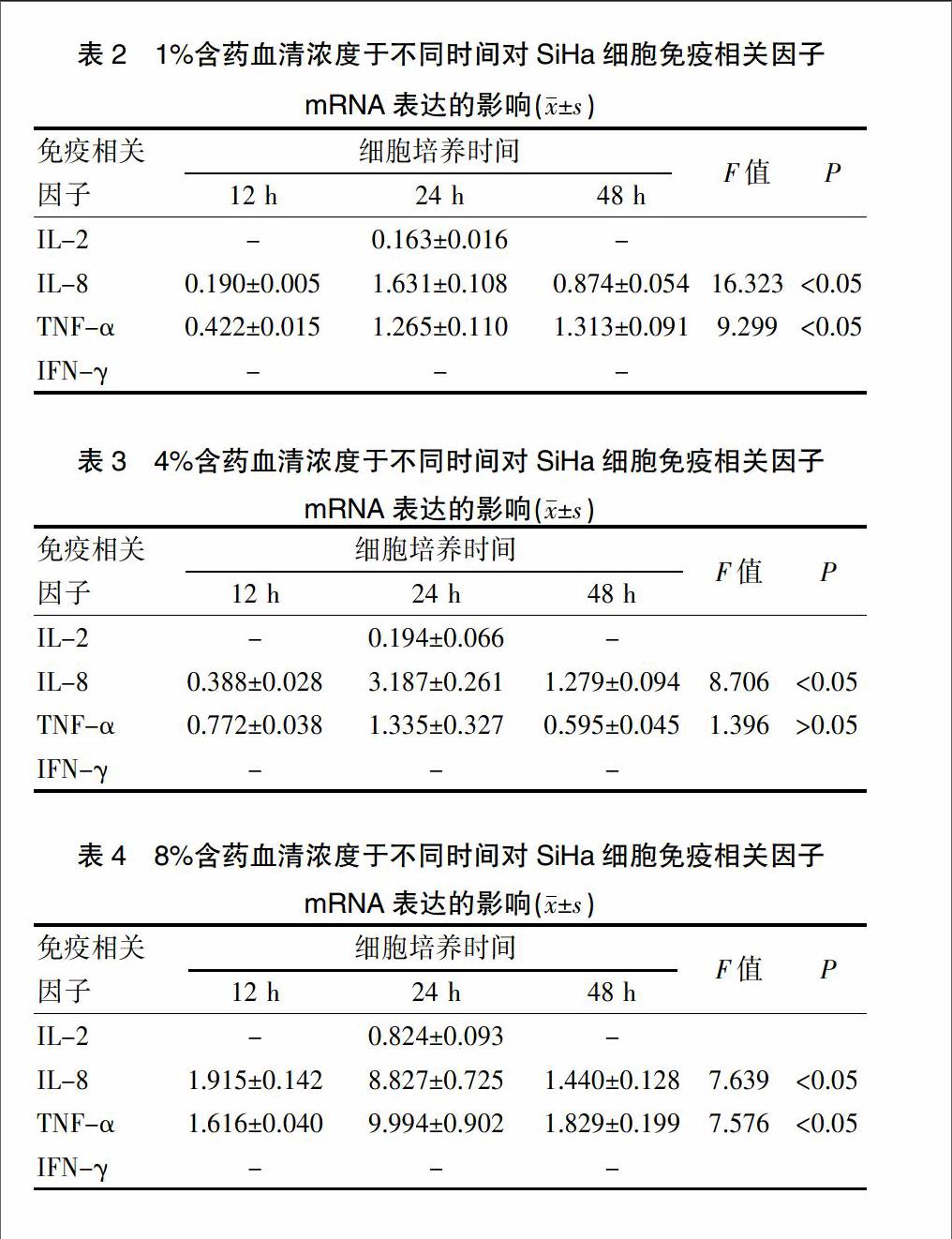
2.1 q-PCR法检测细胞因子mRNA表达
不同浓度含药血清于不同时间对SiHa细胞免疫相关因子mRNA表达结果见表2、表3、表4。在相同的时间内,IL-8、TNF-α的mRNA表达在12 h、24 h都呈上升趋势,48 h后下降。通过重复测量方差分析的检验,IL-8、TNF-α在1%浓度和8%浓度给药后12~24 h内呈现显著上升的趋势(P<0.05)。综合表2、表3、表4,通过两两比较发现,对于特定的免疫因子,IL-2仅在24 h后检测出表达量,在12 h、24 h均未能检测出表达,且随着含药血清浓度增加,mRNA表达增加。IL-8、TNF-α的mRNA表达随着含药血清浓度增加而增加,在相同时间内,24~48 h内增加的浓度显著大于12~24 h内增加的浓度(P<0.05)。
2.2 Western blot法检測结果
细胞内IL-8、TNF-α蛋白表达量在含药血清作用不同时间表达情况是定性实验,每组挑选1个样品进行试验,其灰度数值见表5、表6,Western blot电泳见图1。细胞内IL-8蛋白表达量在8%浓度给药后12~24 h内呈现显著上升的趋势,TNF-α蛋白表达量在8%浓度给药后12~24 h呈现显著上升的趋势。
3讨论
宫颈癌是临床上最常见的妇科恶性肿瘤之一,严重威胁妇女健康。有研究表明[13-14]中医药所含有的抗肿瘤成分可以通过直接细胞毒作用或提高免疫力等途径来达到抗肿瘤作用。中药复方具有“天然组合化学库”之称,作用机制可能是通过多种药物的药理效应共同起作用的结果,所以相对单一成分药物,复方中药有可能在疗效上更具有优势[15]。清毒栓主要是由莪术、黄柏、紫草等组成的复方中药。莪术抗肿瘤效应的研究已经达到分子水平,研究证实其主要成分姜黄素[16]具有抑制肿瘤细胞的作用,对处于各增殖周期的细胞均有不同程度的抑制作用。对于清毒栓抗肿瘤的分子机制,国内目前已有相当的研究基础。曹颖等[17]通过检测主要组织相容性复合物-Ⅰ(MHC-Ⅰ)抗原呈递通路相关分子TAP1、TAP2、LMP2、LMP7的蛋白及基因表达差异,认为中药清毒栓可通过调节抗原呈递通路相关分子的蛋白及基因表达,起到促进抗原呈递的作用,这可能是该方疗效的作用机制之一。金哲等[18]通过流式细胞技术,认为清毒栓及β-榄香烯可以上调HLA-Ⅰ蛋白及基因表达,从而加强宫颈癌细胞系HeLa表面的抗原呈递,可能是这两种药物帮助机体清除人乳头瘤病毒(HPV)感染及癌变细胞的机制之一。本研究从免疫因子的角度出发,通过检测经不同药物浓度处理的SiHa宫颈癌细胞中常见免疫因子IL-8、TNF-α的基因表达情况,并检测基因表达增高的因子蛋白表达量的变化,拟在免疫因子角度解释清毒栓抗肿瘤作用。
本研究表明,不同剂量的清毒栓在12 h、24 h、48 h对宫颈癌SiHa细胞免疫相关细胞因子的基因表达均有一定促进作用,其中以IL-8、TNF-α在8%浓度给药后12~24 h内呈现显著上升的趋势(P<0.05)。肿瘤坏死因子(TNF-α)是由巨噬细胞和单核细胞分泌的一种多肽激素,是一种重要的细胞因子,是多种生理反应和免疫过程的重要介质[19]。IL-8是由单核-巨噬细胞产生的细胞因子,主要促进嗜中性粒细胞趋化、脱粒、释放溶酶以加强炎症防护;促进T 细胞趋化游走以加强机体免疫反应[20]。这提示清毒栓可通过促进IL-8、TNF-α的基因表达来提高机体抗肿瘤能力,尤其是高剂量的清毒栓,对刺激基因的表达更为有效,但是具体通过哪一种途径激活相关基因的表达,需要进一步深入至分子信号通路途径方面的研究。通过进一步检测IL-8、 TNF-α蛋白表达情况,分析表达量随时间浓度的关系,我们发现,细胞内IL-8、 TNF-α蛋白表达量在高剂量组给药后48 h呈现显著上升的趋势(P<0.05)。这证实高剂量的清毒栓可能通过刺激IL-8、 TNF-α基因的表达,进而促进IL-8、 TNF-α蛋白的表达。明确清毒栓主要起刺激作用的免疫因子,对进一步研究清毒栓抗肿瘤机制的免疫学研究有重要指导作用。
[参考文献]
[1] Jan Gaylord Vanslyke, Julie Baum, Veronica Plaza,et al. HPV and cervical cancer testing and prevention:Knowledge, beliefs,and attitudes among hispanic women[J]. Qual Health Res,2008,18(5):584-596.
[2] 楼姣英,金哲. 清毒栓治疗宫颈高危型人乳头瘤病毒(HR-HPV)感染的临床对照研究[A]. 第八届全国中西医结合妇产科学术大会[C]. 第八届全国中西医结合妇产科学术大会:279,2012-10-14.
[3] 金哲,宋爱武,李仁杰.清毒栓治疗宫颈人乳头瘤病毒感染的临床研究[J].中国中西医结合杂志,2002,10(10):735-737.
[4] 金哲,楼姣英. 清毒栓治疗宫颈人乳头瘤病毒(HPV)亚临床感染的临床研究[J]. 中华中西医临床杂志,2006, 6(2):20-22.
[5] 金哲,楼姣英,艾浩. 清毒栓抗炎作用的实验研究 [J]. 中华中西医临床杂志,2006,6(2):117,121-122.endprint
[6] 金哲,李云波. 清毒栓血清药理对宫颈癌SiHa细胞p53基因调控作用的研究[J]. 天津中医药,2007,24(1):47-50.
[7] 李云波,金哲. 清毒栓含药血清对宫颈癌SiHa细胞MDM2基因的影响[J]. 中国中西医结合杂志,2007,27(2):147-150.
[8] 金哲,张雁. 清毒栓对宫颈炎模型大鼠部分炎性细胞因子的影响[A]. 金哲.全国第七届中西医结合妇产科学术会议[C]. 全国第七届中西医结合妇产科学术会议:154,2007-10-01.
[9] 楼姣英,金哲,李云波. 清毒栓血清药对宫颈癌SiHa细胞凋亡及周期的影响[J]. 北京中医药,2008,27(7):563-565.
[10] 佟庆,张雁,金哲. 清毒栓抗炎及诱发干扰素作用的实验研究[J]. 中华中西医临床杂志,2008,8(9):684-687.
[11] 楼姣英,于妍妍,金哲. 中药清毒栓对宫颈癌SiHa细胞P53泛素化降解途径的实验研究[J]. 北京中医药,2009,28(1):55-57.
[12] 徐翠,金哲. 清毒栓含药血清对宫颈癌SiHa细胞凋亡相关蛋白Bcl-2、Bax表达的影响[J]. 北京中医药,2009,28(4):302-304.
[13] 赵建平,王媛媛. 人参多糖体外诱导人非小细胞肺癌A549细胞凋亡的实验研究[J]. 中国中西医结合杂志,2006,26(基础理论研究特集):95-97.
[14] 韩子敏,王巧凤,高福音. 黄芪与川芎嗪注射液加免疫化学治疗转移性肾癌的临床观察[J]. 中国中西医结合肾病杂志,2005,6(8):481-482.
[15] 周俊. 中药复方──天然组合化学库与多靶作用機理[J]. 中国中西医结合杂志,1998,18(2):67.
[16] Harrington DJ,Lessey BA,Rai V,et al. Tenascin is differentially expressed in endometrium and endometriosis[J]. J Pathol,1999,187(2):242-248.
[17] 曹颖,金哲,楼姣英. 中药清毒栓对HeLa细胞MHC-Ⅰ抗原呈递通路相关分子表达的影响[J]. 中华中医药杂志,2014,29(12):3926-3929.
[18] 金哲,曹颖,于妍妍. 清毒栓及β-榄香烯对宫颈癌HeLa细胞HLA-Ⅰ类抗原表达的影响[J]. 北京中医药大学学报,2012,35(8):529-534.
[19] 谢丛华,周云峰. 肿瘤坏死因子的多重临床意义[J]. 国外医学(内科学分册),2005,32(6):247-249,268.
[20] 李克勤,曹传蕴,田小平. 子宫癌患者血清中TNF、IL-8水平的变化及其临床意义[J]. 淮海医药,2003,21(1):3-4.
(收稿日期:2017-08-22)endprint
