柠檬酸-β-环糊精共聚物对铜离子的吸附性能
2018-01-12曾安蓉陈汝盼李云龙汪扬涛
曾安蓉,陈汝盼,李云龙,汪扬涛
(1.黎明职业大学 材料与化学工程学院,福建 泉州 362000;2.实用化工材料福建省高校应用技术工程中心,福建 泉州 362000)
现代工业的飞速发展带来了大量的重金属离子污染物。吸附法是常用的废水处理方法,主要利用物理或者化学原理,吸附、捕捉废水中的重金属离子,例如使用活性炭、蒙脱土等吸附水中重金属离子[1-2]。由于分子中的羧酸基团、磷酸基团具有孤电子对,在水中电离为阴、阳离子,阳离子如氢离子或者钠离子,可以被其他金属离子如铜离子、铅离子等取代,进入络合环中与阴离子基团形成络合物[3]。柠檬酸的分子带有三个羧酸基团,在水中电离捕捉多种金属离子形成络合物,可用于除去废水中的重金属离子。但柠檬酸具有水溶性,即使捕捉到重金属离子,也难以将其从水体中分离出来,因此需要将柠檬酸制备成不溶于水的聚合物。β-环糊精(β-CD)是淀粉酶解的产物之一,具有空心圆筒环状结构,在外缘含有大量的亲水羟基,而内腔由于受到—C—H键的屏蔽作用呈现疏水性,在环境中无毒副作用。β-CD上含有的大量羟基,可以与柠檬酸上的羧基反应,制得不溶于水的共聚物,发挥二者的吸附作用。因此,本文利用柠檬酸分子上的3个羧酸基团,与β-CD带有的羟基进行体形缩聚反应,得到具有配体特征的柠檬酸-β-CD共聚物(CDP);然后以典型重金属离子污染物铜离子为代表,研究CDP用量、铜离子溶液的初始浓度、pH值、吸附温度以及吸附时间对最终铜离子吸附容量的影响,并进行等温吸附模型分析和吸附动力学分析,为探索CDP在废水处理方面的应用提供一些参考。
1 实验部分
1.1 主要试剂和仪器
β-CD,上海阿拉丁生化科技股份有限公司,纯度为96%;磷酸二氢钠、柠檬酸、硫酸铜、硝酸、PEG-400等,购自西陇化工股份有限公司,分析纯。原子吸收光谱仪(A3型),北京普析通用仪器有限责任有限公司。
1.2 CDP的制备
将β-CD和一水合柠檬酸以质量比1︰2的比例置于烧瓶中,加入磷酸二氢钠作为催化剂,以PEG-400作为改性剂,加入适量的蒸馏水,在100 ℃油浴锅中加热使得反应物充分溶解、反应。反应30~60 min后,体系粘度突增,到达凝胶点,将反应物转移到培养皿中,置于120~140 ℃恒温鼓风干燥箱中进行充分反应。反应结束后,取出培养皿中的产物,在蒸馏水中充分洗涤,抽滤并将滤饼转移至60 ℃烘箱中干燥。最后,将干燥得到的CDP破碎、研磨,得到所需产物[4]。CDP合成路线如图1所示。
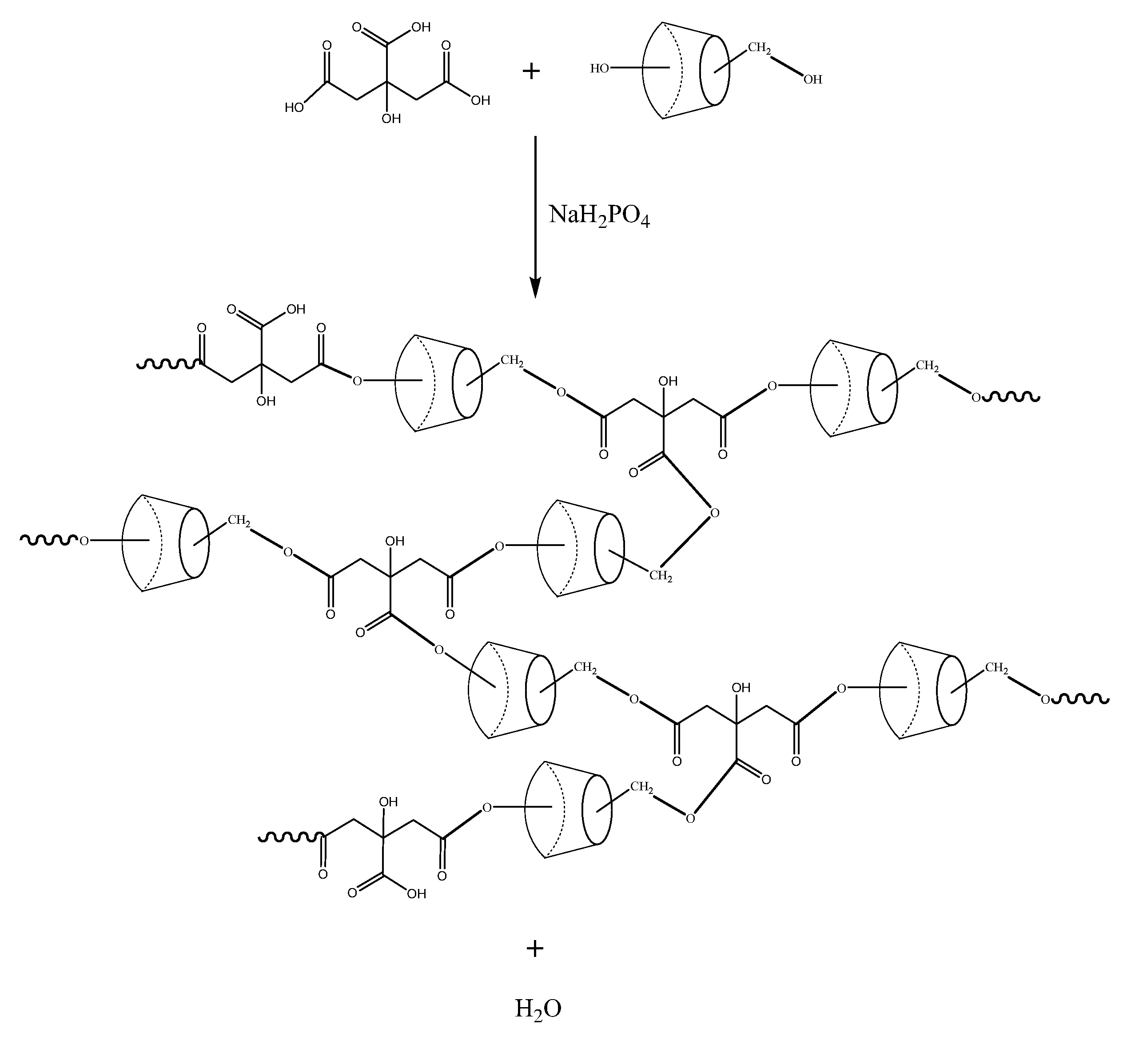
图1 CDP的制备路线
1.3 铜离子吸附性能测试
1.3.1 CDP用量对铜离子吸附性能的影响
在30 mL初始浓度为50 mg·L-1的铜离子溶液中,分别加入0.05~0.5 g CDP进行静置吸附性能测试,控制吸附温度为30 ℃,吸附时间为24 h。吸附完毕后对吸附体系进行离心分离,采用原子吸收光谱仪测量上清液铜离子浓度Ce,计算CDP的铜离子吸附容量qe[1]计算式为:

(1)
式(1)中:
qe—CDP对铜离子的吸附容量(mg·g-1);
C0—初始铜离子浓度(mg·L-1);
Ce—最终铜离子浓度/平衡浓度(mg·L-1);
V—被吸附液的体积(L);
M—CDP的投放量(g)。
1.3.2 铜离子初始浓度和温度对铜离子吸附性能的影响
在30 mL初始浓度为50~600 mg·L-1的铜离子溶液中,加入0.5 g CDP进行静置吸附性能测试,控制吸附温度分别为20、30、40和50 ℃,吸附时间为24 h。参考节1.3.1计算CDP吸附容量qe。
1.3.3 pH值对铜离子吸附性能的影响
取30 mL初始浓度为50 mg·L-1铜离子溶液,利用浓硝酸调节溶液的pH值为1~7(CDP为聚酯类,在碱性条件水解),加入0.5 g CDP进行静置吸附性能测试,控制吸附温度为30 ℃,吸附时间为24 h。参考节1.3.1计算铜离子吸附容量qe。
1.3.4 吸附时间对铜离子吸附性能的影响
在30 mL初始浓度为50 mg·L-1的铜离子溶液中,加入0.5 g CDP进行静置吸附性能测试,控制吸附温度为30 ℃,吸附时间为15~240 min。参考节1.3.1计算铜离子吸附容量qe。
1.3.5 等温吸附模型分析
等温吸附线,即为在一定温度下,测定被吸附质的吸附平衡数据Ce,并绘制成吸附剂上吸附质的吸附容量qe与Ce的关系曲线[5]。基于节1.3.2的吸附数据,进行等温吸附模型拟合分析。常用于拟合等温吸附的模型主要有Langmuir单分子层吸附模型,其计算式为:
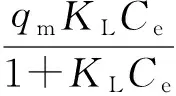
(2)
式(2)中:
qe—CDP对铜离子的吸附容量 (mg·g-1);
Ce—被吸附液的最终铜离子浓度(平衡浓度)(mg·L-1);
qm—吸附剂表面全部被单分子层覆盖的饱和吸附容量 (mg·g-1);
KL—吸附平衡常数 (L·mg-1)。
以及Freundlich模型,其计算式为[6]:
(3)
式(3)中:
qe—CDP对铜离子的吸附容量 (mg·g-1);
Ce—被吸附液的最终铜离子浓度(平衡浓度)(mg·L-1);
n—吸附特征系数;
KF—吸附系数常数 (mgn+1·(g·Ln)-1)。
1.3.6 吸附动力学分析
用动力学模型来拟合实验数据,探究吸附机理,常使用的吸附动力学模型由准一级动力学模型和准二级动力学模型,计算式分别为:[7]
qt=qe1-qe1e-k1t,
(4)
(5)
式(4)、式(5)中:
qe—CDP对铜离子的吸附容量 (mg·g-1);
t—吸附时间 (min);
qt—时间为t时的吸附容量 (mg·g-1);
k1—一级吸附速率常数(min-1);
k2—二级吸附速率常数(g·mg-1·min-1)。
2 结果与讨论
2.1 吸附剂用量对铜离子吸附容量影响
考察CDP用量对最终吸附容量的影响,如图2所示。
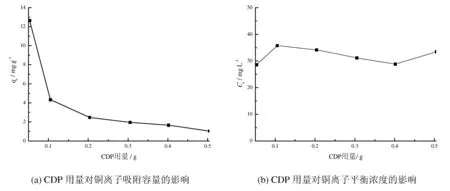
图2 CDP用量对吸附容量和吸附平衡浓度的影响
图2中,随着吸附剂用量的增多,对铜离子的吸附容量逐渐减少。吸附后铜离子的平衡溶度则在28~35 mg·L-1之间波动,而不随着CDP用量的增多有显著的变化。这说明在铜离子吸附过程中,初始浓度与最终平衡浓度之间的浓度差推动CDP对铜离子的吸附,当铜离子浓度降低时,浓度差的推动力随之减小。在后续实验中,为了方便实验操作,将CDP的使用量固定为0.5 g。
2.2 初始浓度和温度对铜离子吸附容量影响
铜离子初始浓度对CDP吸附容量的影响,如图3所示。CDP对铜离子的吸附容量随着铜离子初始浓度的增加而增大,这主要是因为较大的初始浓度有利于在CDP与铜离子之间建立较大的浓度差推动力。图3也能观察到温度对最终吸附容量的影响。在20 ℃下的吸附容量略低于30、40和50 ℃的吸附容量,当温度高于30 ℃,温度对吸附容量的影响较小,升高温度对吸附行为的贡献不显著。

图3 铜离子初始浓度对CDP吸附容量的影响 图4 pH值对CDP吸附容量的影响
2.3 pH值对铜离子吸附容量影响
pH值对铜离子吸附的影响如图4所示。在中性条件下,CDP对铜离子吸附容量最大,当pH值减小至4时,吸附容量最小。随着pH值进一步减小,CDP对铜离子的吸附容量逐渐增多。当pH<4时,溶液中铜离子主要以Cu2+形式存在;当pH=4~6时,主要以Cu2+和Cu(OH)+形式存在,还存在少量的Cu(OH)和Cu(OH)2;当pH=6~7时,主要以沉淀Cu(OH)2和少部分Cu(OH)存在[7]。实验结果表明,当pH=1,CDP的吸附容量较高,这可能是因为CDP表面羧基与此pH下大量存在的Cu2+发生络合反应,以及环糊精表面的羟基对铜离子的结合,大大降低溶液中铜离子的浓度;随着pH逐渐增大,可络合的Cu2+逐渐减少,柠檬酸羧基的络合作用无法发挥,减小了CDP的吸附容量,导致在pH=4时,吸附容量最小;随着pH值的进一步增大,虽然可络合的Cu2+逐渐减少,但是Cu(OH)2仍与环糊精表面的羟基通过氢键结合[8],亦减少了溶液中铜离子的平衡浓度。
综合以上的分析,当吸附剂用量为0.5 g,铜离子溶液的初始浓度为600 mg·L-1,pH值为7,吸附时间为24 h,吸附温度为30 ℃时,CDP对铜离子的最大吸附容量为18.15 mg·g-1。
2.4 吸附时间对铜离子吸附容量影响
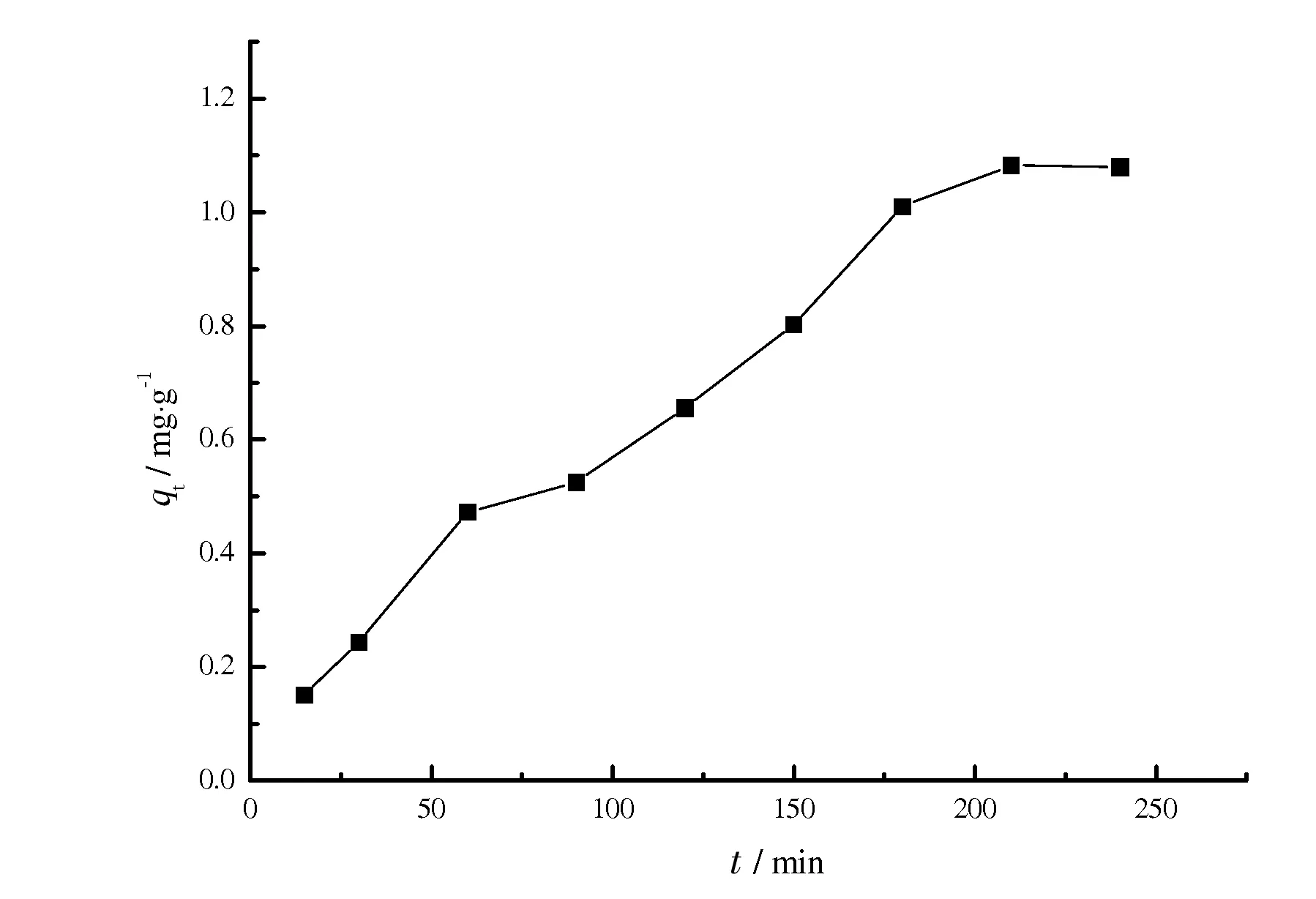
图5 吸附时间对CDP吸附容量的影响
在30 ℃下,CDP对铜离子的吸附容量与时间的变化关系如图5所示。经过240 min后,CDP对铜离子的吸附基本达到吸附平衡。吸附初期,被CDP吸附的铜离子量逐渐增加,随着吸附过程的进行,铜离子浓度逐渐降低,其在CDP内部扩散的阻力逐渐增加,铜离子的浓度梯度差推动力越来越小,导致吸附后期吸附速率变慢,吸附达到平衡[9]。
2.5 等温吸附模型分析
图6为Langmuir和Freundlich等温线对CDP的吸附过程拟合结果,拟合参数见表1。由拟合结果可知,CDP对铜离子的吸附更加符合Freundlich模型,说明以多层吸附为主[6]。
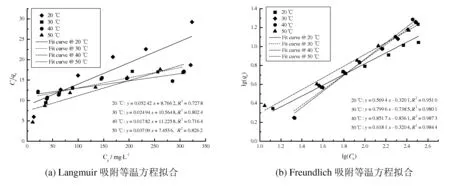
图6 CDP的吸附等温方程拟合结果

温度/KLangmuirR2qmax/mg·g-1KL/L·mg-1FreundlichR2KF/mgn+1·(g·Ln)-1n293.150.727819.080.00600.95100.47851.7562303.150.802440.100.00240.98010.18261.2506313.150.716456.120.00160.98730.14581.1741323.150.826226.960.00500.98440.47821.6179
2.6 吸附动力学分析
在吸附动力学研究中,使用准一级和准二级吸附动力学模型对实验数据进行拟合,分析铜离子吸附容量随着吸附时间的变化关系,结果如图7和表2所示。实验结果表明,准一级动力学方程更符合CDP对铜离子的动态吸附过程,相关系数高于准二级动力学方程拟合结果。此外,由准一级动力学方程拟合得到的平衡吸附容量为1.634 mg·g-1,更接近240 min的吸附结果。

图7 吸附动力学拟合图
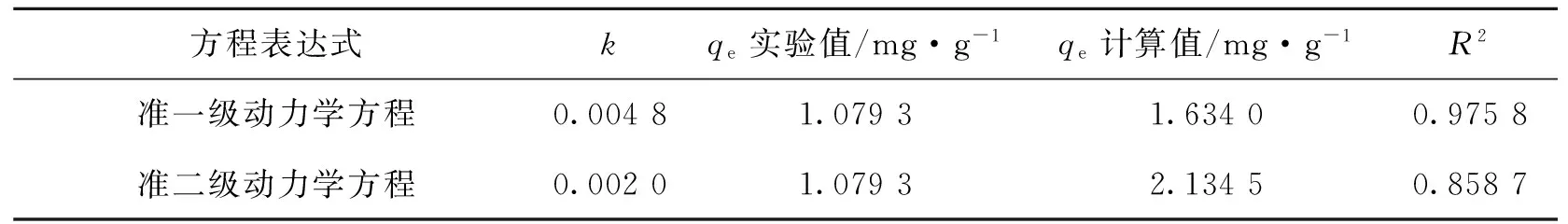
方程表达式kqe实验值/mg·g-1qe计算值/mg·g-1R2准一级动力学方程0.00481.07931.63400.9758准二级动力学方程0.00201.07932.13450.8587
2.7 CDP吸附机理的探讨
在CDP的制备过程中,CDP制品上带有未被酯化的自由羧基,这部分羧基与铜离子发生络合反应,环糊精带有的羟基也与铜离子发生氢键结合,减少铜离子在水中的浓度。仲凯凯等[10]使用柠檬酸钠对活性炭进行浸渍改性,提高活性炭对铜离子的吸附能力。此外,张汝壮等[11]利用柠檬酸对大豆秸秆材料进行改性,将羧基引入大豆秸秆中,亦提高大豆秸秆对铜离子的吸附容量。本文所制备的CDP对水中铜离子具有一定的吸附能力,有望应用于废水处理,未来将进一步测试其对其他重金属离子污染物的吸附特性,扩大其应用范围。
3 结 论
利用柠檬酸对重金属离子的络合能力,制备了CDP共聚物,使其在水溶液中能够捕捉铜离子。在本文实验条件下,当吸附剂用量为0.5 g,铜离子溶液的初始浓度为600 mg·L-1,pH值为7,吸附时间为24 h,吸附温度为30 ℃时,CDP对铜离子的最大吸附容量为18.15 mg·g-1。此外,CDP对铜离子的吸附符合Freundlich模型,属于多分子层吸附。CDP对铜离子的动态吸附动力学表面吸附符合准一级吸附动力学方程,吸附240 min时达到平衡。
[1] 杜尔登,崔旭峰,宋澄杰,等.吸附性碳材料对水中痕量邻苯二甲酸二甲酯的吸附性能及特征研究[J].给水排水,2013(7):125.
[2] 曾安蓉,曾安然,庄汝婷,等.环糊精-蒙脱土复合材料的制备及吸附性能研究[J].黎明职业大学学报,2017(1):70.
[3] 刘艺芸,崔爽,张倩茹,等.可降解氨基羧酸型螯合剂在重金属污染土壤修复中的应用研究进展[J].山东农业科学,2015(5):136.
[4] 俞丹,吴玲玲,杨杰,等.β-环糊精/壳聚糖膜的制备及在废水处理中的应用[J].印染,2013(2):15.
[5] 韩瑾.膨润土吸附材料制备及对铜离子的吸附行为研究[D].西安:西安科技大学,2014.
[6] XING M,WANG J.Nanoscaled zero valent iron/graphene composite as an efficient adsorbent for Co(II)removal from aqueous solution[J].Journal of Colloid & Interface Science,2016(474):119.
[7] 唐文清,曾荣英,冯泳兰,等.柠檬酸改性柚子皮纤维素对废水中铜离子的吸附[J].过程工程学报,2012(5):776.
[8] 吴宁.壳聚糖/β-环糊精/二氧化钛多孔吸附膜制备及含铜废水处理研究[D].南京:南京航空航天大学,2015.
[9] 苏秀霞,杨祥龙,李仲谨,等.淀粉微球对Pb2+的吸附及动力学研究[J].水处理技术,2009(4):57.
[10] 仲凯凯,黄张根,韩小金,等.柠檬酸钠改性的活性炭对铜离子的吸附性能[J].新型炭材料,2013(2):156.
[11] 张汝壮,周彦波,顾晓晨,等.柠檬酸改性大豆秸秆材料对铜离子的吸附性能[J].科技导报,2014(14):15.
