基于桥联双水杨醛结构的新型聚Salen-Zn(II)配合物的设计合成及性能研究
2018-01-12聂守杰姚小泉
聂守杰 喻 敏 黄 翔 姚小泉
(南京航空航天大学材料科学与技术学院,江苏 南京 210016;*南京晓庄学院环境科学学院,江苏 南京 211171)
基于桥联双水杨醛结构的新型聚Salen-Zn(II)配合物的设计合成及性能研究
聂守杰 喻 敏*黄 翔 姚小泉
(南京航空航天大学材料科学与技术学院,江苏 南京 210016;*南京晓庄学院环境科学学院,江苏 南京 211171)
本文以各种桥联双水杨醛与不同的二胺反应合成一系列聚Salen配体及其相应的锌(II)配合物。通过核磁共振、红外光谱确定物质的化学结构;利用紫外吸收光谱和荧光发射光谱研究它们的发光性能,并计算物质的荧光量子效率为:0.71%~1.65%;热重分析测得锌(II)配合物的热分解温度高于400 ℃,具有较好的热稳定性;循环伏安法确定其能级带隙约为2.32~2.95 eV。通过分子设计可以改变材料的发光波长、荧光量子效率、热稳定性等性能。
桥联双水杨醛 聚Salen配体 锌(II)配合物 荧光量子效率
有机电致发光器件(Organic Light-Emitting Device, OLED)具有驱动电压低、视角宽、响应速度快、全固化、主动发光、热稳定性好、可实现柔性显示等特点。近年来,引起越来越多的科学研究者们的关注[1]。1987年,Tang等[2]用8-羟基喹啉铝(Alq3)作为发光材料制成双层结构的有机电致发光二极管(OLED),作为一类新的固体光源,吸引人们去合成新的金属配合物并研究其发光性能,开拓了有机电致发光材料及器件研究的新局面。1993年,Hamada等[3]利用水杨醛缩胺类希夫碱锌配合物成功制备了蓝光EL器件;2009年,Hwang等[4]报道了Salen-Al (Salen:水杨醛缩二胺)的光谱性质;2010年,Vashchenko等[5]利用水杨醛缩二胺类希夫碱锌配合物成功制备了结构为ITO/α-NPD/ ZnL/Ca:Al四种电致发光器件,均为黄绿光发射。希夫碱类有机金属配合物具有好的热稳定性和发光性能,易于合成,通过分子设计可以改变化合物的溶解性[6, 7];且研究表明双希夫碱类金属配合物具有电荷平衡和配位饱和的特点,可以得到非常纯的荧光,是具有广阔应用前景的一类有机发光材料。而聚合物发光材料则有着良好的加工性能和机械性能,通过不同取代基的引入可以实现全色发光。
合成了桥联双水杨醛与单胺反应的双希夫碱配体;并与锌(II)配位,形成配位聚合物[8];该类化合物具有简便的合成方法,合理的荧光量子效率,较高的热分解温度及合理的能级结构,具有作为有机电致发光材料的潜力。

图1 基于双酚A结构的聚Salen-Zn(II)的结构式Fig 1 Poly-salen-Zn(II) based on the backbone of bisphenol A
本文以各种桥联双水杨醛与不同的二胺反应合成了一系列新型聚合物有机电致发光材料聚Salen-Zn(II)配合物,结构如图1,并研究了其发光性能,热稳定性,能级带隙和量子效率等。
1 实验部分
1.1 仪器与试剂
NEXUS 670红外光谱仪,ARX-300核磁共振仪,Cary-Varian 500紫外-可见分光光度计(美国Varian公司),Cary Eclipse荧光光度计(美国Varian公司),Netzsch 409 PC热分析仪。
1.2 实验步骤

图2 合成路线Fig 2 The synthesis route
1.2.1聚Salen配体(1a1~1d3)的合成
氮气保护下,向Schlenk管中加入基于双酚A结构的桥联双醛1 mmol (1 eq),芳香或脂肪二胺1.1 mmol (1.1 eq),3 mL 1,2-二氯乙烷,80 ℃回流反应24 h。反应结束后加入2 mL无水乙醇,有固体析出,离心分离(或过滤),依次用无水乙醇、乙醚洗涤。干燥、称重,得到目标产物。
表征数据:
1a1yield 84.7%. IR (KBr压片):ν(cm-1) 3 058,2 966,1 616,1 496,1 424,1 387,1 282,1 176,1 106,976,887,827,743;1H NMR (CDCl3,300 MHz):δ(ppm) 12.96 (s,2 H),8.55 (s,2 H),7.25~7.21 (m,8 H,),6.93 (d,J= 7.8,2 H),1.64 (s,6 H);13C NMR (CDCl3,300 MHz):δ(ppm) 196.41,163.38,158.00,142.30,140.65,131.82,129.78,127.29,119.09,118.16,116.85,41.22,30.55.
1b1yield 91.0%. IR (KBr 压片):ν(cm-1) 3 068,2 965,1 618,1 560,1 459,1 355,1 282,1 242,1 214,1 164,973,880,826,741,633;1H NMR (CDCl3,300 MHz):δ(ppm) 13.67 (s,2 H),8.55 (s,2 H),7.67~7.38 (m,3 H),7.17~ 7.05 (m,5 H),1.66 (s,6 H);13C NMR (CDCl3,300 MHz):δ(ppm) 196.36,165.31,164.29,163.70,141.85,134.99,130.20,128.26,120.50,119.61,111.20,41.88,30.96.
1c1yield 73.8%. IR (KBr 压片):ν(cm-1) 3 030,2 965,1 615,1 577,1 464,1 386,1 364,1 281,1 190,1 110,1 030,973,884,794,754,697;1H NMR (CDCl3,300 MHz):δ(ppm) 13.59 (s,2 H),8.62 (s,2 H),7.61~7.18 (m,18 H),1.71 (s,6 H);13C NMR (CDCl3,300 MHz):δ(ppm) 197.21,164.12,156.96,142.60,138.47,137.95,133.19,130.17,129.51,128.25,127.79,127.20,119.70,119.08,41.95,31.24.
1d1yield 83.9%. IR (KBr 压片):ν(cm-1) 3 026,2 965,1 614,1 486,1 455,1 386,1 281,1 191,1 110,1 039,1 007,972,885,840,731,696,585;1H NMR (CDCl3,300 MHz):δ(ppm) 13.93 (s,2 H),8.93 (s,2 H),7.68~7.40 (m,26 H),1.71 (s,6 H);13C NMR (CDCl3,300 MHz):δ(ppm) 197.23,163.98,157.10,142.60,141.04,136.92,132.99,129.88,129.23,128.78,127.93,127.22,127.09,119.56,119.21,42.01,31.30.
1a2yield 87.3%. IR (KBr 压片):ν(cm-1) 3 054,2 965,1 617,1 488,1 428,1 386,1 285,1 222,1 177,1 072,1 026,975,826,749,624,527;1H NMR (CDCl3,300 MHz):δ(ppm) 11.74 (s,2 H),8.54 (s,2 H),8.06~7.31 (m,13 H),7.10~7.01 (m,3 H),6.53 (d,J= 8.4,2 H),1.55 (s,6 H).
1b2yield.64.5%. IR (KBr 压片):ν(cm-1) 3 055,2 968,1 610,1 505,1 456,1 388,1 284,1 219,1 167,1 073,964,879,816,749,698,632,522;1H NMR (CDCl3,300 MHz):δ(ppm) 12.78 (s,2 H),8.57 (s,2 H),8.00~6.88 (m,16 H),1.58 (s,6 H).
1c2yield.73.9%. IR (KBr 压片):ν(cm-1) 3 054,2 965,1 612,1 581,1 504,1 461,1 431,1 282,1 200,1 146,1 113,1 073,1 030,818,777,747,697,634;1H NMR (CDCl3,300 MHz):δ(ppm) 12.61 (s,2 H),8.56 (s,2 H),7.88 (s,4 H),7.50~7.40 (m,12 H),7.07~6.95 (m,10 H),1.63 (s,6 H).
1d2yield. 64.8%. IR (KBr 压片):ν(cm-1) 3 026,2 966,1 611,1 504,1 457,1 387,1 319,1 281,1 200,1 146,1 114,1 073,1 007,966,841,573;1H NMR (CDCl3,300 MHz):δ(ppm) 12.73 (s,2 H),8.57 (s,2 H),7.60~6.99 (m,34 H),1.57 (s,6 H).
1a3yield.68.0%. IR (KBr 压片):ν(cm-1) 2 930,2 858,1 634,1 587,1 489,1 384,1 283,1 232,1 183,1 046,1 041,939,826,788,632;1H NMR (CDCl3,300 MHz):δ(ppm) 13.15 (s,2 H),8.22 (s, 2 H),7.02 (m, 4 H),6.75 (d,J= 8.4 Hz,2 H),3.30~3.27 (m,2 H),1.85~1.62 (m,8 H),1.54 (s,6 H);13C NMR (CDCl3,300 MHz):δ(ppm) 164.91,159.00,140.76,131.28,129.07,118.00,116.57,72.81,41.54,33.37,30.98,24.27.
1b3yield. 67.6%. IR (KBr 压片):ν(cm-1) 2 933,2 859,1 628,1 571,1 460,1 388,1 283,1 240,1 168,1 133,1 041,878,794,745,699;1H NMR (CDCl3,300 MHz):δ(ppm) 14.23 (s,2 H),8.20 (s,2 H),7.32 (d,J= 10.8 Hz,2 H),6.99 (d,J= 17.4 Hz,2 H),3.35~3.30 (m,2 H),1.88~1.63 (m,8 H),1.54 (s,6 H);13C NMR (CDCl3,300 MHz):δ(ppm) 164.52,156.69,141.07,134.30,128.89,128.64,118.47,111.02,72.12,41.64,33.20,30.74,24.09.
1c3yield. 75.9%. IR (KBr 压片):ν(cm-1) 2 931,2 859,1 628,1 467,1 435,1 287,1 209,1 113,1 031,971,881,778,697,634;1H NMR (CDCl3,300 MHz):δ(ppm) 13.76 (s,2 H),8.27 (s,2 H),7.50~7.32 (m,9 H),7.20~7.16 (m,5 H),3.27~3.25 (m,2 H),1.71~1.59 (m,8 H),1.54 (s,6 H);13C NMR (CDCl3,300 MHz):δ(ppm) 165.17,156.44,140.54,138.07,132.11,129.52,129.41,128.30,128.21,127.13,118.26,72.64,41.62,33.40,30.99,24.22.
1d3yield. 64.3%. IR (KBr 压片):ν(cm-1) 2 930,2 858,1 627,1 598,1 459,1 388,1 289,1 208,1 145,1 113,1 008,841,758,697,501;1H NMR (CDCl3,300 MHz):δ(ppm) 13.85 (s,2 H),8.19 (s,2 H),7.73~7.37 (m,18 H),7.21 ~7.03 (m,4 H),3.51~3.45 (m,2 H),1.80~ 1.71 (m,8 H),1.56 (s,6 H);13C NMR (CDCl3,300 MHz):δ(ppm) 164.93,156.28,141.14,140.63,140.00,139.70,137.40,137.09,130.22,129.94,129.80,129.17,128.95,128.84,127.21,119.18,72.72,41.69,40.37,33.42,30.96,29.78,24.13.
1.2.2聚Salen-Zn(II)(2a1~2d3)配合物的合成
氮气保护下,将0.1 mmol (1 eq)聚Salen配体1 (1a1~ 1d3)加入Schlenk管中,溶于3 mL二氯甲烷,再加入22.1 mg (0.11 mmol,1.1 eq)乙酸锌的无水乙醇(1 mL)溶液,28 μL (0.2 mmol,2 eq)三乙胺,40oC回流24 h,冷却至室温,向反应液中加入2 mL无水乙醇,有沉淀析出,离心分离(或过滤),依次用无水乙醇、乙醚洗涤。干燥、称重。得到目标产物。
2a1yield 92.8%. IR (KBr压片):ν(cm-1) 2 965,1 615,1 582,1 488,1 417,1 386,1 311,1 291,1 173,1 047,977,886,829,745,540.
2b1yield 89.0%. IR (KBr压片):ν(cm-1) 2 965,1 617,1 581,1 502,1 456,1 386,1 315,1 248,1 211,1 159,1 129,1 044,972,836,801,751,634,543.
2c1yield 83.7%. IR (KBr压片):ν(cm-1) 2 964,1 613,1 581,1 530,1 456,1 385,1 325,1 282,1 201,1 103,1 030,974,882,791,754,699,572.
2d1yield 82.1%. IR (KBr压片):ν(cm-1) 2 963,1 613,1 581,1 532,1 485,1 452,1 387,1 286,1 199,1 103,1 007,973,881,840,762,696,576.
2a2yield 80.2%. IR (KBr压片):ν(cm-1) 2 965,1 615,1 487,1 426,1 386,1 285,1 229,1 175,1 072,1 022,976,830,808,750,623,525.
2b2yield 79.9%. IR (KBr压片):ν(cm-1) 2 966,1 608,1 504,1 452,1 387,1 287,1 219,1 163,1 072,973,878,815,748,697,668,629,527.
2c2yield 69.5%. IR (KBr压片):ν(cm-1) 2 965,1 611,1 583,1 504,1 458,1 431,1 282,1 200,1 146(1 146),1 113,1 073,1 030,818,778,747,697,634,529.
2d2yield 66.5%. IR (KBr压片):ν(cm-1) 2 965,1 609,1 584,1 535,1 505,1 455,1 389,1 322,1 282,1 198,1 146,1 112,1 073,1 007,841,819,731,576.
2a3yield 81.8%. IR (KBr压片):ν(cm-1) 2 932,2 860,1 634,1 533,1 477,1 388,1 303,1 234,1 177,1 086,1 025,940,833,805,668,614.
2b3yield 85.8%. IR (KBr压片):ν(cm-1) 2 933,2 860,1 616,1 509,1 449,1 389,1 313,1 236,1 164,1 129,1 090,880,807,758,632,501.
2c3yield 88.9%. IR (KBr压片):ν(cm-1) 2 929,2 857,1 611,1 537,1 455,1 433,1 322,1 280,1 234,1 152,1 105,1 030,973,810,779,754,697,556.
2d3yield 84.6%. IR (KBr压片):ν(cm-1) 2 929,1 609,1 537,1 450,1 386,1 283,1 235,1 151,1 105,1 008,842,761,732,697,502.
2 结果与讨论
2.1 紫外-可见吸收光谱分析
图3是聚Salen配体及其锌(II)配合物的二氯甲烷溶液(约1×10-5mol/L)的紫外-可见吸收光谱。游离配体在200~305 nm内的吸收带归属为配体中苯环的的π→π*跃迁,在配合物中没有发生明显改变。位于310~371 nm处的吸收带是配体中C=N双键的π→π*和n→π*跃迁的结果,在形成配合物后,亚胺基C=N的特征吸收带发生红移,说明氮原子参与了配位,而配合物的形成更有利于从苯环到亚胺基的电荷转移跃迁[9,10,11]。该配合物的主要能量吸收来源于配体的特征吸收,总的来说,配体的单线态变化主要源于π→π*跃迁所产生的吸收。
配体与金属配位后使亚胺基C=N的特征吸收带发生红移,是由于金属离子的引入使中心离子的电子云密度变大,配合物中共轭π电子的离域化程度增加,影响相应前线分子轨道的能态,跃迁的轨道能级差减小,跃迁几率增大,导致电子吸收带红移。
2.2 荧光发射光谱及荧光量子效率的测定
(1)液体荧光光谱分析
图4给出了聚Salen配体及相应的聚Salen-Zn(II)配合物的二氯甲烷溶液(约1×10-5mol/L)的荧光发射光谱。同一二胺体系化合物的荧光光谱形状基本一致,不同的化合物发射峰的相对强度不同。
由图可知,聚Salen配体的荧光发射光谱在430 nm左右有一个主发射峰,随双醛骨架上R1修饰基团的改变,峰的位置基本不变;在550~650nm的长波长处有一个较弱的发射峰,此发射峰随双醛骨架上R1基团共轭度的增加发生红移,可能是因为共轭度增大,离域π电子较容易激发,荧光更容易产生。

图3 聚Salen (左)和聚Salen-Zn(II) (右)的紫外-可见吸收光谱Fig 3 The UV-Vis absorption spectra of the Poly-salen (left) and Poly-salen-Zn(II) (right)
聚Salen配体与金属锌(II)形成配合物后,荧光发光强度相对增加,且长波长处发射峰的位置发生蓝移,可能是由于配体与金属配位后,分子的刚性增加,减少了激发态电子和分子振动之间相互作用引起的非辐射能量损失,因而有利于荧光的增强;另外,分子刚性的增加也增大了π电子的离域,也有利于增强分子的荧光强度。在长波长处的发射峰也随双醛骨架上R1基团共轭度的增加发生红移。
(2)固体荧光光谱分析
图5分别是2d1,2d2,2d3在不同激发波长下的固体荧光光谱。
由图可知,以370nm激发不同的锌(II)配合物时,荧光发射峰均出现波动;同一物质分别以340 nm,350 nm,360 nm激发时,荧光发光强度和发光波长基本一致,发射峰几乎重叠。该体系固体荧光发光强度受激发波长的影响较小;2d1,2d2,2d3最强发射峰处的波长分别为:593 nm,601 nm,564 nm,对应于配体内的(π*→π)电子跃迁。
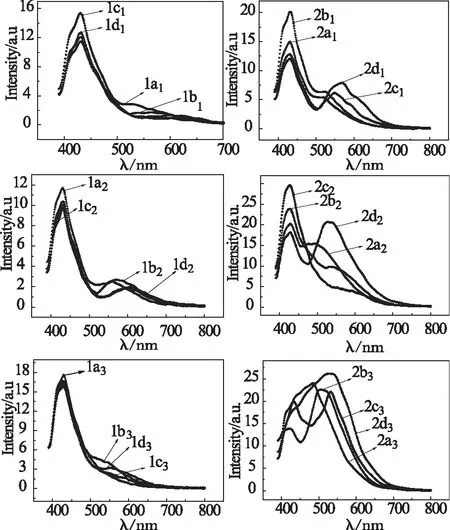
图4 聚Salen(左)及聚Salen-Zn(II)(右)的荧光发射光谱Fig 4 The PL spectra of Poly-salen (left) and Poly-salen-Zn(II) (right)

图5 2d1,2d2,2d3的荧光发射光谱Fig 5 The PL spectra of 2d1,2d2,2d3
1,2-反式环己基、邻苯、联萘系列的共轭度依次增大,上述分析结果表明,聚Salen-Zn(II)配合物固体粉末的荧光光谱随着共轭体系的增大,荧光发射峰发生红移,可能是因为共轭体系增大,π电子的离域性变强,减小了分子激发态和基态的能级差,更有利于荧光的产生。但是,由于粉末的颗粒大小,覆盖模具的均匀度等因素都可能影响荧光发光强度,所以该荧光光谱不能作为评价荧光发光强度大小的标准。

图6 2d1,2d2,2d3的溶液(左)和固体(右)荧光发射光谱Fig 6 The PL spectra of 2d1,2d2,2d3 in liquid (left)and solid (right)
测试结果表明,以360 nm波长激发时,金属锌(II)配合物2d1,2d2,2d3的固体荧光发射峰相对于溶液的发射峰发生了红移,如图6所示;且固体荧光发射峰表现出较好的单一发射特性,发射波长覆盖500~700 nm范围内,一般比液体荧光发光强,可能是荧光分子在固体表面被基质刚性化的缘故。物质的刚性化有利于荧光强度的增加。
(3)荧光量子效率的计算
以硫酸奎宁溶于0.05 mol/L的H2SO4中配成1 μg/mL的硫酸奎宁标准溶液,在激发波长为380 nm的情况下测量物质的荧光量子效率[12~14]。
量子效率计算结果列于表1:

表1 聚-salen(1a1-1d3)和聚-salen-Zn(II) (2a1-2d3)的量子效率(Φf/%)Table 1 Fluorescence quantum efficiency of the Poly-salen and Poly-salen-Zn(II)
计算结果表明,聚Salen配体与Zn(II)配位后,荧光量子效率增加。可能是由于金属离子的引入增加了物质的刚性,同时扩大了共轭度,大的共轭π键结构和刚性的平面结构是影响物质发光性能的重要因素,有利于荧光量子效率的增加;而溴原子的引入不利于荧光的增强,因为溴原子能够增强电子的自旋轨道耦合作用,使电子经隙间窜越从S1态到达T1态的的速率常数和量子产率增加,从而导致低荧光量子效率。这称为重原子效应[15,16]。
2.3 热稳定性
测量了聚Salen-Zn(II)配合物2d1,2d2,2d3的热分解温度,图7是化合物的TG曲线。
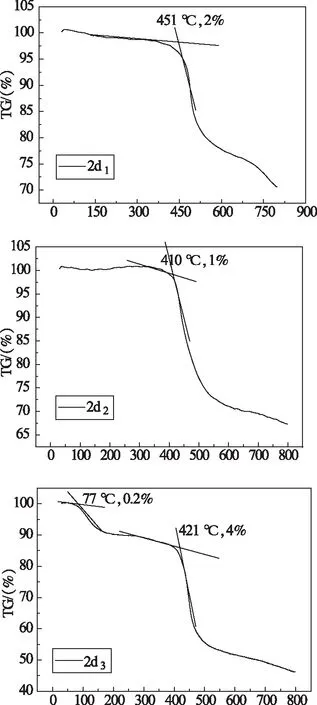
图7 2d1~2d3的TG曲线Fig 7 The TG curve of 2d1~2d3
由图7可知,化合物2d1,2d2的外延起始分解温度分别为:451 ℃,410 ℃,此时分别失重2%,1%;2d3在77 ℃失重0.2%,可能是样品中含有结晶水,在加热过程中失去,其外延起始分解温度为421 ℃,此时失重4%。
上述测试结果表明,聚Salen-Zn(II)配合物具有较高的热分解温度,热稳定性好,这主要归因于配合物具有大的共轭体系。在真空蒸镀过程中,能够承受高温,满足有机电致发光材料对热稳定性的要求,有利于器件的优化。
2.4 电化学性质
用循环伏安法对制得的材料进行了测试,如图8所示。

图8 Poly-salen-Zn(II)的循环伏安曲线Fig 8 Cyclic voltammograma of Poly-salen-Zn(II)
循环伏安法(cyclic voltammetry)测量的有机材料的EHOMO和ELUMO值是相对于参考电极的电位值,使用不同的参比电极时,计算公式要进行适当改变[17,18]。
采用一个三电极体系,参比电极为Ag/AgCl电极,工作电极为玻碳电极,对电极为铂电极;以四丁基高氯酸铵(浓度为0.05 mol/L)做支持电解质,二茂铁做内参,二氯甲烷为溶剂,扫描速度为100 mV/s,测定了各种锌配合物(2a1~2d3)的循环伏安特性,图8是聚Salen-Zn(II)配合物的循环伏安曲线。结合相应的紫外-可见吸收光谱[19],可以计算出各化合物的最高占有轨道能量(EHOMO),最低空轨道能量(ELUMO)以及能级带隙(Eg)值。计算公式如下:
EHOMO=(-EOX-4.30)eV
Eg=1240/λabs
ELUMO=Eg-|EHOMO|
表2给出了聚Salen-Zn(II)配合物的电化学数据。

表2 化合物2a1~2d3的电化学数据Table 2 The electrochemical data of 2a1~2d3
3 结 论
(1)成功地合成了一系列新型聚Salen配体和相应的聚Salen-Zn(II)配合物,并对其发光性能进行研究。结果表明,聚Salen-Zn(II)配合物具有良好的热稳定性,其热分解温度高于400 ℃,满足有机电致发光材料的性能指标;
(2)增大π电子的共轭度,增强物质的刚性平面结构都有利于荧光量子效率的增加;
(3)由于重原子效应,溴原子的引入不利于荧光量子效率的提高;
(4)联萘二胺体系具有较大的π电子共轭体系,溶解性较差,影响核磁数据表征;此外,可能由于分子的空间体积增大,受空间阻力的影响,使配合物的荧光效率降低。
[1] Huang C,Li F,Huang Y. Ultrathin films for optics and electronics [M]. Beijing University Press,2001.
[2] Tang C W,VanSlyke S A. Organic electro luminescent diodes [J]. Appl. Phys. Lett.1987,51(12):913~915.
[3] Hamada Y,Sano T,Fujita M,Fujii T,Nishio Y,Shibata K. Organic electro- luminescent devices with 8-hydroxy -quinoline derivative-metal complexes as an emitter [J]. Jpn. J. Appl. Phys. 1993,32(4A): 514~515.
[4] Hwang K Y,Kim H,Lee Y S,Lee M H,Do Y. Synthesis and properties of salen-aluminum complexes as a novel class of color-tunable luminophores [J]. Chem. Eur.2009,15(26): 6 478~6 487.
[5] Vashchenko A A,Lepnev L S,Vitukhnovs -kii A G. Photo and electroluminescent properties of Zinc(II) complexes with tetradentate schiff bases derivatives of salicylic aldehyde [J]. Opt. Spectrosc.2010,108(3): 463~465
[6] Chang K H,Huang C C,Liu Y H,Hu Y H,Chou P T,Lin Y C. Synthesis of photoluminescent Zn(II) schiff base complexes and its derivative containing Pd(II) moiety [J]. Dalton. Trans.2004,1731~1738.
[7] Wang P F,Xie Z Y,Hong Z R,Tang J X,Wang O,Lee C S,Wong N,Lee S. Synthesis,photoluminescence and electroluminescence of new 1H-pyrazolo [3,4-b] quinoxaline derivatives [J]. Mater. Chem. 2003,13(8): 1894-1899.
[8] Gu L Y,Tu H,Yao X. Synthesis and electroluminescent properties of novel metal- organic coordination Polymers base on bisphenol A [J]. Chin. J. Lumin.,2011,32(2): 127-133.
[9] Andreas W,Christian F,Manuela C,Martin D H;Ulrich S S. Self- assembly of p-conjugated bis (terpyridine) ligands with Zinc(II) ions: new metallosupra- molecular materials for optoelectronic applications [J]. J. Polym. Sci. Part A: Polym. Chem. 2009,47(16):4 083~4 098.
[10] Hou L X,Jia H S,Hao Y Y,Wang H,Chen L Q. Characterization and photoluminescence properties of an azomethin-Zinc complex [J]. Spectrosc. Spect. Anal.,2008,28(4):766~769.
[11] Chen L,Xu H,Wang Y. Systhesis and characterization of a new Schiff base boron complex [J]. Chin. J. Lumin.,2008,29(1): 61~66.
[12] Suzanna F F,Dominique L. Are fluore- scence quantum yields so tricky to measure. A demonstration using familiar stationery products [J]. J. Chem. Ed. 1999,76(9): 1 260~1 264.
[13] Demas J N,Crosby G A. Measurement of photoluminescence quantum yields. A review [J]. Review. J. Phys. Chem. 1971,75(8): 991~1 024.
[14] Ci Y,Jia X. Determination of relative fluorescence quantum yields using a simplified method [J]. Analysis Chemistry. 1986,14(6): 616~617.
[15] Isadore B,Berlman. Empirical study of heavyatom collisional quenching of the fluorescence state of aromatic compounds in solution [J]. J. Phys. Chem. 1973,77(4): 562~567.
[16] Becker R S. Theory and interpretation of fluorescence and phosphorescence [M]. London . Wiley. 1969,139.
[17] Bard A J,Memming R,Miller B. Ter -minology in semiconductor electro -chemistry and photoelectro-chemical energy conversion [J]. Pure & Appl. Chem. 1991,63(4): 569-596.
[18] Trasatti S. The absolute electrode poten -tial: An explanatory note [J]. Pure & Appl. hem. 1986,58(7): 955~966.
[19] Kim K,Park S,Hahm S G. Nonvolatile unipolar and bipolar bistable memory characteristics of a high temperature polyimide bearing dipheny laminobenzy -lidenylimine moieties [J]. J. Phys. Chem. B 2009,113(27): 9 143~9 150.
Design,SynthesisandPerformanceResearchofaNovelPoly-salen-zinc(II)ComplexesBasedonBridgedBis-salicylaldehydeDerivatives
Nie Shoujie Yu Min*Huang Xiang Yao Xiaoquan
(College of Material Science and Technology, Nanjing University of Aeronautics and Astronautics, Jiangsu Nanjing 210016; *School of Environmental Sciences, Nanjing Xiaozhuang University,Jiangsu Nanjing 211171)
A series of poly-salen ligands derived from aliphatic or aromatic diamine with bridged disalicyclaldehyde and corresponding zinc(II)-chelate complexes were designed and synthesized successfully. The chemical structures of the complexes were characterized by1H NMR,13C NMR spectra and IR spectra; and the luminescence properties of the complexes were characterized by UV-Vis absorption spectra, fluorescence spectra. The fluorescence quantum efficiency of the complexes was 0.71%~1.65%. The thermogravitometric analysis showed that the decomposition temperature of the zinc(II) complexes were around 400 ℃. Cyclic voltammetry revealed that Energy band gap was 2.32~2.95 eV. Kinds of substitutes were introduced into the ligands to change emissive wavelengths, fluorescent quantum efficiency and thermally stable of the resulted complexes.
bridged bisalicylaldehyde poly-salen ligand metal-coordination fluorescence quantum efficiency
10.16597/j.cnki.issn.1002-154x.2017.03.004
2017-02-18
江苏高校优势学科建设工程,国家自然科学基金面上项目(21472092),江苏省高校自然科学研究面上项目(15KJD150003)。
聂守杰(1991~),男,硕士,主要从事有机合成方法学研究。通讯作者:姚小泉(1973~),男,教授,从事绿色合成方法学研究,Email:yaoxq@nuaa.edu.cn
