正交实验优化雄烯二酮-3-乙氧基醚的合成工艺研究
2018-01-12杨春梅冯书晓
杨春梅 冯书晓
(河南科技大学医院,河南 洛阳 471023;*河南科技大学化工与制药学院,河南 洛阳 471023)
雄烯二酮(Androstendione, AD,1)是雄甾-4-烯-3,17-二酮的简称,是一种由肾上腺和性腺分泌的19碳的甾体激素,作为生物化学合成雄性激素睾酮和雌性激素雌酮雌二醇的中间产物[1]。近些年来,随着微生物限制性切除甾醇碳17侧链技术的成功[2~5],使雄烯二酮成为继薯蓣皂素的又一甾体药物合成原料,成为甾体制药企业开发研究的重点[6, 7]。由于雄烯二酮的碳3位和碳17位均含有酮羰基结构,而17位酮羰基常常用于侧链修饰合成甾体激素药物,因此往往需要有选择性的保护3位烯酮结构。
烯醇醚法在甾体药物合成中具有很重要的应用[8,9],这是由于该反应可以专属地与甾体A环C3-烯酮位点反应[10],而其它位点如C17-酮基不参与反应,具有条件温和,收率高等优点。烯醇醚保护法具有和缩酮保护法相似的功能,即碱性条件稳定,酸性条件脱保护,但烯醇醚保护法只需一步反应即可实现C3酮羰基的选择性保护(见图1),相对于缩酮法具有操作简便、反应条件温和、收率高等优点。

图1 雄烯二酮-3-乙氧基醚的合成Fig 1 Synthesis of 3-ethoxy-androstendione
1 实验部分
1.1 主要仪器与试剂
Bruker Avance 400 MHz核磁共振仪(TMS为内标,德国Bruker公司);Q-Tof MicroTM高分辨质谱仪(美国waters公司);XT-4型显微熔点仪(美国Perkin-Elmer 公司)。
雄烯二酮(湖北康宝泰精细化工公司);原甲酸三乙酯(TEOF)(阿拉丁试剂);对甲苯磺酸(TsOH·H2O)(国药集团化学试剂);四氢呋喃(THF)(天津市科密欧化学试剂);甲苯、丙酮、氯仿及其它试剂均为分析纯。
1.2 绝对乙醇的制备
在装有球形冷凝管(顶端附氯化钙干燥管)的250 mL圆底烧瓶中,加入市售无水乙醇180 mL,金属钠2 g切丝加入,加入磁子,置于磁力加热电热套上加热回流30 min,然后加入邻苯二甲酸二乙酯6 mL,继续回流10 min,将回流装置改为蒸馏装置,尾接管接干燥管,用干燥圆底烧瓶做接受器,蒸馏至几乎无液滴流出为止,用橡胶塞密封,置于干燥器中贮存。检验乙醇是否有水分,可取一支干燥试管,加入绝对乙醇1 mL,立即加入无水硫酸铜粉末少许,如乙醇中含有水分,则无水硫酸铜变为蓝色的五水硫酸铜。
1.3 实验方法
1.3.13-乙氧基-雄甾-3,5-二烯-17-酮的制备方法
称取雄烯二酮(2.00 g,6.98 mmol,1)溶于20 mL新干燥的THF溶液中,并不断搅拌,加入新制的绝对乙醇(A eq.),原甲酸三乙酯(B eq.),对甲苯磺酸(C% eq.),N2保护,反应液在D℃加热E h,TLC跟踪反应(Rf=0.78,PE∶EtOAc=3∶1);用5 mL 10%NaHCO3溶液稀释,乙醚(3×15 mL)提取3次,橙色层用盐水洗涤(10 mL),有机层用无水Na2SO4干燥,减压除去溶剂,用含吡啶/乙醇重结晶,得3-乙氧基-雄甾-3,5-二烯-17-酮(3-Ethoxyandrosta-3,5-dien-17-one,2)白色粉末状固体,干燥,称重,计算产率。
1.3.2因素水平表的选择
本实验选择正交实验法对影响雄烯二酮-3-烯醇醚收率的实验因素进行优选,选取L16(45)正交表进行实验。因素水平表见表1。

表1 正交实验因素水平表Table 1 Orthogonal factor level table
1.3.3试验安排表与结果
用L16(45)正交表安排试验,在此正交试验中原料雄烯二酮为6.983mmol, 2.00g,以新蒸四氢呋喃(THF)为溶剂。实验结果见表2。
2 结果与讨论
2.1 烯醇醚保护法的反应机理
烯醇醚保护法一般以原酸酯类或二甲氧基丙烷为反应试剂,以对甲苯磺酸或吡啶酸盐为催化剂在相应醇类试剂中,在比较温和的条件下进行。烯醇醚在非酸性溶剂中稳定,对酸和光照很敏感。利用此特性,烯醇醚的去保护在酸水溶液中或经光照即可完成。该反应的机理如图2所示。
2.2 产品结构解析
产品经柱层析分离,得到3-乙氧基-雄甾-3,5-二烯-17-酮(3-Ethoxyandrosta-3,5-dien-17- one,2)白色粉末状固体。Mp.144-146℃。Rf=0.80(petroleum ether (30-60℃)/EtOAc = 3/2)。1H NMR (400 MHz, CDCl3) δ5.25 (s, 1H, H-6), 5.14(s,1H, H-4), 3.81-3.78(t, 2H,OCH2CH3),2.52-2.45(m, 1H, H-9), 2.32-1.10 (m,16H, skeleton protons), 1.32 (t, 3H, OCH2CH3), 1.02 (s, 3H, H-19), 0.93 (s, 3H, H-18)。13C NMR (101 MHz, CDCl3) δ 220.98, 154.60, 141.16, 117.07, 98.87, 62.17, 51.94, 48.42, 47.65, 35.84, 35.26, 33.74, 31.50, 31.45, 30.71, 25.45, 21.82, 20.47, 18.97, 14.65, 13.66。ESI-MS, m/z: 315.3[M + H]+,337.3[M + Na]+。HR-MS, m/z: 315.2315[M+H]+(cal. 315.2319)。
2.3 正交实验结果分析
极差直观分析表明:五个因素对产物收率的影响程度分别为:D>A>E>C>B,即影响收率最突出的是反应温度,其次是乙醇的摩尔当量。方差分析结果也证实(见表3)反应温度具有显著性影响。由此确定的最佳反应条件为D2A3E3C2B4:即乙醇量(6eq)2.50 mL,原甲酸三乙酯量(3.0eq)3.50 mL,对甲苯磺酸(1.0%eq)0.012 g,反应温度45 ℃,反应时间4 h。此条件下,产品AD-3-烯醇醚的最高产率可达95.48%。
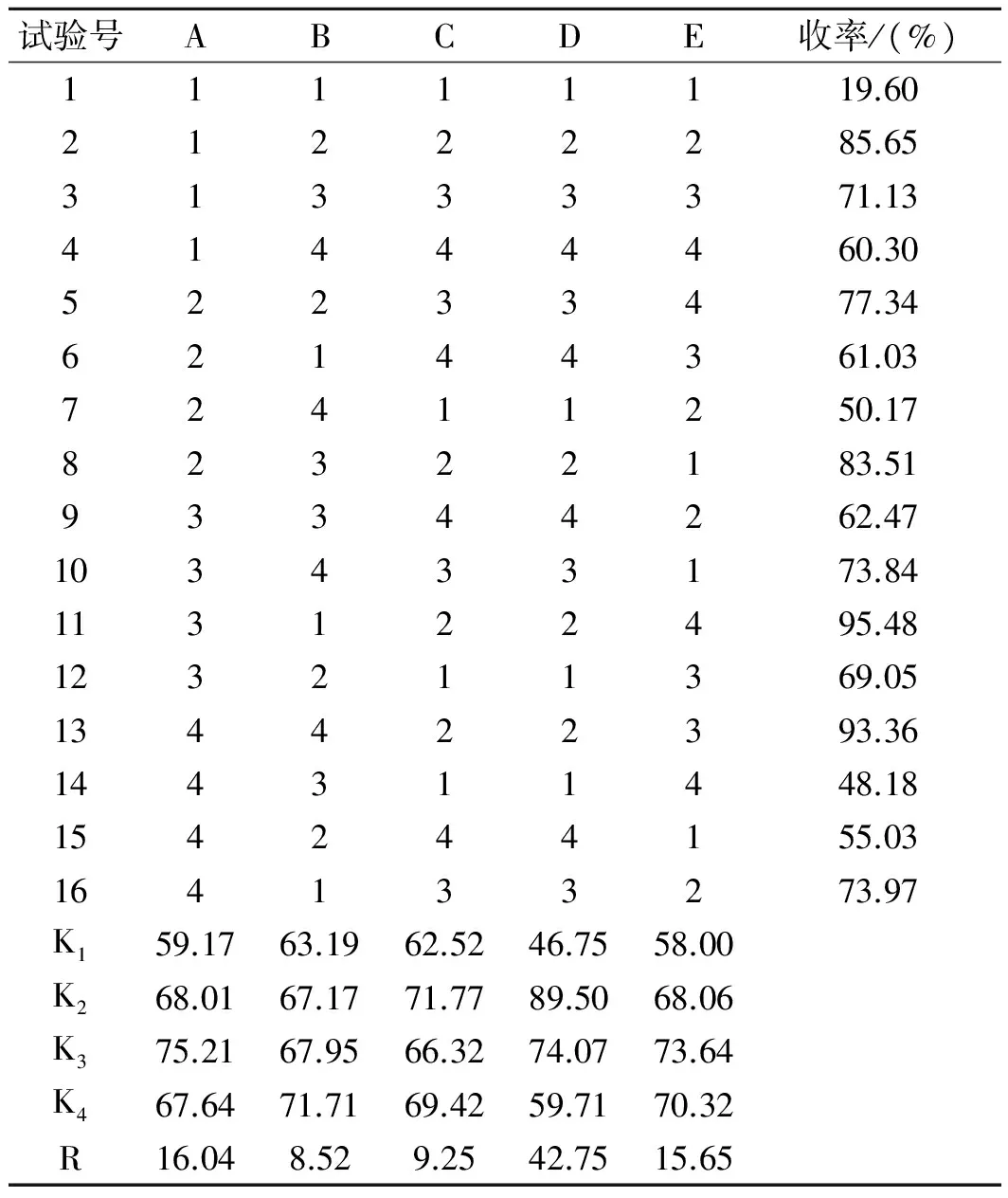
表2 L16(45)正交实验表Table 2 L16(45) orthogonal design and results
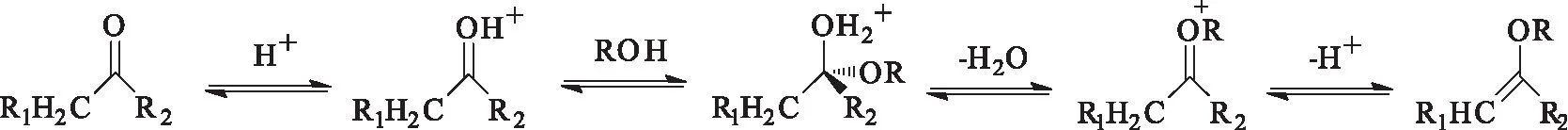
图2 烯醇醚保护法的反应机理Fig 2 Mechanism of the protection method of enol ether
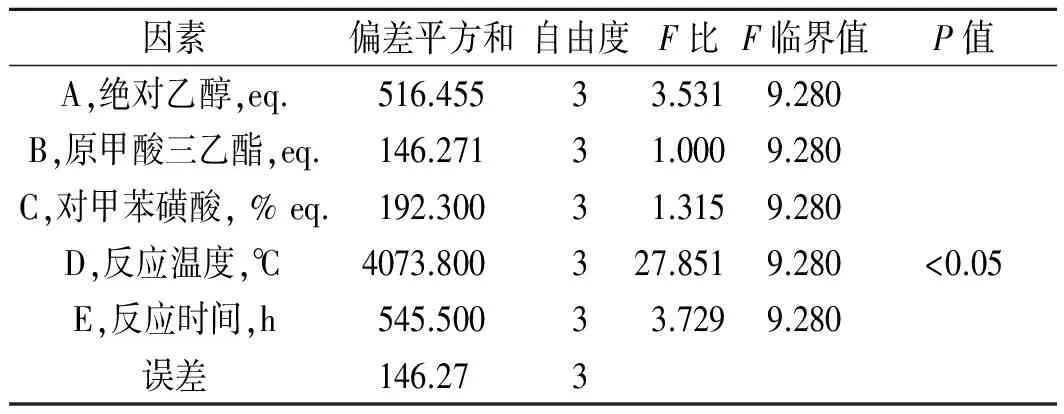
表3 方差分析表Table 3 Variance analysis of orthogonal experiment
2.4 验证试验
针对优化出的最佳反应组合,为考查它的可靠性,对最佳工艺条件即各量放大一定的倍数(本实验放大10倍)对其进行验证,进行三次重复性实验(见表4)。验证结果与正交结果相近,说明该工艺稳定、可行。
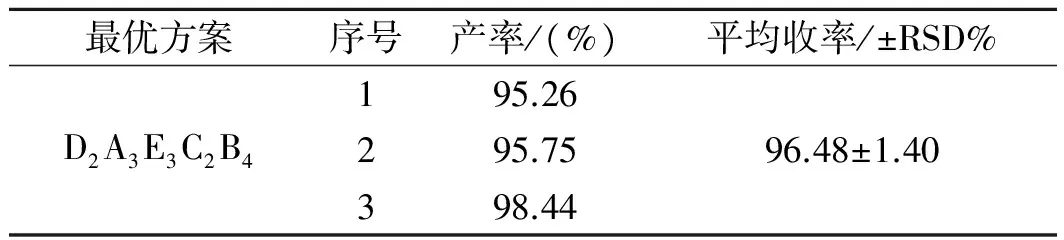
表4 验证试验Table 4 The verification test
3 结 论
本研究采用正交实验的方法对雄烯二酮-2-乙氧基醚的合成工艺进行了优化,为甾体原料的开发利用奠定了基础,确定最佳合成条件为:乙醇量(6eq)2.50 mL,原甲酸三乙酯量(3.0eq)3.50 mL,对甲苯磺酸(1.0%eq)0.012 g,反应温度45 ℃,反应时间4 h。该工艺稳定、可靠,平均收率达到96.48%,适合工业化应用。
[1] Callow N H, Callow R K. The isolation of androsterone and transdehydroandrosterone from the urine of normal women.[J]. Biochemical Journal, 1938, 32(10):1 759~1 762.
[2] Arima K, Nagasawa M, Bae M. Microbial transformation of Sterols.Part I. Decom- position of cholesterol by Microorganisms[J]. Agricultural and Biological Chemistry, 1969, 33(11): 1 636~1 643.
[3] Nagasawa M, Bae M, Tamura G, et al. Microbial Transformation of Sterols. Part II. Cleavage of Sterol Side Chains by Microorganisms [J]. Agricultural and Biological Chemistry, 1969, 33(11): 1 644~1 650.
[4] Nagasawa M; Watanabe N; Hashiba H. Microbial transformation of Sterols. Part III. Substrate specificity for cleaving steroid side chains by Arthrobacter simplex [J]. Agricultural and Biological Chemistry, 1970, 34(5): 798~800.
[5] Femanders P; Cruz A; Pinheiro H M. Microbial conversion of steroid compounds: recent developments [J]. Enzyme Microb Technol, 2003, 32(6): 688~705.
[6] Redpath J, Zeelen F J. Stereoselective synthesis of steroid side-chains [J]. Chemical Society Reviews, 1983, 12(1): 75~98.
[7] Hogg J A. Steroids, the steroid community, and Upjohn in perspective: a profile of innovation [J]. Steroids. 1992, 57(12): 593~616.
[8] 王红霞, 叶景泉, 姜中兴. 螺内酯的合成[J]. 中国医药工业杂志, 2005, 36(1): 1~3.
[9] Gioiello A, Sardella R, Rosatelli E., et al. Novel stereoselective synthesis and chromatographic evaluation of E-guggulsterone[J]. Steroids, 2012, 77(3): 250~254.
[10] Nussbaum A L, Yuan E, Dincer D., et al. Enol Ethers of Steroidal Δ4-3-Ketones[J]. The Journal of Organic Chemistry, 1961, 26(10): 3 925~3 928.
