非透析慢性肾脏病患者左心室结构和功能的改变及其影响因素分析
2018-01-10陈财铭陈源陈怡张小红万建新
陈财铭 陈源 陈怡 张小红 万建新
·论著·
非透析慢性肾脏病患者左心室结构和功能的改变及其影响因素分析
陈财铭 陈源 陈怡 张小红 万建新
目的分析非透析慢性肾脏病(non-dialysis chronic kidney disease,ND-CKD)患者左心室结构和功能的改变及其影响因素。方法回顾性收集福建医科大学附属第一医院2013年1月至2014年7月住院的ND-CKD患者的临床资料和心脏彩色多普勒超声检查结果,比较不同慢性肾脏病(chronic kidney disease,CKD)分期患者的左心室结构和功能改变,并分析左心室结构和功能改变与临床及生化指标之间的关系。结果共337例ND-CKD患者纳入分析,其中CKD 1期71例,2期37例,3期28例,4期36例,5期165例。随着CKD 进展,体质量指数(body mass index,BMI)、血钙逐步下降(P<0.05),血尿素氮(BUN)、血肌酐(SCr)、血磷、全段甲状旁腺素(intact parathyroid hormone,iPTH)、胱抑素C逐步上升(P<0.05);25-羟维生素D 逐渐下降(P<0.05),N-端骨钙素、β-胶原特殊序列(β-C-terminal telopeptide of typeⅠcollagen,β-CTX)、总Ⅰ型前胶原氨基末端前肽逐渐上升(P<0.05);左心室舒张末期内径(left ventricular end diastolic dimension,LVDd)、左心室收缩末期内径、左心室质量指数(left ventricular mass index,LVMI)数值逐渐增大(P<0.05),而左室相对室壁厚度(relative wall thickness,RWT)各期CKD之间差异无统计学意义。每搏输出量(stroke volume,SV)随着CKD 进展而逐渐增大(P<0.05),而心搏出量、左心室射血分数(left ventricular ejection fraction,LVEF)、短轴缩短率、二尖瓣口舒张早期血流速度/舒张晚期血流速度(transmitral diastolic early peak inflow velocity/transmitral diastolic late peak inflow velocity,E/A)值各期CKD之间均无明显差异(P>0.05);但E/A随着CKD进展而逐渐下降,且在CKD 2期以后均值均小于1。左室正常构型占各自CKD 1~5期例数的百分比逐渐下降,分别为84.5%、70.3%、64.3%、44.4%、38.2%。多元线性回归分析发现,年龄和血磷是RWT的危险因素,BMI是LVDd的危险因素,血β-CTX是LVMI的危险因素,血胱抑素C是SV的危险因素,iPTH是LVEF的危险因素,年龄、女性、血钙和BUN是E/A的保护因素。结论ND-CKD患者的左心室结构和功能随着CKD 进展而恶化,年龄、肾功能、血磷、血钙、iPTH、BMI、血β-CTX与左心室结构和功能改变相关。
慢性肾脏病;心脏结构;心脏功能
我国慢性肾脏病(chronic kidney disease,CKD)的发病率高达10.8%[1],心血管并发症是CKD患者死亡的主要原因。透析患者心血管病的年病死率近9%,在矫正年龄、性别、种族、糖尿病等因素后,透析患者心血管病的病死率是普通人群的10~30倍[2]。本文通过心脏彩色多普勒超声测量CKD 1~5期患者的心脏结构与功能,并进一步分析其发生改变的相关影响因素。
资料与方法
一、一般资料
收集2013年1月至2014年6月在我院住院且有完整资料的非透析慢性肾脏病(non-dialysis chronic kidney disease,ND-CKD)患者共337例,其中男198例,年龄范围19~91岁,平均年龄(58.6±15.0)岁;女139例,年龄范围18~88岁,平均年龄(60.1±15.8)岁。有高血压病史275例(占81.4%)。CKD的定义和分期参照2012年KDOQI指南,其中估算肾小球滤过率 (estimated glomerular filtration rate,eGFR)采用CKD-EPI公式计算[3]。CKD 1期71例,CKD 2期37例,CKD 3期28例,CKD 4期36例,CKD 5期165例。收集所有患者性别、年龄、身高、体质量及体质量指数(body mass index,BMI)[BMI=体质量/身高2(kg/m2)]。
二、实验室检查
所有患者均于清晨空腹采血用生化检测仪检测血肌酐(SCr)、尿素氮(BUN)、血钙、血磷。Elecsys2010电化学发光全自动免疫分析仪(瑞士罗氏)测量血清全段甲状旁腺素(intact parathyroid hormone,iPTH)。ADVIA2120血细胞分析仪检测血常规。采用西门子公司生产的ADVIA 2400测定外周血胱抑素C,Roche Cobase 601测定外周血25羟维生素D3、N端骨钙素(N-Osteocalcin,NOC)、β-胶原特殊序列(β-C-terminal telopeptide of type Ⅰ collagen,β-CTX)、总Ⅰ型前胶原氨基末端前肽(N-terminal peptide of type Ⅰ procollagen,TP1NP)。血钙在低血清白蛋白(Alb)时进行纠正钙计算后纳入分析,公式为:纠正钙=测钙值+(40-Alb)×0.02。
三、心脏彩色多普勒超声检查
所有患者同期行心脏彩色多普勒超声检查,根据美国超声心动学学会推荐[3],采用M型超声显像仪测量所有数据并纳入指标左心室舒张末期内径(left ventricular end diastolic dimension,LVDd)、左心室收缩末期内径(left ventricular end systolic dimension,LVDs),并计算左室相对室壁厚度(relative wall thickness,RWT)、左心室质量指数(left ventricular mass index,LVMI),应用机内自带软件系统算得左心室射血分数(left ventricular ejection fraction,LVEF)、短轴缩短率(fractional shortening,FS)、每搏输出量(stroke volume,SV)、每分心输出量(cardiac output,CO),同时采用彩色多普勒超声显像仪测量二尖瓣口舒张早期血流速度(PVE)、二尖瓣口舒张晚期血流速度(PVA)。根据公式:体表面积(body surface area,BSA)(m2)=0.0061×身高(cm)+0.0128×体质量(kg)-0.1529;左心室质量指数LMVI(g/m2)=LMV(g)/BSA(m2);左室相对室壁厚度RWT(mm)=(IVST+LVPWT)/LVDd;E/A=PVE/PVA。(室间隔厚度:interventricular septal thickness,IVST;左心室后壁厚度:left ventricular posterior wall thickness,LVPWT)左心室构型可以分为4种:①左室正常型:LVMI>125 g/m2(男)或<120 g/m2(女),RWT<0.45;②向心性重构型:LVMI>125 g/m2(男)或<120 g/m2(女),RWT ≥0.45;③向心性肥厚型:LVMI>125 g/m2(男)或>120 g/m2(女),RWT>0.45;④离心性肥厚型:LVMI>125 g/m2(男)或>20 g/m2(女),RWT<0.45。
四、统计学处理
实验数据采用SPSS 19.0统计软件处理,正态分布资料以均数±标准差表示,计量资料2组间均数比较采用t检验,计数资料采用卡方检验,各组间比较采用方差分析。采用逐步法多元线性回归分析CKD患者心脏结构及功能与各生化指标间的关系,P<0.05为差异有统计学意义。
结 果
一、各期CKD患者一般资料和临床生化指标的比较
随着CKD 的进展,BMI、血钙逐步下降,BUN、SCr、无机磷、iPTH、胱抑素C逐步上升;25羟维生素D 逐步下降,NOC、β-CTX、TP1ND逐步上升,且上述差异均有统计学意义,其中维生素D 正常14例(25-羟维生素D≥30 ng/ml),维生素D不足89例(15 ng/ml≤25-羟维生素D<30 ng/ml),维生素D 缺乏234例(25-羟维生素D<15 ng/ml)[4]。(表1)
二、各期CKD患者心脏结构和功能改变的比较
随着CKD 进展,LVDd、LVDs、LVMI数值逐渐增大,且差异有统计学意义,而RWT差异无统计学意义。E/A值在CKD各组之间无差异(P=0.192),但E/A值随着CKD进展而逐渐下降,且在CKD 2期时均值<1。SV随着CKD 进展而逐渐增大,且组间差异有统计学意义,表现为CKD 5期和CKD 1、2、4期比较有统计学差异,而 CO、LVEF、FS指标在CKD各组间差异均无统计学意义。(表2)
三、各期CKD患者左心室构型
左室正常型随着CKD进展百分比逐渐下降;左室异常型的比例随着CKD 进展逐渐增大,尤其是CKD 5期达到高峰。(表3)
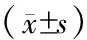
表1 CKD各期患者一般资料和生化指标的比较
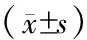
表2 CKD各期患者心脏超声检查结果的比较
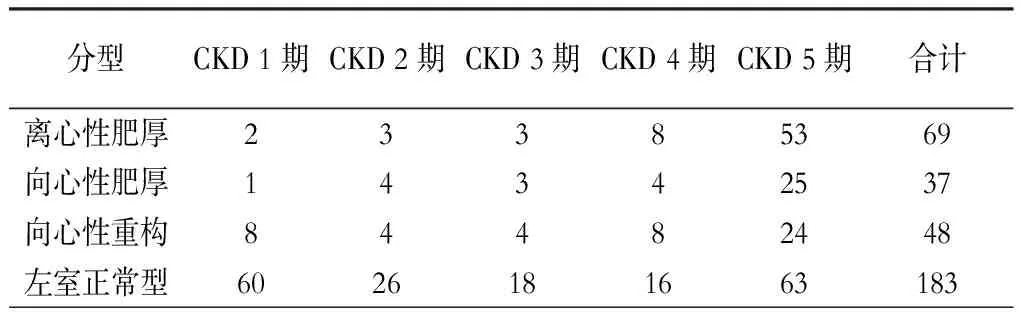
表3 CKD各期患者左心室构型比较(例)
四、左心室结构和功能与临床及生化指标之间的关系
选取代表左心室结构和功能的心脏彩超指标RWT、LVDd、LVMI、SV、LVEF、E/A作为因变量,将所有收集的临床资料和生化指标作为自变量进行多元线性逐步回归分析,结果发现:年龄和血磷是RWT的危险因素;BMI是LVDd的危险因素;血β-CTX是LVMI的危险因素;血胱抑素C是SV的危险因素;iPTH是LVEF的危险因素;年龄、女性、血钙和血BUN是E/A的保护因素。(表4)
讨 论
心血管疾病是终末期肾病患者死亡的首要原因,CKD患者发生心脏结构和功能改变可能的原因包括传统的心血管病高危因素及CKD所特有的高血压、尿蛋白、贫血、水钠潴留及骨-矿物质代谢紊乱等[5]。
心脏彩超结果提示随着CKD进展,LVDd、LVDs、LVMI数值逐渐增大,而RWT各期CKD之间差异无统计学意义。SV随着CKD 进展而逐渐增大,而CO、LVEF、FS、E/A值各期CKD之间均无明显差异;但E/A随着CKD进展而逐渐下降,且在CKD 2期以后均值均小于1。进一步多元线性回归分析发现年龄和血磷是RWT的危险因素;BMI是LVDd的危险因素;血β-CTX是LVMI的危险因素;血胱抑素C是SV的危险因素;iPTH是LVEF的危险因素;年龄、女性、血钙和BUN是E/A的保护因素。以上结果表明,影响CKD患者心脏结构和功能改变是一个综合因素作用的结果。因此,CKD合并心血管疾病的相关影响因素及其心脏彩超表现、临床结局是复杂的。目前的研究发现伴有CKD的心血管疾病患者对保护心血管的治疗效果欠佳[6]。
研究发现,新型的骨代谢指标与心脏结构和功能改变有一定的相关性。Magni等[7]发现低骨钙素是心血管事件的高危因素。Verheyen等[8]在分析一组155例病例中发现P1NP是LVEF的独立预测因子,骨钙素和骨性碱性磷酸酶是心彩超侧壁组织多普勒E峰的独立预测因子,而β-CTX仅与E峰相关,但无预测价值。Al Mheid等[9]在一组554例健康人群中发现,25羟维生素D缺乏和动脉硬度增加和内皮功能紊乱相关。目前研究认为,心肌肥厚伴随着心肌维生素D受体表达增加[10],而维生素D受体活跃对心肌细胞可以有抗肥厚和抗增殖的作用[11],同时维生素D可以下调促进心肌肥厚相关基因的表达[11]。本文显示随着CKD 进展,25羟维生素D 逐渐下降,NOC、β-CTX、TP1NP逐渐上升,且差异都有统计学意义。但进一步行多元线性回归分析时仅发现血β-CTX是LVMI的危险因素,其余指标并未发现相关性,这与CKD患者CVD的病因较为复杂有关,是传统的危险因素和非传统的CKD独有的危险因素相互作用的结果。

表4 左心室结构和功能指标与各生化指标相关性分析
CKD早、中期即存在不同程度的动脉粥样硬化、左室肥厚、瓣膜病变等,晚期患者常伴有充血性心力衰竭和明显的左心室重构[6]。研究发现在eGFR>30 ml/min的病例中约16%~31%存在左心室肥厚,而在肾脏替代治疗前期迅速升至60%~75%,在进入透析初始可升至90%[12]。目前认为,左室肥厚是心律失常和心源性猝死的独立危险因素[13]。有学者对一组123例维持性血液透析患者随访10年发现,左室肥厚是猝死的最强预测因子,其中LVMI每增加1 g,心源性猝死的风险增加2%。左室肥厚可以表现延长QT间期和增加QT离散度而引起猝死[14]。本文显示CKD 1期左室构型异常比例为15.5%,而CKD 5期左室构型异常比例为61.8%,符合大部分研究。有学者发现,向心性肥厚导致最高的心血管病死率(31%)和非致死性心血管事件(11%)。目前认为,冠心病和心肌病比较容易出现离心性肥厚,高血压、瓣膜病变和主动脉硬化更容易出现向心性肥厚,而糖尿病或代谢综合征更易出现向心性重构[15]。Paoletti等[16]在一组445例CKD 2~5期患者中发现左室肥厚患者349例(56.0%),其中离心性肥厚124例,向心性肥厚125例。本文显示,在不同CKD分期内,不同的左室构型异常分型之间的比例不同,而进入CKD 5期后左室构型异常中的离心性肥厚为向心性肥厚的2倍(53例比25例),这与国外报道不同,可能和种族、基础疾病状态和诊治经过、药物影响、入组人群的选择等有关,需要更多病例的研究。
总之,本文发现ND-CKD患者的心脏左心结构和功能改变随着CKD 进展而恶化,和传统的高血压和糖尿病相关的心脏改变相比具有一定的特殊性,影响因素较为复杂,临床实践的关键在于综合监测和管理。
[1] Zhang L, Wang F, Wang L. Prevalence of chronic kidney disease in China: a cross-sectional survey[J]. Lancet, 2012, 379(9818): 815-822.
[2] Jain P, Calvert M, Cockwell P, et al. The need for improved identification and accurate classification of stage 3-5 chronic kidney disease in primary care: retrospective cohort study[J]. PloS One, 2014, 9(8): e100831.
[3] Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate[J]. Ann Intern Med, 2009, 150(9): 604-612.
[5] Di Lullo L, Gorini A, Russo D, et al. Left ventricular hypertrophy in chronic kidney disease patients: from pathophysiology to treatment[J]. Cardiorenal Med, 2015, 5(4): 254-266.
[6] Ogawa M, Suauki J, Takayama K, et al. Impaired post infarction cardiac remodeling in chronic kidney disease is due to excessive renin release[J]. Lab Invest, 2012, 92(12): 1766-1776.
[7] Magni P, Macchi C, Sirtori Cr, et al. Osteocalcin as a potential risk biomarker for cardiovascular and metabolic disease[J]. Clin Chem Lab Med, 2016, 54(10): 1579-1587.
[8] Verheyen N, Fahrleitner-Pammer A, Belyavskiy E, et al. Relationship between bone turnover and left ventricular function in primary hyperparathyroidism: The EPATH trial[J]. PloS One, 2017, 12(4): e0173799.
[9] Al Mheid I, Patel R, Murrow J, et al. Vitamin D status is associated with arterial stiffness and vascular dysfunction in healthy humans[J]. J Am Coll Cardiol, 2011, 58(2): 186-192.
[10] Chen S, Glenn DJ, Ni W, et al. Expression of the vitamin D receptor is increased in the hypertrophic heart[J]. Hypertension, 2008, 52(6): 1106-1112.
[11] Pilz S, Tomaschitz A, Drechsler C, et al. Vitamin D deficiency and myocardial disease[J]. Mol Nutr Food Res, 2010, 54(8): 1103-1113.
[12] Di Lullo L, Floccari F, Polito P. Right ventricular diastolic function in dialysis patients could be affected by vascular access[J]. Nephron Clin Pract, 2011, 118(3): c257-c261.
[13] Mansia G, Faqard R, Narkiewicz K, et al. 2013 ESH-ESC Guidelines for the management of arterial hypertension: the task force for the management of arterial hypertension of the European Society of Hypertension(ESH) and of the European Society of Cardiology(ESC)[J]. J Hypertens, 2013, 31(7): 1281-1357.
[14] Morin DP, Oikarinen L, Viitasalo M, et al. QRS duration predicts sudden cardiac death in hypertensive patients undergoing intensive medical therapy: the LIFE study[J]. Eur Heart J, 2009, 30(23): 2098-2114.
[15] Sundström J, Arnlöv J, Stolare K, et al. Blood pressure independent relations of left ventricular geometry to the metabolic syndrome and insulin resistance: a population-based study[J]. Heart, 2008, 94(7): 874-878.
[16] Paoletti E, De Nicola L, Gabbai FB, et al. Associations of left ventricular hypertrophy and geometry with adverse outcomes in patients with CKD and hypertension[J]. Clin J Am Soc Nephrol, 2016, 11(2): 271-279.
Thechangesofleftcardiacstructureandfunctioninthepatientswithnon-dialysischronickidneydiseaseandinfluencingfactors
CHENCai-ming,CHENYuan,CHENYi,ZHANGXiao-hong,WANJian-xin.
DepartmentofNephrology,theFirstAffiliatedHospitalofFujianMedicalUniversity,Fuzhou350005,China
WANJian-xin,E-mail:wanjx@263.net
ObjectiveTo analyze the changes of left ventricular structure and function in the patients with non-dialysis chronic kidney disease (ND-CKD) and the influencing factors.MethodsThe ND-CKD patients were enrolled from Jan. 2013 to July 2014 in our hospital. All patients were subjected to echocardiography and the indexes were collected. Also the clinical data were collected. The indexes of left ventricular structure and function among different CKD groups were analyzed, and the correlation between the changes of cardiac structure and function were clinical data were also analyzed.Results337 ND-CKD patients were enrolled, including 71 patients with CKD 1 stage, 37 patients with CKD 2 stage, 28 patients with CKD 3 stage, 36 patients with CKD stage 4 and 165 patients with CKD stage 5. In pace with the progression of CKD, the data revealed that body mass index (BMI) and serum calcium were gradually declined (P<0.05), while blood urea nitrogen (BUN), serum creatinine (SCr), serum phosphorus, intact parathyroid hormone (iPTH) and Cystatin C gradually ascended (P<0.05). New bone metabolic markers revealed that in pace with the progression of CKD, 25-(OH)-VitD gradually declined (P<0.05), but N-Osteocalcin(NOC), β-C-terminal telopeptide of typeⅠcollagen(β-CTX) and N-terminal peptide of typeⅠprocollagen (P1NP) gradually ascended (P<0.05). Echocardiographic indexes revealed that in pace with the progression of CKD, left ventricular end diastolic dimension (LVDd), left ventricular end systolic dimension (LVDs), and left ventricular mass index (LVMI) gradually ascended (P<0.05) in cardiac structure, and SV gradually ascended (P<0.05) in cardiac function, while relative wall thickness (RWT), cardiac output (CO), left ventricular ejection fraction (LV-EF), fractional shortening (FS), and transmitral diastolic early peak inflow velocity/transmitral diastolic late peak inflow velocity(E/A) had no statistically significant difference, but E/A gradually declined and was less than 1 after CKD 2. Left ventricular geometric remodeling revealed that the normal LV geometry group gradually declined from CKD 1 to CKD 5, with 84.5%, 70.3%, 64.3%, 44.4% and 38.2% respectively. The abnormal LV geometry groups gradually ascended from CKD 1 to CKD 5, and there were 32.1% with eccentric hypertrophy, 15.2% with concentric hypertrophy, and 14.5% with concentric remodeling. Multiple linear regression revealed that the risk factors of RWT were age and serum phosphorus, the risk factor of LVDd was BMI, the risk factor of LVMI was β-CTX, the risk factor of SV was Cystatin C, and the protective factors of E/A were age, gender(female), Ca and BUN.ConclusionsThe left ventricular structure and function in the patients with ND-CKD were aggravated in pace with the progression of CKD. Age, renal function, serum phosphorus, serum calcium, iPTH, BMI and β-CTX were related to the changes of left ventricular structure and function.
Chronic kidney disease; Cardiac structures; Cardiac function
10.3969/j.issn.1671-2390.2017.12.004
吴阶平医学基金会临床科研课题基金(No.320.6750.16059)
350005 福州,福建医科大学附属第一医院肾内科
万建新,E-mail:wanjx@263.net
2017-08-30
2017-11-21)
