欧式鹅膏毒蕈中毒肝肾损伤的临床病理特点
2018-01-09许书添李海蛟董建华李世军章轶哲孙承业孙健刘志红
许书添 李海蛟 董建华 孙 丹 李世军 章轶哲 孙承业 孙健 刘志红
欧式鹅膏毒蕈中毒肝肾损伤的临床病理特点
许书添1李海蛟2董建华1孙 丹1李世军1章轶哲2孙承业2孙健2刘志红1
目的:了解欧式鹅膏毒蕈中毒临床病理特点,为临床医师提供准确的临床病理信息。 方法:收集的一家3例毒蕈中毒患者的病例资料、对毒蕈样本进行形态学和分子生物学鉴定,同时结合患者临床、实验室检查以及病理特点进行分析。 结果:3例患者均食用自行采摘并烹制的蘑菇,用量不等,潜伏期8~12h,恶心、呕吐胃肠道症状后出现急性肾损伤和轻度肝损伤,经毒蕈形态学和分子生物学鉴定,确定为欧式鹅膏。给予血液净化和激素等对症支持治疗后,肝肾功能逐渐恢复。肾活检病理提示急性肾小管坏死伴急性间质性肾炎。 结论:欧式鹅膏毒蕈中毒可引起严重急性肾损伤和轻度肝损伤表现,肾脏病理表现为急性肾小管坏死和急性间质性肾炎,经积极救治临床结局较好。
欧式鹅膏 毒蕈 中毒 急性肾损伤
毒蕈(也称毒蘑菇)中毒时常有发生,轻者仅表现为急性胃肠道症状,对症处理即可,重者可造成多器官功能障碍甚至危及生命。目前毒蕈中毒无特效解毒药物,重症者可予血液净化或血浆置换治疗。毒蕈中毒临床表现复杂多样,临床上尽早识别重症患者,并及时采取相应治疗措施,可降低患者病死率。为对临床救治提供详尽准确的信息,本文对一家3例野生毒蕈中毒的临床及肝肾损害特征进行分析,旨在提高毒蕈中毒诊疗水平。
对象与方法
研究对象在南京总医院国家肾脏疾病临床医学研究中心确诊3例毒蕈中毒患者。收集患者的一般资料、临床病例资料和实验室检查指标及随访资料。
有关定义急性肾损伤(AKI)的诊断标准根据2012年KDIGO指南。肾功能完全恢复是指出院时血清肌酐(SCr)恢复至不超过基础SCr值44.2 mmol/L;部分恢复是指出院时SCr超过基础SCr值44.2 mmol/L,不超过最高SCr值,且摆脱透析(指停止透析>1周);不恢复是指患者SCr持续升高或需要维持性透析[1]。 基础SCr值定义为住院期间测得的SCr最小值或随访过程SCr最小值。
肾活检组织病理学检查肾组织标本行常规光镜、免疫荧光及电镜检查。肾活检组织采用石蜡包埋、切片,行HE、PAS、PASM-Masson及Masson三色染色,对疑有肌红蛋白成分进行特殊染色;免疫荧光检查采用直接法观察肾组织冰冻切片IgG、IgA、IgM和补体C3、C1q沉积部位、强度和分布特点;电镜检查对所取肾组织用3.75%的冷戊二醛固定,1%四氧化锇后固定,超薄切片厚度70~90 nm,醋酸铀、柠檬酸铅双染色,置于Hitachi7500透射电镜下观察。
毒物鉴定将烘干保存完好的毒蕈送至中国疾病预防控制中心职业卫生与中毒控制所进行形态学和分子生物学鉴定,其中分子生物学鉴定方法:采用Phire® Plant Direct PCR Kit (Finnzymes Oy,Finland)试剂盒从干标本中提取基因组DNA和PCR扩增。采用的片段为ITS,扩增引物为ITS5 (GGA AGT AAA AGT CGT AAC AAG G)和ITS4(TCC TCC GCT TAT TGA TAT GC) 。系统发育分析采用PAUP version 4.0b10(Swofford 2002),系统发育树中其他序列的选取主要参考[2]。
统计学方法所有数据采用 SPSS16.0统计软件处理,计量资料资料以均数±标准差表示。
结 果
一般资料病例1妻子(45岁),病例2丈夫(47岁),病例3大嫂(53岁),均否认高血压、糖尿病以及慢性肾炎病史。
病例1于2016-07-07晨采白色、伞状蘑菇约1kg,部分赠送给病例3。病例1和病例2中午和晚餐两人分别进食加工后蘑菇量共约500g和330g,病例3中午进食蘑菇100g。进食8~12h后3人均出现恶心、呕吐,呕吐胃内容物,无腹痛、发热,无多汗流涎和流泪,无意识障碍,无肉眼血尿,无少尿。3人分别于7月8日和10日至当地卫生所接受庆大霉素、林可霉素以及输液治疗(用法用量不详),呕吐较前缓解,但7月10日后3人逐渐发现尿量减少,最少<400 ml/d,经大量补液尿量未增加。7月14日3人均出现眼睑和双下肢水肿,但无胸闷气喘,因检查发现肾功能受损和重度酸中毒,随即转入我院急诊,经颈内静脉置管并床边血液净化,辅以护肝、护胃治疗后而收住院。查体:3人生命体征平稳,精神可,无脱水貌,皮肤巩膜无黄染,心肺腹检查阴性,双下肢无水肿。
实验室检查
尿常规分析 病例1尿蛋白1+,尿红细胞阴性;病例2、3尿蛋白和红细胞均阴性,3例尿嗜酸性粒细胞均阴性。
免疫学检查 三例抗中性粒细胞胞质抗体阴性;抗ds-DNA、ANA阴性;抗GBM抗体阴性;出血热特异性抗体IgG、IgM阴性,补体正常。
血气分析 pH:7.25±0.04;PaO2:123.6±17.6 mmHg;PaCO2:24.3±1.52 mmHg;BE:-14.3±1.57 mmol/L;HCO3-11±1 mmol/L;LAC 0.6±0.2 mmol/L;
凝血功能监测 PT:12.0±0.41s;APTT:34±6.57s;纤维蛋白原4.2±1.04g/L;INR1.05±0.04;
血常规 WBC 7.36±2.8×109/L;Hb12.7±0.51 g/dL;血小板 140±7.0×109/L;CRP 13.6±2.36 mg/L;
肾小管损伤指标 NAG 131±18.6 μ/(g·cr);RB蛋白29.3±10.9 mg/L;溶菌酶5.99±3.74 mg/L;IL-18 21.9±18.4 ng/L;NGAL 687±596 ng/L;尿糖分别2+、2+和1+;FENa分别为37.5%±23.8%;肾衰指数51.7±31.6 mmol/L;尿渗量分别为321、ND和265 mOsm/kg;上皮细胞计数2.1±0.7/μl;管型计数0.65±0.22/μl;
血生化 ALT 77.3±10.2 U/L;AST 20.3±7.5 U/L;LDH 3 303±659 U/L;SCr 1 548±251 μmol/L;TCO211.8±1.79 mmol/L;Pro-BNP 929±31.3 pmol/L;肌红蛋白192±126 ng/ml;CK 45±36.4 U/L;
肾脏病理病例2(当时SCr 553.4 μmol/L)行肾活检病理如下:
光镜 21个肾小球中1个球性废弃。皮质、皮髓质肾组织各1条。肾小管间质病变明显,表现为重度急性病变,斑片状肾小管上皮细胞扁平、刷状缘脱落,见肾小管裸膜及小管再生,偶见肾小管上皮细胞大空泡,散在肾小管萎缩、基膜增厚,管腔内见少量蛋白管型及脱落的肾小管上皮细胞,间质管周毛细血管充血明显,间质灶性增宽,较多炎细胞浸润,以单个核细胞为主,少量中性粒细胞和浆细胞,偶见嗜酸性粒细胞,临近见小管炎(图1A)。PASM-Masson:阴性。小叶间动脉节段内膜增厚。

图2 采集的毒蘑菇样本
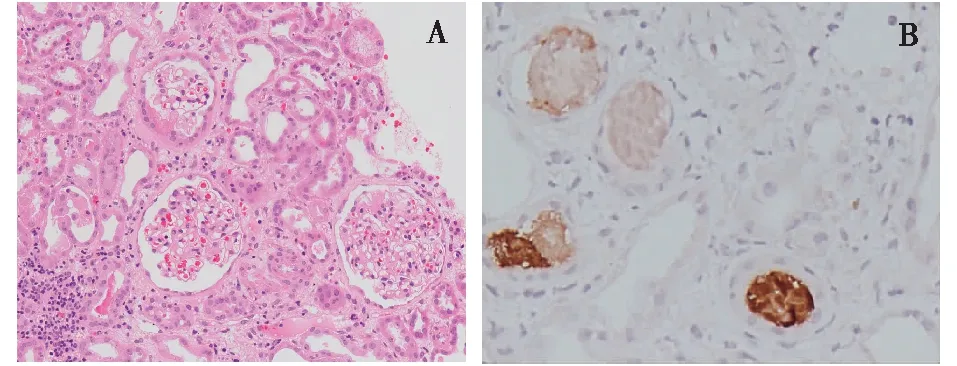
图1 A:肾小管间质病变明显,斑片状肾小管上皮细胞扁平、刷状缘脱落,见肾小管裸膜及小管再生,偶见肾小管上皮细胞大空泡,散在肾小管萎缩、基膜增厚,间质灶性增宽,较多炎细胞浸润(PAS,×400);B:肌红蛋白染色见个别肾小管管型阳性(IH,×400)
免疫荧光 肾小球5个,冰冻切片荧光染色IgM+,呈颗粒状弥漫分布于系膜区。IgG、IgA、C3、C1q阴性。
免疫组化 肌红蛋白染色见个别肾小管管型呈阳性(图1B)。
电镜 观察1个肾小球。肾小管上皮细胞刷状缘脱落,见部分肾小管上皮细胞脱落至管腔,见小管炎。间质见单个核细胞浸润 。
毒物鉴定结果2016-07-18患者家属再次采集相同蘑菇样本约1kg(图2),经烘干后取保存完好共计18朵送检。送检标本形态学高度一致,经宏观和微观结构的观察,鉴定为欧式鹅膏。
宏观结构 菌盖表面白色,中央有时米黄色,多光滑;菌褶白色,老时米色或淡黄色,短菌褶近菌柄端渐窄。菌柄近圆柱,白色,被白色反卷纤毛状或绒毛状鳞片;基部腹鼓状至白萝卜状,菌托浅杯状,游离檐托0~1 cm;菌环白色、上位。
显微结构 担子棒状,具4个小梗,基部无锁状联合;担孢子椭圆形至宽椭圆形,无色,光滑,在Melzer’s试剂中呈淀粉质反应,(8~10.5) × 6-8μm。
分子生物学特征 系统发育树结果见图3,其中粗体Amanita oberwinklerana (Genbank No.MF149046- MF149048)为事件样品,与该种其他序列聚类到同一分枝上(支持率100%),故鉴定为欧式鹅膏(amanita oberwinklerana)。
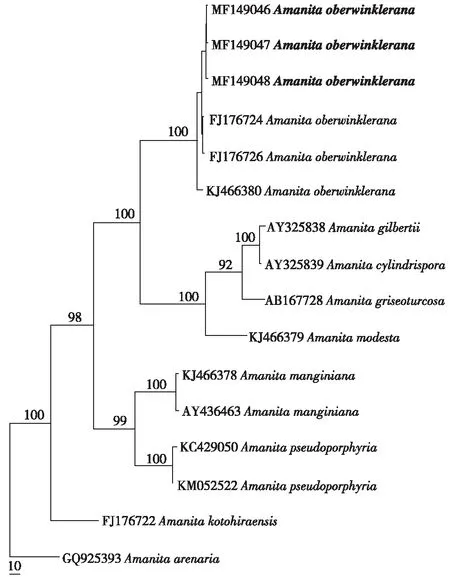
图3 基于ITS片段构建的MP系统发育树 其中粗体为事件标本获得的ITS序列
诊治经过根据患者临床特征、病例2肾脏病理及毒蕈鉴定结果,最终诊断为欧式鹅膏中毒,急性肾小管坏死伴急性间质性肾炎,AKI 3期。
3例患者入院后均给予中心静脉置管连续性血液净化及泮托拉唑注射剂护胃、多烯磷脂酰胆碱注射剂护肝、虫草制剂、联合中小剂量甲泼尼龙(15~40 mg/d)静滴对症处理,动态监测肝肾功能、血气分析以及电解质、凝血功能等检查。复查酸中毒基本纠正,尿量增加,转氨酶恢复正常,乳酸脱氢酶下降,逐渐摆脱透析并拔除中心静脉置管。病情好转出院。
随访资料2个月后3例患者肾功能均部分恢复;病例1出院时SCr 300.6 μmol/L,未随访。病例2出院时SCr 350.9 μmol/L,出院2月后SCr下降至79.6 μmol/L,尿检阴性,尿糖转阴,强的松逐渐减停。病例3出院时SCr 272.3 μmol/L,两月后复查尿检阴性,SCr 97.2 μmol/L,泼尼松减停。
讨 论
鹅膏菌属是一个世界性分布大属,全球已经描述的物种超过500种,在我国已有发现130种[3]。在欧洲和北美,90%以上的蘑菇中毒死亡是由鹅膏菌属的种类引起的。本起毒蕈中毒事件中,根据患者辨认食用的蘑菇样本,以及通过蘑菇标本的形态学特征和分子鉴定,确定为欧式鹅膏,此类蘑菇属于鹅膏属[4]。这有助于鉴定毒素的性质以及为临床预后判断提供可靠的保证。
欧式鹅膏中毒临床表现1999年首次报道欧式鹅膏[5],随后中国学者陆续报道此类鹅膏[3,6-7]。2013年韩国学者报告了在本土境内首次发现欧式鹅膏[8]。2015年在贵州省遵义发生一起欧式鹅膏中毒事件,共计父女两个人中毒[4],临床表现为进食毒蘑菇6h后出现胃肠道反应,继发轻度肝功能损伤和重度肾功能衰竭,临床预后良好。这两例与中国台湾、德国、葡萄牙与本文3例中毒病例高度类似,称之为“鹅膏肾毒性综合征” (amanita nephrotoxic syndrome)[4],表现为食用毒蕈6~12h之后出现呕吐、腹泻、腹痛等肠胃症状。从误食到肝肾损害一般是1~4d,肝酶升高约为正常上限的1~5倍,反映出肝功能轻中度受损。肾功能损害的表现为急性肾小管间质病变,临床表现为少尿或无尿,生化指标表现为血液中SCr和尿素氮升高,约25%的病例需要进行血液透析。肾功能恢复期约为3周左右,没有肝肾后遗症报道。本组3例患者发病2月后肾功能仅部分恢复,推测原因可能与容量不足情况下使用肾毒性药物等因素有关。
欧式鹅膏毒素可引起AKI的毒蘑菇有两类:含奥来毒素的丝膜菌属的一些种类和含有2-氨基-4、5已二烯酸的鹅膏菌属的一些种类。含有奥来毒素的蘑菇主要是丝膜菌属的一些种类。由于丝膜菌属引起的中毒特征具有较长潜伏期,而本例患者发病特点明显与丝膜菌属中毒不符。鹅膏菌属鳞鹅膏组中的鹅膏菌引起急性肾损伤的毒素成分通常认为是2-氨基-4、5已二烯酸,有关其中毒机制目前还不清楚。也有学者认为其毒素不是2-氨基-4、5已二烯酸[9],而是一种未知成分。目前有关欧式鹅膏毒素的鉴定仍无法明确,需要进一步研究证实,但可以肯定的是不属于鹅膏毒肽的主要毒素(包括ɑ-鹅膏毒肽、β-鹅膏毒肽)以及鬼笔毒肽[4,10]。
欧式鹅膏菌致肾损害病理特点目前有关鹅膏菌导致肾脏损害的病理报道很少,欧式鹅膏肾损害病理类型至今未见报道,一般认为导致急性间质性肾炎和急性肾小管坏死[11]。本文报道的3例患者中,仅有一例行肾活检病理检查,结果提示急性间质性肾炎和急性肾小管坏死。这也是迄今为止首例报道欧式鹅膏引起肾脏病理损害。本例患者病程中同时使用两种具有肾毒性的抗生素(庆大霉素和林可霉素),二者从理论上均有导致的肾小管间质损害可能[12-13],但病理上难以区分药物性肾损害和鹅膏菌毒素肾损害,因此不能除外肾毒性药物加重肾损伤可能。再者,我们注意到患者血肌红蛋白偏高,病理上可见个别管型有肌红蛋白阳性(图1B),且尽管肌酸激酶正常,因此不能排除毒蕈毒素产生横纹肌溶解加重肾小管间质损害。“鹅膏肾毒性综合征”没有肝肾功能后遗症,且恢复期平均在3周左右,本组3例患者发病2月后肾功能仅部分恢复,预后不如文献病例好,这恰恰证明本组患者不能排除药物毒性和横纹肌溶解等加重因素。总之,结合既往文献病例报道以及本文3例病例,可以明确欧式鹅膏会引起急性肾小管间质性损伤,诊断时需甄别药物等加重肾损伤因素。治疗上短期给予糖皮质激素(1 mg/kg)改善间质炎症,促进肾小管间质损伤修复[9]。
小结:蘑菇中毒患者应尽可能明确毒蕈类型,指导药物治疗和判断预后。本文3例欧式鹅膏中毒患者,合并轻度肝损伤和严重肾功能受损,肾脏病理表现为急性肾小管坏死和急性间质性肾炎,经血液净化以及支持治疗,其预后较好。
1 Palevsky PM,Zhang JH,O′Connor TZ,et al.Intensity of renal support in critically ill patients with acute kidney injury.N Engl J Med,2008,359(1):7-20.
2 Cai Q,Tulloss RE,Tang LP,et al.Multi-locus phylogeny of lethal amanitas: implications for species diversity and historical biogeography.BMC Evol Biol,2014,14:143.
3 杨祝良.中国鹅膏科真菌图志.北京:科学出版社,2015:213.
4 Xiaoyun Fu,Bao Fu,Zhengmi He,et al.Acute renal failure caused by Amanita oberwinklerana poisoning.mycoscience 2007.58:121-127.
5 Yang ZL,Doi Y,1999.A contribution to the knowledge of Amanita (Amanitaceae,Agaricales) in Japan.Bulletin of the National Science Museum.Series B,Botany 25,1999:107-130.
6 杨祝良.中国真菌志.第27卷 鹅膏科.北京:科学出版社,2005:258.
7 Yang ZL,Li TH,2001.Notes on three white Amanitae of section Phalloideae (Amanitaceae) from China.Mycotaxon,2001,78: 439-448.
8 Kim CS,Jo JW,Kwag YN,et al.Taxonomic study of amanita subgenus lepidella and three unrecorded amanita species in Korea.Mycobiology,2013,41(4):183-190.
9 Kirchmair M,Carrilho P,Pfab R,et al.Amanita poisonings resulting in acute,reversible renal failure: new cases,new toxic Amanita mushrooms.Nephrol Dial Transplant,2012,27(4):1380-1386.
10 Tang S,Zhou Q,He Z,et al.Cyclopeptide toxins of lethal amanitas: Compositions,distribution and phylogenetic implication.Toxicon,2016,120:78-88.
11 Graeme KA.Mycetism: a review of the recent literature.J Med Toxicol,2014,10(2):173-189.
12 谢红浪、陈惠萍等.克林霉素导致的急性肾损伤。肾脏病与透析肾移植杂志,2011,20 (5): 432-437.
13 McWilliam SJ,Antoine DJ,Smyth RL,et al.Aminoglycoside-induced nephrotoxicity in children.Pediatr Nephrol,2017,32(11):2015-2025.
Clinicalpathologicfeaturesofliverandkidneyinjurycausedbyamanitaoberwinkleranapoisoning
XUShutian1,LIHaijiao2,DONGJianhua1,SUNDan1,LIShijun1,ZHANGYizhe2,SUNChengye2,SUNJian2,LIUZhihong1
1NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing210016,China2NationalInstituteofOccupationalHealthandPoisonControl,ChineseCenterforDiseaseControlandPrevention,Beijing100050,China
LIUZhihong(E-mail:liuzhihong@nju.edu.cn)
Objective:To understand clinical and pathological characteristics as well as the clinical prognosis of the Amanita oberwinklerana toxic mushroom poisoning,and to provide accurate information for clinical physicians.MethodologyWe found a family of 3 members who eating self picking and cooking mushrooms.Clinical investigation,morphology and molecular biology identification of mushroom samples at the same time,combined with the clinical,laboratory examination and pathological features of the patients were analyzed.ResultsThe incubation period of 8 to 12 hours,nausea,vomiting,gastrointestinal symptoms secondary oliguria and severe acute renal injury and mild liver damage.According to the morphology and molecular biology identification,the toxic mushroom was identified as Amanita oberwinklerana.Given the continuous blood purification and steroid,liver and kidney function recovered gradually,Renal biopsy pathology showed acute tubular necrosis with acute interstitial nephritis.ConclusionAmanita oberwinklerana poisoning can cause severe acute kidney injury and mild liver damage,kidney pathology demonstrated acute tubular necrosis and acute interstitial nephritis,the clinical outcome is good after active treatment.
amanita oberwinklerana toxic mushroom poisoning acute kidney injury
10.3969/cndt.j.issn.1006-298X.2017.06.003
南京总医院院管课题(2015029)
1南京总医院 国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016);2中国疾病预防控制中心职业卫生与中毒控制所
刘志红(E-mail:liuzhihong@nju.edu.cn)
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有
2017-05-23
(本文编辑 律 舟)
