超声造影检测子宫内膜及内膜下血流灌注评价子宫内膜容受性的应用研究
2018-01-09张亚兰李秀春刘昌荣
张亚兰 李秀春 刘昌荣
超声造影检测子宫内膜及内膜下血流灌注评价子宫内膜容受性的应用研究
张亚兰①李秀春①刘昌荣①
目的:探讨超声造影(CEUS)检测子宫内膜及内膜下血流灌注情况,评价子宫内膜容受性的临床价值。方法:选取86例妇产科门诊检查的病例,将其中49名健康育龄期女性纳入健康组,37例不孕症患者纳入不孕组,分别在增殖晚期、排卵期和种植窗口期对所有受试者进行经阴道彩色多普勒血流成像(CDFI)以及CEUS检测;其中20名健康女性和18例不孕症患者接受子宫内膜活检。统计2组微血管密度(MVD)和时间-强度曲线(TIC)。结果:经CDFI检测在增殖晚期,健康组受试者比不孕组受试者子宫内膜及内膜下血流灌注更丰富,差异有统计学意义(x2=4.575,P<0.05);经活检在增殖晚期和排卵期,不孕组受试者的子宫内膜MVD均低于健康组,差异有统计学意义(t=7.821,t=8.659;P<0.05);经CEUS检测在增殖晚期和排卵期,健康组受试者子宫内膜和内膜下峰值强度(Pi)和曲线下面积(AUC)值均高于不孕组,差异有统计学意义(t=8.004,t=1.269,t=6.581,t=6.759;P<0.05);且两组受试者内膜下峰值强度(Pi)与MVD均呈正相关。结论:超声造影检测可以通过准确检测子宫内膜及内膜下血流灌注情况,评价子宫内膜的容受性,值得临床推广。
超声造影;子宫内膜容受性;血流灌注;微血管密度;时间-强度曲线;超声造影剂
子宫内膜容受性是指母体子宫内膜特定时间内接受胚胎种植的能力[1]。临床上认为胞饮突是评价子宫内膜容受性的超微结构标志物,需要进行子宫内膜活检,不仅价格昂贵,且易对子宫造成创伤,因此临床应用受限[2]。经阴道超声造影价格低廉且不会入侵子宫,有潜力成为评价子宫内膜容受性的检测手段[3]。
近年来,随着新型微气泡声学超声造影剂的面世,以及检测仪器灵敏度的提高,超声造影(contrastenhanced ultrasound,CEUS)已广泛用于检测各种器官血流灌注情况。既往有研究证实,子宫内膜及内膜下血流灌注与子宫内膜容受性密切相关[4]。为此,本研究通过超声造影技术,检测不孕症患者和健康育龄女性子宫内膜以及内膜下血流灌注情况,评价子宫内膜的容受性。
1 资料与方法
1.1 一般资料
选取2015年2月至2017年4月期间在荆州市妇幼保健院妇产科门诊检查的86例就诊病例,年龄为21~35岁,平均年龄为(28.32±3.17)岁,将其中的49名健康育龄期女性纳入健康组,37例不孕症患者纳入不孕组。86例就诊病例中20名健康育龄期女性和18例不孕症患者接受子宫内膜活检,其余受试者未进行此项检查。分别在增殖晚期、排卵期和种植窗口期对所有受试者进行经阴道彩色多普勒血流成像(color Doppler flow imaging,CDFI)以及CEUS检测,统计微血管密度(microvessel density,MVD)和时间-强度曲线(timeintensity curve,TIC)。受试者均签署知情同意书。
1.2 纳入与排除标准
(1)纳入标准:①具有完整的病历资料;②对于不孕症患者,需1年以上正常性生活,但仍未怀孕且被诊断为不明原因不孕;③健康育龄期女性1年内有生育史,并停止母乳喂养>3个月;④无任何妇科疾病;⑤月经周期正常;⑥入院前3个月未服用任何影响盆腔供血的药物;⑦既往无血液系统疾病史。
(2)排除标准:①排卵障碍患者;②双侧输卵管均不通患者;③患有盆腔感染和子宫内膜炎;④患有卵巢囊肿妇科疾病。
1.3 仪器与试剂
采用Volusion 730 EXPERT型三维彩色B超诊断仪(美国通用公司),探头频率为4~9.5 MHz,脉冲频率为4~6 cm/s。Sonovue新型超声造影剂(意大利Bracco公司)。
1.4 检查时间
接受超声检查的受试者分别于同一月经周期增殖晚期(第10~12 d)、排卵期(排卵当日至排卵后2 d)、种植窗口期(排卵后第8 d至第10 d)先进行超声检查,再进行活检。根据阴道超声检查以及尿促黄体生成素(luteotropic hormone,LH)的浓度确定排卵时间。
1.5 CDFI检查
获取子宫灰阶正中长轴切面,采用CDFI模式检测子宫内膜及内膜下血流灌注情况。将内膜下区域设定为内膜边缘外5 mm,根据内膜及内膜下血流灌注情况分为:①Ⅰ型,内膜区域可见血流信号,并接近宫腔中线;②Ⅱ型,内膜区域可见血流信号,但≤1/2单层内膜;③Ⅲ型,内膜下区域可见血流信号,如图1所示。
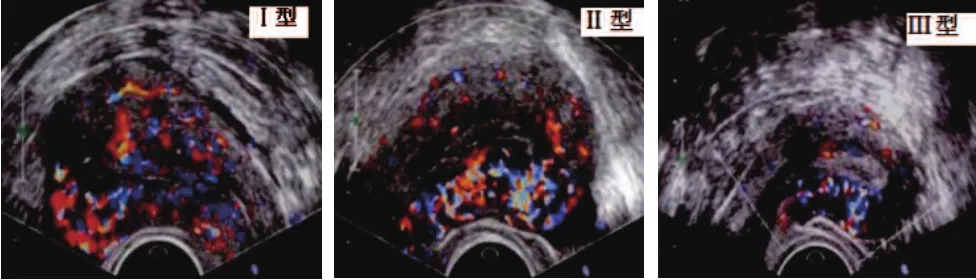
图1 子宫内膜及内膜下血流灌注分型声像图
1.6 CEUS检查
采用Sonovue新型超声造影剂,静脉注射进入检查者体内。获取子宫正中长轴切面,通过自动超声造影模式进行造影,保存动态图像;统计TIC。采用Q-Lab软件分析TIC数据,包括峰值强度(peak intensity,Pi)和曲线下面积(area under curve,AUC),如图2、图3所示。
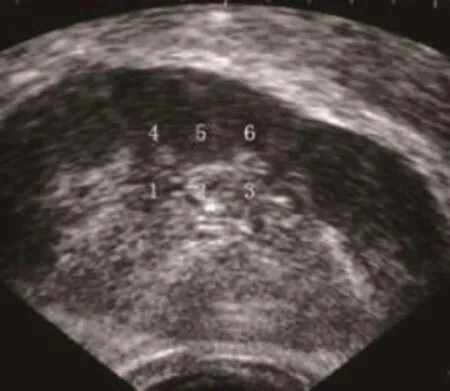
图2 CEUS检查子宫内膜下6个重点区域图像
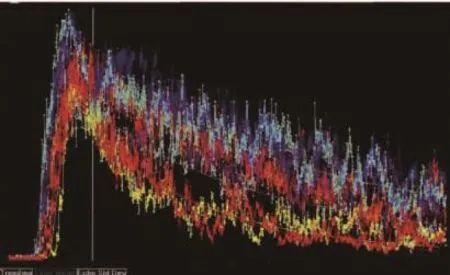
图3 子宫内膜下6个子区域的TIC图像
1.7 子宫内膜活检
受试者活检当日以及术后连续服用达力新至少3 d,手术当日受试者膀胱内留尿,采用宫腔组织吸引管,进入子宫内7~8 cm,到达宫壁后往回抽吸,采集子宫内膜组织。将获取的组织置入10%的福尔马林固定液中,用石蜡包埋制片,将蜡块切片后,进行HE染色或CD34免疫组织化学染色。采用Weidne改良定量法检测MVD,用条和(或)视野作为统计单位。
1.8 统计学方法
采用SPSS 19.0统计学软件进行处理,计数资料采用Mann-Whitney U检验或者Kruskal-Wallis检验,计量资料之间的比较采用独立样本t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 两组子宫内膜及内膜下血流灌注分型比较
经CDFI检测,在增殖晚期两组受试者子宫内膜及内膜下血流灌注分型情况相比,差异有统计学意义(x2=4.575,P<0.05);健康组受试者子宫内膜及内膜下血流情况更丰富,但在排卵期和种植窗口期,两组受试者子宫内膜及内膜下血流灌注情况分型相比,差异无统计学意义(x2=2.986,x2=1.374;P>0.05),见表1。
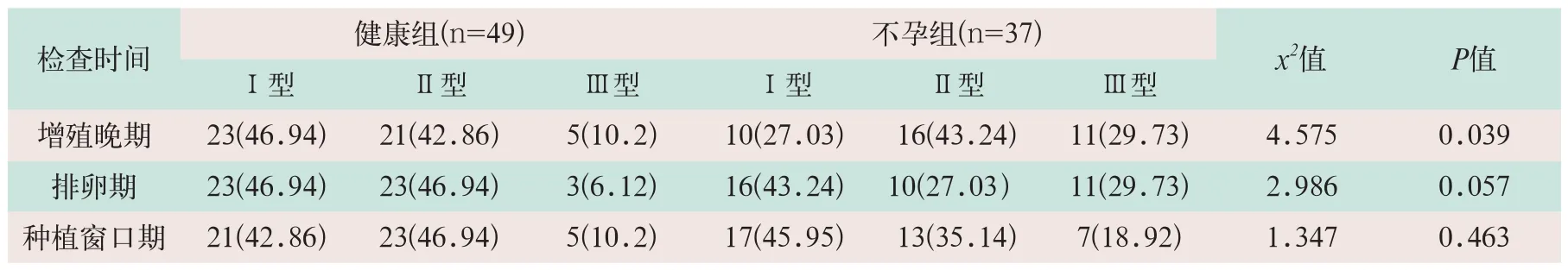
表1 两组子宫内膜及内膜下血流灌注情况分型[例(%)]
2.2 两组子宫内膜MVD比较
对比20名健康育龄期女性和18例不孕症患者,接受子宫内膜活检的情况,在增殖晚期和排卵期,不孕组子宫内膜MVD均低于健康组,差异有统计学意义(t=7.821,t=8.659;P<0.05);表明健康组子宫内膜微血管更多,血流灌注更丰富,但在种植窗口期,两组子宫内膜MVD相比,差异无统计学意义(t=0.753,P>0.05),见表2。
表2 两组子宫内膜MVD比较(条/视野) (±s)
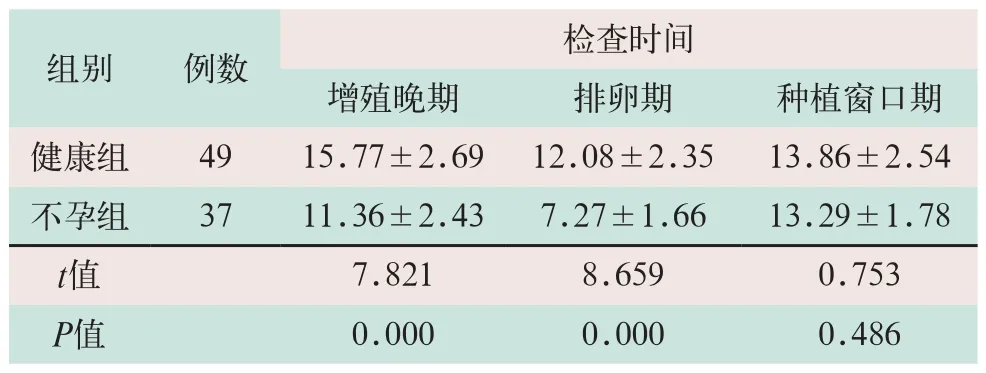
表2 两组子宫内膜MVD比较(条/视野) (±s)
2.3 两组TIC参数比较
(1)子宫内膜和内膜下Pi和AUC值是最重要的两个TIC参数,在增殖晚期和排卵期,健康组子宫内膜Pi和AUC值均高于不孕组,差异有统计学意义(t=8.004,t=1.269,t=6.581,t=6.759;P<0.05);在种植窗口期,两组子宫内膜Pi和AUC值均相当,差异无统计学意义(t=1.001,t=0.899,t=0.708,t=0.945;P>0.05),见表3。
(2)健康组和不孕组内膜下Pi在3个不同检测时间点的值比较,差异有统计学意义(F=3.756,F=5.083,F=4.627;P<0.05),但在排卵期最低,在种植窗口期达到峰值,见表4。
表3 两组内膜TIC参数比较 (±s)
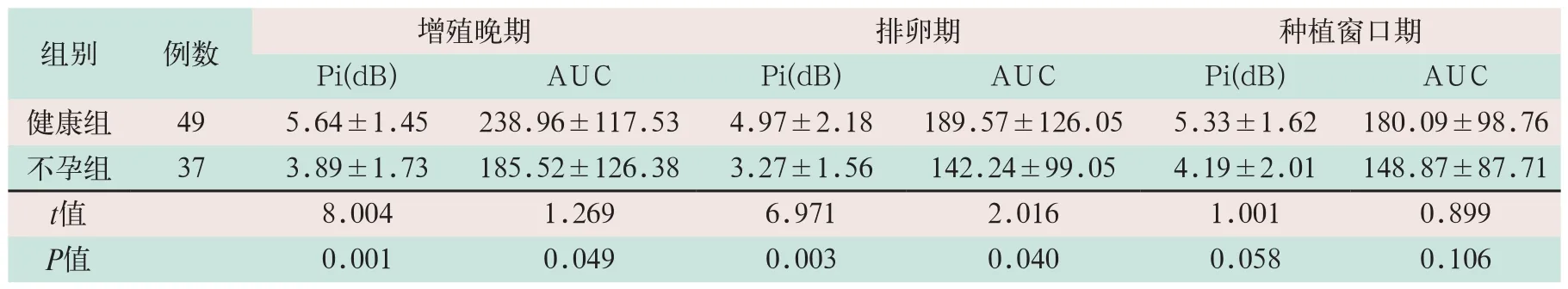
表3 两组内膜TIC参数比较 (±s)
表4 两组内膜下TIC参数比较 ±s)
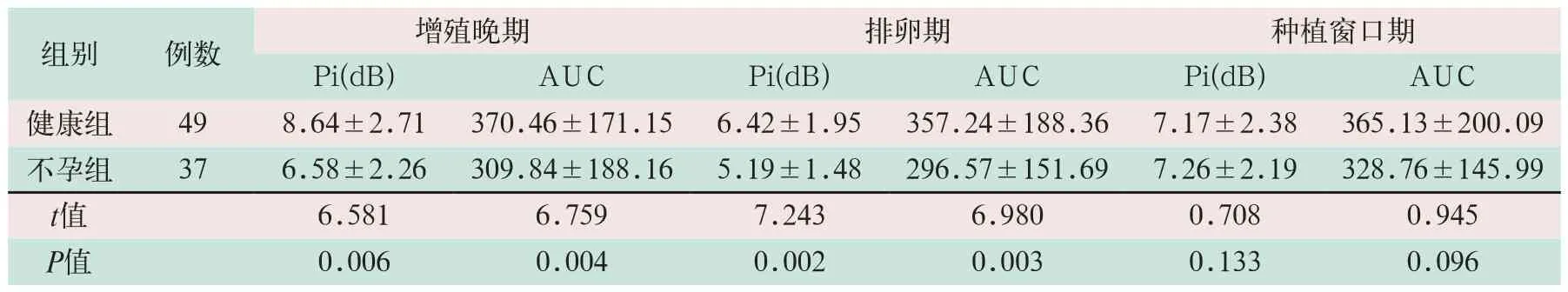
表4 两组内膜下TIC参数比较 ±s)
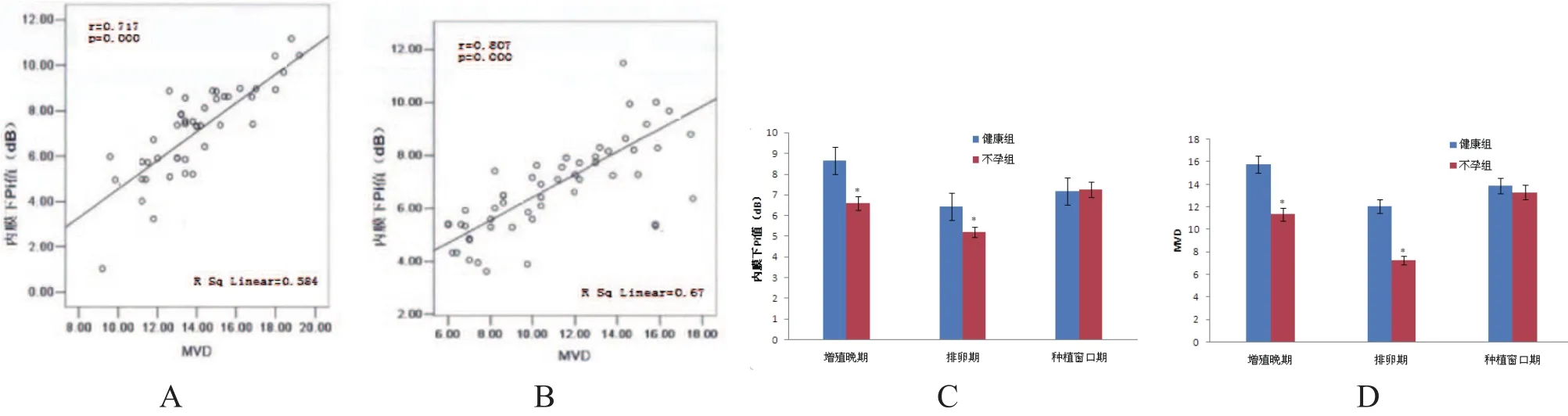
图4 内膜下Pi与MVD的关系示图
2.4 内膜下Pi与MVD的关系
健康组和不孕组内膜下Pi与MVD均呈正相关,如图4所示。
3 讨论
子宫对胚泡种植的接受期时间很短,通常为排卵后6~8 d,在此关键时期是子宫具备容受性的时间段[5]。子宫内膜容受性的建立需要多种因素参与,尤其是受到卵巢分泌的性激素的影响,在激素周期性分泌的宏观调控下,子宫内膜局部周期性表达容受性相关分子,从而影响胚泡的植入[6-7]。
目前,全球范围内大约有15%左右的适龄期夫妇患有不孕不育,排除卵巢、子宫、输卵管等器质性变化、精子因素以及激素分泌异常等因素,很多女性确诊为不明原因不孕症[8]。而子宫内膜容受性异常被认为是这部分不孕症患者的主要原因,虽然子宫内膜活检可以检查患者的子宫内膜容受性,但是价格昂贵,且属于有创手术,易对患者子宫造成伤害,患者接受程度较差,从而使得其临床推广受限。相比这种入侵式的手术方式,超声检查更易被患者接受[9-10]。
MVD作为反映血管生成和血流灌注最直接的检测指标,一直得到临床上的普遍认可[11]。CD34是血管内皮细胞其特异性标志抗原,敏感性较高,本研究通过免疫组化的方法对血管内皮细胞CD34进行染色标记,计数MVD[12]。本研究结果显示,在增殖晚期和排卵期,不孕组的MVD低于健康组,表明健康组子宫内膜微血管更多,血流灌注更丰富。由此可以推断,子宫内膜受损及内膜下血流灌注情况异常是很多患者不孕的主要原因。但是根据CDFI的检测结果,在增殖晚期,健康组比不孕组子宫内膜及内膜下血流灌注更丰富,有统计学差异,但在排卵期和种植窗口期,两组子宫内膜及内膜下血流灌注情况分型无统计学差异。
MVD统计结果和CDFI检测结果存在一定的偏差,推测原因可能是因为CDFI检测手段具有一定的局限性,检测结果易受到设备设定条件、衰减情况以及操作技术等影响;此外,虽然子宫内膜活检创伤较小,但是仍有可能刺激到微血管再生,因此有可能导致排卵期间受试者血流灌注差异减小[13]。相较于活检和CDFI,CEUS则是一种更敏感、更可靠以及重复性更好的检测手段。以往利用CDFI检测子宫内膜及内膜下血流灌注情况一直备受临床争议[14]。
随着近年CEUS广泛应用于临床,以及新型微气泡声学超声造影剂的出现,可以极大提高CEUS检测的精确度和灵敏度[15]。本研究中CEUS检测结果显示,在增殖晚期和排卵期,健康组子宫内膜和内膜下Pi和AUC值均高于不孕组;在种植窗口期,两组子宫内膜和内膜下Pi和AUC值均相当,证实CEUS检测结果与MVD结果一致,表明CEUS用于检测子宫内膜及内膜下血流灌注较CDFI准确性更高。此外,健康组和不孕组内膜下Pi在3个不同检测时间点的值比较有统计学差异,在排卵期最低,在种植窗口期达到峰值,并且与MVD呈正相关性,表明内膜下Pi对于评价子宫内膜及内膜下微循环灌注较AUC更敏感,MVD值越大,Pi值越大,微血管生成越多,血流灌注量越丰富。
综上所述,超声造影检测可以准确可靠地检测子宫内膜及内膜下血流灌注情况,用以评价子宫内膜的容受性,具有较大的临床价值和应用前景。
[1]Homer H,Rice GE,Salomon C.Review:Embryoand endometrium-derived exosomes and their potential role in assisted reproductive treatments-liquid biopsies for endometrial receptivity[J].Placenta,2017,54:89-94.
[2]隋晓倩,于德钦,张冬梅.子宫内膜容受性各相关标志物研究进展[J].生殖与避孕,2015,35(3):185-190.
[3]Pop CM,Mihu D,Badea R.Role of contrastenhanced ultrasound(CEUS)in the diagnosis of endometrial pathology[J].Clujul Med,2015,88(4):433-437.
[4]Chen M,He Y,Zhang P,et al.Comparison of Uterine Receptivity between Fertile and Unexplained Infertile Women by Assessment of Endometrial and Subendometrial Perfusion Using Contrast-EnhancedUltrasound:Which Index is Better--Peak Intensity or Area under the Curve?[J].Ultrasound Med Biol,2016,42(3):654-663.
[5]Al Chami A,Saridogan E.Endometrial Polyps and Subfertility [J].J Obstet Gynaecol India,2017,67(1):9-14.
[6]张宁宁,左娜,杨清.改善子宫内膜容受性方法的研究进展[J].医学综述,2017,23(4):629-633.
[7]Devoto L,Henríquez S,Kohen P,et al.The significance of estradiol metabolites in human corpus luteum physiology[J].Steroids,2017,123:50-54.
[8]Liu Y,Xu Y,Cheng W,et al.Quantitative contrast-enhanced ultrasonography for the differential diagnosis of endometrial hyperplasia and endometrial neoplasms[J].Oncol Lett,2016,12(5):3763-3770.
[9]曾品鸿,叶鸿.子宫内膜容受性的超声评价[J].实用妇产科杂志,2015,31(1):12-14.
[10]Angioli R,Plotti F,Capriglione S,et al.Preoperative local staging of endometrial cancer:the challenge of imaging techniques and serum biomarkers[J].Arch Gynecol Obstet,2016,294(6):1291-1298.
[11]Rübenthaler J,Paprottka KJ,Hameister E,et al.Diagnostic accuracy of contrast-enhanced ultrasound(CEUS)in monitoring vascular complications in patients after liver transplantationdiagnostic performance compared with histopathological results[J].Clin Hemorheol Microcirc,2017,66(4):311-316.
[12]徐少元,刘倍余,李洁.人类子宫内膜容受性评估的研究进展[J].生殖医学杂志.2014,22(1):19-23.
[13]Zanozin AS,Demura TA,Kolosovsky DY,et al.Impaired endometrial receptivity in primary infertility in women with undifferentiated connective tissue dysplasia and hereditary thrombophilia[J].Arkh Patol,2016,78(6):23-29.
[14]邓玲灵,赵萍.超声评价不孕症患者子宫内膜容受性的研究进展[J].临床超声医学杂志,2014,16(8):543-545.
[15]Fujii S,Kido A,Mikami Y,et al.Peritumoral enhancement in endometrial cancer on dynamic contrast-enhanced imaging:radiologicpathologic correlation[J].J Obstet Gynaecol Res,2014,40(5):1445-1449.
An application study on assessment for endometrial receptivity by detecting endometrial and sub-endometrial perfusion with contrast-enhanced ultrasound
/ZHANG Yalan, LI Xiu-chun, LIU Chang-rong
Objective:To discuss the endometrial and sub-endometrial perfusion by using contrast-enhanced ultrasound (CEUS) so as to assess the clinical value of endometrial receptivity.Methods:86 cases, that were divided into healthy group (49 healthy females) and infertility group (37 patients with infertility),were enrolled in the research. All of cases
detection of color doppler flow imaging (CDFI) and CEUS per vaginam at later period of proliferation, ovulatory period and window phase of implantation, respectively. In these cases, 20 healthy females and 18 patients received endometrial biopsy. The microvessel density (MVD) and time intensity curve (TIC) were analyzed.Results:At the later period of proliferation, the endometrial and subendometrial perfusion of the healthy females were significantly more abundant than that of the infertility females as the results of CDFI (x2=4.575, P<0.05). As the results of biopsy for later period of proliferation and ovulatory period, the endometrial MVD of infertility females were significantly lower than that of healthy females (t=7.821,t=8.659, P<0.05). As the results of CEUS for later period of proliferation and ovulatory period, the endometrial and sub-endometrial perfusion peak intensity (Pi) value and area under the curve (AUC) value of healthy females were significantly higher than that of infertility females (t=8.004, t=1.269, t=6.581, t=6.759, P<0.05). Besides, the subendometrial Pi were positive correlation with MVD at healthy group and infertility group, respectively.Conclusion:The CEUS can assess the endometrial receptivity through accurately detected endometrial and sub-endometrial perfusion. Therefore, it is worthy to be popularized in clinical practice.
Contrast-enhanced ultrasound; Endometrial receptivity; Perfusion; Microvessel density; Time-intensity curve; Ultrasound contrast agent
Department of Special Inspection, Maternal and Child Health Care Hospital of Jingzhou City, Jingzhou 434020,China.

张亚兰,女,(1979- ),本科学历,主治医师。荆州市妇幼保健院特检科,研究方向:超声医学。
①荆州市妇幼保健院特检科 湖北 荆州 434020
//China Medical Equipment,2017,14(12):7-11.
1672-8270(2017)12-0007-05
R445.1
A
10.3969/J.ISSN.1672-8270.2017.12.003
2017-06-03
