A-Raf-S214C突变体的构建、表达及其对MAPK信号通路的影响
2018-01-08李安毅杨洋刘莹郭晓汐郝倩徐天瑞安输
李安毅 杨洋 刘莹 郭晓汐 郝倩 徐天瑞 安输
(昆明理工大学生命科学与技术学院 云南省高校靶点药物筛选与利用重点实验室,昆明 650500)
A-Raf-S214C突变体的构建、表达及其对MAPK信号通路的影响
李安毅 杨洋 刘莹 郭晓汐 郝倩 徐天瑞 安输
(昆明理工大学生命科学与技术学院 云南省高校靶点药物筛选与利用重点实验室,昆明 650500)
为了观察A-Raf的突变体A-Raf-S214C对MAPK(mitogen-activated protein kinase,丝裂原活化蛋白激酶)信号通路的影响,并探讨其诱发肺癌和朗格汉斯增生症的可能分子机制。通过定点突变构建pcDNA5-FRT-TO-A-Raf-S214C突变质粒,并利用该质粒构建稳定表达A-Raf-S214C突变体的HEK293细胞系,之后通过检测下游ERK磷酸化程度,确定该突变体对MAPK信号通路的影响。结果显示,通过实验成功构建了稳定表达A-Raf-S214C突变体的细胞系,在不同浓度的多西环素诱导下,其表达量有所不同。与野生型相比,A-Raf-S214C突变体可明显增强MAPK信号通路中下游信号分子ERK的磷酸化。结果表明A-Raf-S214C突变体是A-Raf激酶的激活突变体,可以导致MAPK信号通路下游信号分子ERK磷酸化明显增强。
A-Raf激酶;MAPK信号通路;信号传导
Raf激 酶(Rapidly accelerated fibrosarcoma) 是逆转录病毒致癌基因v-Raf的同源蛋白,它调控细胞的生长、分化、转化和凋亡等诸多生命过程,Raf-MEK-ERK通路是细胞信号传导的一条主干通路,这条通路的调控失常是细胞癌变的主要原因之一[1-2]。
Raf激酶家族有3个成员A-Raf、B-Raf和C-Raf(Raf-1),它们均可被上游信号分子Ras激酶激活(Ras突变和异常活化与20%的人类癌症相关[3]),从细胞质转位到细胞膜,并通过磷酸化靶蛋白MEK来进一步激活ERK。但3个成员生物学功能却各有所不同[4-5]。与 B-Raf和 C-Raf相比,A-Raf的激酶活性最低,仅为 C-Raf的 20%[6]。而且,A-Raf突变在癌症中的发现相对较少,目前仅在肺癌细胞中发现了 A-Raf-S214C 突变体[7]。
A-Raf-S214C突变体是A-Raf的第214位氨基酸丝氨酸突变为半胱氨酸。通过基因组学筛查在肺癌细胞中发现该突变体,并且它能转化支气管表皮细胞,使其发生癌变[7]。在朗格汉氏增生症中也发现该突变[8]。A-Raf(S214C)突变体对MAPK的激活能力几乎与 B-Raf(V600E)相同[8]。
本研究通过点突变法构建了A-Raf-S214C位点突变真核表达质粒,并在Flp-In T-Rex HEK293细胞进行稳转,构建该突变体的稳定表达细胞系,检测其在Flp-In T-Rex HEK293细胞中的表达水平,以及其对MAPK信号通路的作用。
1 材料与方法
1.1 材料
1.1.1 细胞、菌株和质粒 A-Raf cDNA、Flp-In细胞、pcDNA5/FRET/TO载体由本实验室保存,感受态大肠杆菌DH5α购自TaKaRa公司。引物合成和测序工作由生工生物工程(上海)有限公司完成。
1.1.2 主要试剂盒与抗体 TOYOBO点突变试剂盒购自东洋纺(上海)生物科技有限公司(该试剂盒含 有 KOD-Plus-、DpnI、T4 Polynucleotide Kinase、Ligation high等);胶回收试剂盒、质粒提取试剂盒等购自Tiangen公司;DMEM培养基、Blasticidin、Zeocin、Hygromycin、转染试剂Lipo-fectamine2000均购自Invitrogen corporation;胎牛血清和Opti-MEM培养基购自北京Solarbio有限公司;Anti-VSV、Anti-GAPDH、Anti-ERK、Anti-p-ERK购 自 Santa Cruz Biotechnology;辣根过氧化物标记鼠、羊、兔IgG抗体购自Kirkegaarg & laboratories公司。
1.2 方法
1.2.1 pcDNA5/FRT/TO-VSV-A-Raf质粒的构建 首先根据载体特点及VSV标签序列设计上下游引物(表1)。然后用PCR的方法将VSV标签序列及限制性酶切位点引入A-Raf的cDNA,并用BamH I和Xho I酶对pcDNA5/FRET/TO载体和含有VSV标签和酶切位点的A-Raf cDNA进行双酶切,利用连接酶将扩增的VSV-A-Raf基因连接到pcDNA5/FRET/TO载体,从而得到pcDNA5/FRT/TO-VSV-A-Raf质粒(以下简称A-Raf质粒)。将质粒送生工生物工程(上海)有限公司测序。
1.2.2 设计点突变引物 以A-Raf质粒为模板,设计点突变引物(表1),并送生工生物工程(上海)有限公司合成。
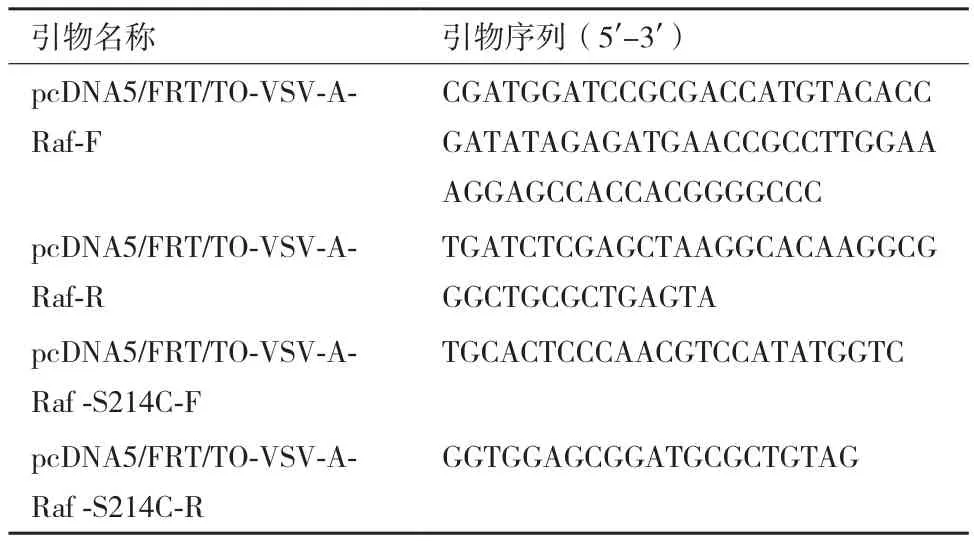
表1 引物列表
1.2.3 pcDNA5/FRT/TO-VSV-A-Raf-S214C突变体(以下简称A-Raf-S214C)的构建与鉴定 用TOYOBO点突变试剂盒构建突变体质粒。第一步,以A-Raf质粒为模板,用反向设计的两条引物对质粒进行完整的PCR。第二步,用Dpn I对模板质粒进行消化,37℃反应1 h。第三步,PCR产物自身环化:将Dpn I处理后PCR产物、灭菌蒸馏水、Ligation high、T4 Polynucleotide Kinase 以2∶7∶5∶1的体积比进行混合,混合物在16℃条件下反应1 h,实现PCR产物的自身环化。第四步,转化质粒:将自身环化后产物转化至DH5α感受态细胞中,涂布于含有氨苄青霉素的LB固体培养基平板,37℃恒温培养12 h后,挑取单克隆菌落进行PCR鉴定,筛选阳性克隆,用质粒提取试剂盒抽提质粒,用Xho I和BamH I酶进行双酶切,并测序验证定点突变是否成功。
1.2.4 细胞培养及转染 Flp-In T-Rex HEK293细胞培养于含有10%胎牛血清、100 U/mL的青霉素、100 μg/mL的链霉素、3 μg/mL Blasticidin、100μg/mL 的Zeocin的DMEM维持培养基中,培养条件为37℃,5%CO2和80%湿度。待细胞生长至密度为70%-80%时(T25培养瓶培养),将构建成功的pcDNA5/FRT/TO-VSV-A-Raf-S214C质粒(以下简称A-Raf-S214C质粒)和pOG44质粒按1∶9的比例共转染该细胞。具体步骤:将质粒DNA(0.3 μg)与 pOG44(2.7 μg)混合物溶入 500 μL Opti-MEM 培养基中,并将6 μL脂质体Lipo-fectamine2000也溶入500 μLOpti-MEM培养基中,将二者混合均匀,静置15-20 min。在静置期间,将T25培养瓶中的培养基吸出,用1 mL 1×PBS洗涤3次,并加入2.5 mL Opti-MEM培养基,并放回培养箱继续培养。待静置结束后,轻轻将质粒与转染试剂混合物均匀混合,加入T25培养瓶中,混匀后放回37℃培养箱中继续培养。6 h后,将Opti-MEM培养基更换为正常维持培养基5 mL,继续培养。第2天,将转染了质粒的Flp-In T-Rex HEK293细胞传代至T125培养瓶中继续培养。第3天,将T125培养瓶中的维持培养基更换成含200 μg/mL Hygromycin 的筛选培养基继续培养。之后每3-5 d更换一次筛选培养基,直至有单克隆细胞出现。然后将单克隆细胞用胰酶消化,转移至T25培养瓶,并更换为维持培养基继续扩大培养,用于后续试验。
1.2.5 免疫印记分析 将A-Raf 野生型和A-Raf-S214C稳定表达细胞系铺6孔板,用浓度为0、1、5、10、100和1 000 ng/mL六个浓度梯度的Doxycycline(Dox)诱导VSV-A-Raf和VSV-A-Raf-S214C的表达,诱导24 h后裂解细胞,收集蛋白样品,并进行BCA定量,进行SDS-PAGE电泳、PVDF膜转膜、牛奶封闭、孵育一抗、1×TBST洗膜、孵育二抗、1×TBST洗膜、显影,用凝胶成像系统软件对结果进行分析。根据VSV的表达水平,可确定诱导剂的最佳浓度。再次将A-Raf野生型和A-Raf-S214C稳定细胞系铺6孔板,用之前检测得到的Dox最佳诱导浓度分别诱导细胞0、12、18和24 h后收集细胞,进行Western blot检测,方法同前,可确定Dox最佳诱导时间。
1.2.6 A-Raf-S214C突变体活性检测 将A-Raf野生型和A-Raf-S214C突变体稳定表达细胞系分别铺6孔板,每种细胞分成3组。待细胞生长至密度为70%-80%时,用最佳Dox诱导浓度分别诱导A-Raf野生型和A-Raf-S214C突变体稳定表达细胞。诱导12 h后,第1组细胞不做任何处理,将第2组和第3组细胞更换为无血清培养基,并继续用Dox诱导。再过12 h后,将第2组细胞用200 μL胎牛血清刺激5 min(加入血清后,培养基中血清终浓度为10%),其余两组不作处理。然后进行细胞收样,用Western blot检测ERK的磷酸化水平,Western blot方法同前。1.2.7 统计学分析 本实验数据处理应用SPASS21.0统计软件,采用t检验进行统计分析,显著性差异水平定位P<0.05。
2 结果
2.1 pcDNA5/FRT/TO-VSV-A-Raf质粒的鉴定
将构建的A-Raf质粒用琼脂糖凝胶电泳分析,结果(图1)显示,pcDNA5/FRT/TO-VSV-A-Raf质粒在相应位置具有清晰的条带,大小正确。质粒测序结果与NCBI数据库中基因序列完全一致,说明构建的A-Raf质粒符合实验要求。

图1 琼脂糖凝胶电泳测定pcDNA5-FRT-TO-A-Raf质粒的大小
2.2 pcDNA5/FRT/TO-VSV-A-Raf-S214C突变体质粒构建
通过反向PCR法对A-Raf进行点突变PCR产物经Dpn I酶切及产物自身环化后,将环化产物转染至DH5α感受态细胞中,挑取单克隆菌落进行菌液PCR鉴定,其中12个代表性单克隆菌落的菌落PCR电泳结果如图2-A所示。通过菌液PCR筛选阳性克隆,用质粒提取试剂盒抽提质粒,将其中前8个菌落的质粒分别进行Xho I和BamH I双酶切鉴定它们是否含有相应大小的插入片段,酶切的电泳结果如图2-B所示。经序列比对,发现A-Raf序列第641位碱基C突变为G,即编码214位氨基酸的丝氨酸(TCC)突变为半胱氨酸(TGC),即可确定点突变成功。测序结果如图3所示。
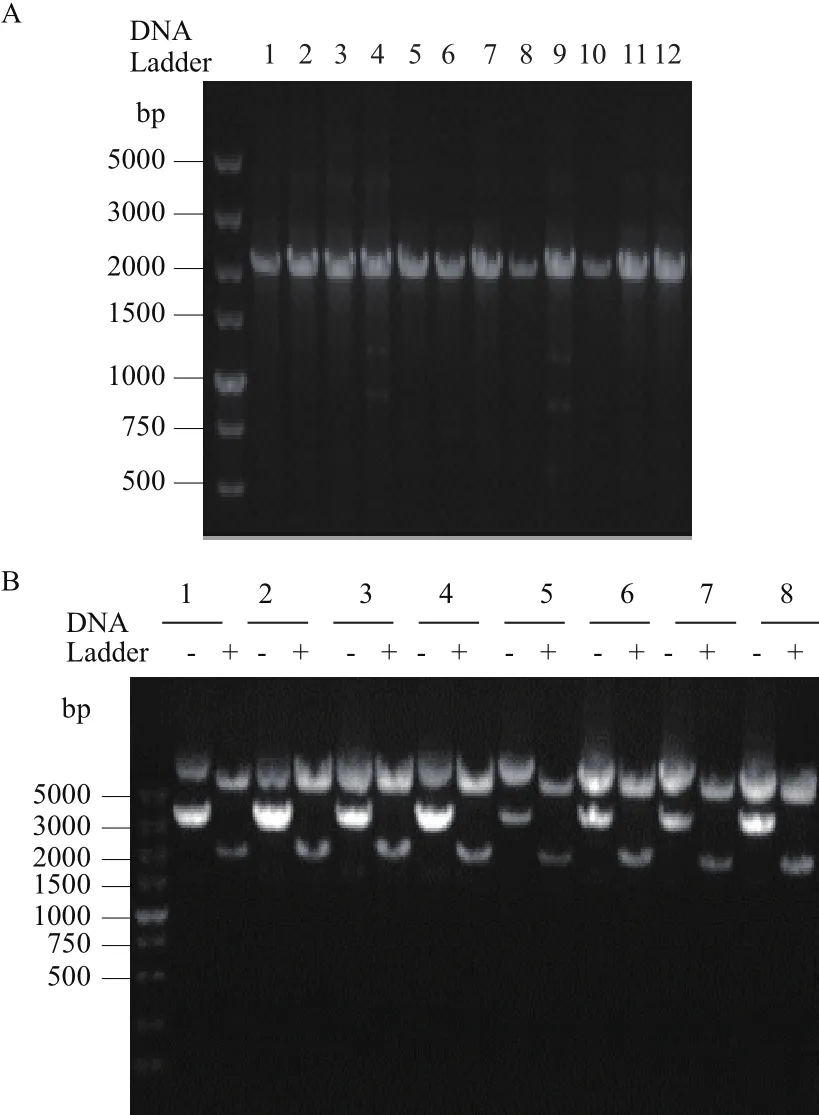
图2 琼脂糖凝胶验证A-Raf-S214C菌落PCR产物(A)及pcDNA5-FRT-TO-A-Raf-S214C质粒的双酶切验证(B)
2.3 免疫印记检测A-Raf-S214C突变体在Flp-In T-Rex HEK293细胞表达情况
用 浓 度 为 0、1、5、10、100和 1 000 ng/mL Doxycycline分别处理稳定表达A-Raf及其突变体A-Raf-S214C的两个细胞系,处理24 h后,用抗VSV标签蛋白抗体检测A-Raf及其突变体A-Raf-S214C的表达情况,免疫印记结果(图4-A)显示,100 ng/mL Dox是A-Raf及其突变体A-Raf-S214C的最佳诱导浓度。用该最佳浓度,再次分别诱导两个细胞系0、12、18和24 h,结果(图4-B)显示诱导24 h后,A-Raf和A-Raf-S214C的表达量可达最大。本实验说明,用100 ng/mL Dox处理细胞24 h是诱导A-Raf和A-Raf-S214C表达的最佳条件。
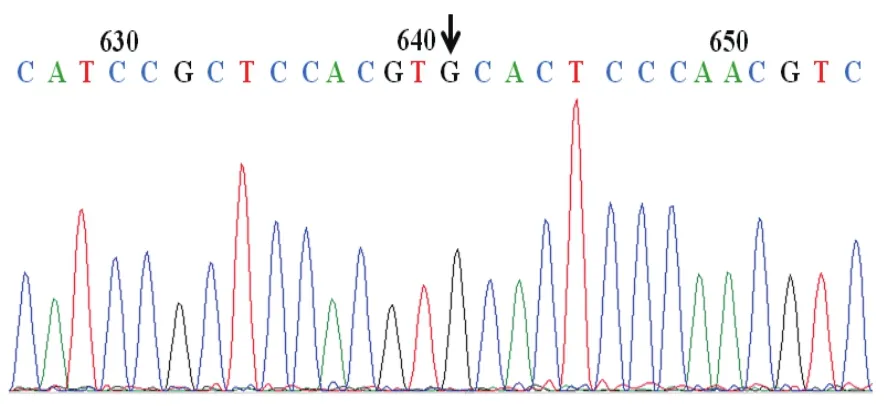
图3 A-Raf-S214C突变体测序
2.4 A-Raf-S214C突变体对MAPK信号通路的影响
将A-Raf 野生型和A-Raf-S214C稳定表达细胞系分别分为正常培养诱导组、饥饿组和饥饿后加血清刺激组进行实验,之后用Western blot检测ERK的磷酸化水平,发现饥饿组中的A-Raf-S214C突变体细胞的ERK磷酸化水平明显高于A-Raf野生型细胞(图5-A)。重复3次该实验,并进行统计学分析,饥饿处理组A-Raf野生型和A-Raf-S214C突变体的ERK磷酸化水平,差异显著(**P<0.01),结果如图5-B所示。该结果初步证明A-Raf-S214C突变体是A-Raf的激活突变体,与A-Raf相比,A-Raf-S214C对MAPK信号通路下游信号分子ERK的磷酸化能力更强。
3 讨论
Ras-Raf-MEK-ERK通路是细胞信号传导的一条主干通路,它调控着细胞的生长、分化、转化和凋亡等诸多生命过程[9]。在这条通路中,Raf激酶作为关键组分之一发挥着重要作用[6]。
Raf激酶是逆转录病毒致癌基因v-Raf的同源蛋白,Raf激酶家族有3个成员A-Raf、B-Raf 和C-Raf(Raf-1),3个成员结构相似(由调节区和激酶活性区两部分组成),大小接近(A-Raf:606个氨基酸;B-Raf:806个氨基酸;C-Raf:648个氨基酸),都可以被Raf激酶的结合蛋白Ras激活,之后从细胞质转位到细胞膜,并通过磷酸化靶蛋白MEK进一步激活ERK。但3个成员生物学功能和调控机制却各不相同[10]。其中对B-Raf和C-Raf的研究最为深入,它们是Ras-Raf-MEK-ERK信号通路上的主要致癌蛋白也是激活MEK的主要蛋白[10]。研究表明Ras-Raf-MEK-MAPK信号通路中的组分过表达或发生激活突变,与超过30%的人类肿瘤相关[11]。其中Raf激酶的突变是导致细胞癌变的主要原因之一,如B-Raf突变与57%的神经系统癌变、39%的皮肤癌和38%胸腺癌相关[12];C-Raf突变与超过90%的小细胞肺癌相关[13]。因此,调控Raf激酶也就成为了治疗癌症的最主要手段之一[13-14]。

图4 不同多西环素浓度(A);及在100 ng/mL多西环素诱导的条件下,不同诱导时间(B)对VSV-A-Raf野生型和VSV-A-Raf-S214C突变体表达的影响

图5 免疫印迹检测VSV-A-Raf野生型细胞和VSV-A-Raf-S214C突变体细胞的ERK磷酸化水平
与B-Raf和C-Raf相比,A-Raf具有较低的激酶活性,其最大活性仅为C-Raf的20%[15],而且当前在肿瘤中发现A-Raf发生基因突变的报道较少。因此,人们对A-Raf激酶的关注较少,作为Raf激酶家族中重要一员,对其生物学功能仍不是非常清楚。这同时也给我们一种启示,为什么在进化过程中会形成一个较差的MEK激酶A-Raf,而与之同源的B-Raf和C-Raf会具有非常强的激酶活性?因此,这些问题驱使我们对A-Raf及其激活突变体进行研究。本研究发现,与野生型A-Raf相比,其突变体A-Raf-S214C可明显增强下游信号分子ERK的磷酸化程度,该突变体是A-Raf激酶的构建性激活突变体,可引起MAPK信号通路下游信号分子ERK异常活化。而异常活化的ERK可通过转录因子调控细胞周期进展、细胞分化、蛋白质合成、代谢、细胞存活[16]、细胞迁移和入侵等使正常细胞获得许多肿瘤细胞的特征[17]。也有报道称,A-Raf激酶在细胞凋亡[18]、肿瘤形成[19]、拮抗 Raf激酶抑制剂[20]等过程中扮演重要角色。因此,进一步了解A-Raf-S214C突变体的具体激活机制有助于帮助我们了解A-Raf的致癌机制,为人们寻找治疗癌症的方法提供了新的思路。
4 结论
利用点突变的方法,成功构建了A-Raf-S214C突变体质粒。并且成功构建了在Flp-In T-Rex HEK293细胞中稳定表达的A-Raf野生型和A-Raf-S214C突变体细胞系。在不同浓度的多西环素诱导下,A-Raf野生型细胞与A-Raf-S214C突变体细胞的表达量有所不同,二者均在100 ng/mL的多西环素诱导24 h的条件下,表达水平达最大值。与野生型相比,A-Raf-S214C突变体可明显增强MAPK信号通路中下游信号分子ERK的磷酸化水平,即A-Raf-S214C突变体是A-Raf激酶的激活突变体。
[1]Kolch W. Coordinating ERK/MAPK signalling through scaffolds and inhibitors[J]. Nat Rev Mol Cell Biol, 2005, 6(11):827-837.
[2]Matallanas D, Birtwistle M, Romano D, et al. Raf family kinases:old dogs have learned new tricks[J]. Genes Cancer, 2011, 2(3):232-260.
[3]Montagut C, Settleman J. Targeting the Raf-MEK-ERK pathway in cancer therapy[J]. Cancer Lett, 2009, 283(2):125-134.
[4]Leicht DT, Balan V, Kaplun A, et al. Raf kinases:function,regulation and role in human cancer[J]. Biochim Biophys Acta,2007, 1773(8):1196-1212.
[5]Osborne JK, Zaganjor E, Cobb MH. Signal control through Raf:in sickness and in health[J]. Cell Res, 2012, 22(1):14-22.
[6]An S, Yang Y, Ward R, et al. A-Raf:A new star of the family of raf kinases[J]. Crit Rev Biochem Mol Biol, 2015, 50(6):520-530.
[7]Imielinski M, Gredulich H, Kaplan B. Oncogenic and sorafenibsensitive A-Raf mutations in lung adenocarcinoma[J]. J Clin Invest, 2014, 124(4):1582-1586.
[8]Nelson DS, Quispel W, Badalian-Very G, et al. Somatic activating A-Raf mutations in Langerhans cell histiocytosis[J]. Blood, 2014,123(20):3152-3155.
[9]Olson JM, Hallahan AR. P38MAPK kinase:a convergence pointin cancer therapy[J]. Trends Mol Med, 2004, 10(3):125-129.
[10]Osbome JK, Zaganjor E, Cobb HM. Signal control through Raf:in sickness and in health[J]. Cell Res, 2012, 22(1):14-22.
[11]Fernandez-Medarde A, Santos E. Ras in cancer and developmental diseases[J]. Genes Cancer, 2011, 2(3):344-358.
[12]Santarpia L, Lippman SM, El-Naggar AK. Targeting the MAPKRAS-RAF signaling pathway in cancer therapy[J]. Expert Opin Ther Targets, 2012, 16(1):103-119.
[13]Beeram M, Patnaik A, Rowinsky EK. Raf:a strategic target for therapeutic development against cancer[J]. J Clin Oncol, 2005,23(27):6771-6779.
[14]Kim DH, Sim T. Novel small molecule Raf kinase inhibitors for targeted cancer therapeutics[J]. Arch Pharm Res, 2012, 35(4):605-615.
[15]Martin-Liberal J, Larkin J. New RAF kinase inhibitors in cancer therapy[J]. Expert Opin Pharmacother, 2014, 15(9):1235-1245.
[16]邹平, 何涛, 陈颢, 等. 细胞衰老过程中JNK、p38和Akt的活性变化[J]. 中国生物化学与分子生物学报, 2006, 22(7):571-574.
[17]Scheid MP, Schubert KM, Duronio V. Regulation of bad phosphorylation and association with Bcl-x(L)by the MAPK/ERK kinase[J]. J Biol Chem, 1999, 274(43):31108-31113.
[18]Rauch J, Moran-Jones K, Albrecht V, et al. c-Myc regulates RNA splicing of the A-Raf kinase and its activation of the ERK pathway[J]. Cancer Res, 2011, 71(13):4664-4674.
[19]Imielinski M, Greulich H, Kaplan B, et al. Oncogenic and sorafenib-sensitive ARAF mutations in lung adenocarcinoma[J].J Clin Invest, 2014, 124(4):1582-1586.
[20]Mooz J, Oberoi-Khanuja TK, Harms GS, et al. Dimerization of the kinase ARAF promotes MAPK pathway activation and cell migration[J]. Sci Signal, 2014, 7(337):ra73.
Construction and Expression of Mutant A-Raf-S214C and Studies on Its Role in MAPK Signaling Pathway
LI An-yi YANG Yang LIU Ying GUO Xiao-xi HAO Qian XU Tian-rui AN Shu
(University Based Provincial Key Laboratory of Screening and Utilization of Targeted Drugs,Faculty of Life Science and Technology,Kunming University of Science and Technology,Kunming 650500)
This study is to observe the influence of A-Raf mutant A-Raf-S214C on MAPK(mitogen-activated protein kinase)signal pathway and to explore the molecular mechanism of lung cancer and Langerhans cell histiocytosis caused by A-Raf-S214C. The pcDNA5-FRT-TO-A-Raf-S214C plasmid was constructed through point mutation,and then it was used to establish HEK293 cell lines stably expressing A-Raf-S214C. Further,the influence of A-Raf-S214C on MAPK signaling pathway was determined by detecting the level of ERK phosphorylation. Results showed that HEK293 cell line with stable expression of A-Raf-S214C was successfully constructed,and A-Raf-S214C expression levels increased under induction with increasing concentrations of doxycycline. In comparison with wild type A-Raf,mutant A-Raf-S214C significantly enhanced the phosphorylation level of ERK . Conclusively,A-Raf-S214C mutant is an activating mutant of A-Raf kinase,resulting in significantly increased phosphorylation level of ERK,a downstream signaling molecule in MAPK pathway.
A-Raf kinase;MAPK signaling pathway;signal transduction
10.13560/j.cnki.biotech.bull.1985.2017-0445
2017-05-30
国家自然科学基金项目(81460253,U1302225),云南省人才培养项目(KK23201426014)
李安毅,女,硕士研究生,研究方向:细胞信号传导;E-mail:82291898@qq.com
安输,男,博士,副教授,研究方向:细胞信号传导;E-mail:aslxj@mail.ustc.edu.cn徐天瑞,男,博士,教授,研究方向:细胞信号传导;E-mail:xtrgfq@hotmail.com
(责任编辑 李楠)
