淡黑巨藻醇提取物降血糖活性及其对小鼠肠道菌群的影响
2018-01-08陈玉青严新陈明军林娈杨成凤李秋哲刘斌赵超
陈玉青 严新 陈明军 林娈 杨成凤,3 李秋哲 刘斌,2 赵超,4,
(1. 福建农林大学食品科学学院,福州 350002;2. 国家菌草工程技术研究中心,福州 350002;3. 中国农业大学食品科学与营养工程学院,北京 100083;4. 美国加利福利亚大学化学系,戴维斯 95616;5. 泉州师范学院海洋与食品学院,泉州 362000)
淡黑巨藻醇提取物降血糖活性及其对小鼠肠道菌群的影响
陈玉青1严新1陈明军1林娈5杨成凤1,3李秋哲1刘斌1,2赵超1,4,5
(1. 福建农林大学食品科学学院,福州 350002;2. 国家菌草工程技术研究中心,福州 350002;3. 中国农业大学食品科学与营养工程学院,北京 100083;4. 美国加利福利亚大学化学系,戴维斯 95616;5. 泉州师范学院海洋与食品学院,泉州 362000)
筛选具有降血糖活性的海藻活性物质,研究其对2型糖尿病小鼠肠道菌群的影响,为开发具有降糖作用的营养功能性食品提供依据。利用体外α-葡萄糖苷酶抑制活性和HepG2胰岛素抵抗细胞模型,对13种海藻通过分步提取法制备得到的35种海藻提取物进行筛选,并采用16S rRNA高通量测序技术分析降糖效果佳的提取物对2型糖尿病小鼠肠道菌群的影响。结果表明,35种海藻提取物中泡叶藻和淡黑巨藻55%乙醇提取物对α-葡萄糖苷酶活性抑制作用最为显著,淡黑巨藻55%乙醇提取物更能显著提高HepG2胰岛素抵抗细胞的葡萄糖消耗量,其显著增加2型糖尿病小鼠肠道内Bacteroidetes属的丰度,且使Firmicutes属细菌数量明显减少。淡黑巨藻55%醇提取物表现出显著的降血糖及调节肠道菌群的作用,具有潜在的食药用价值。
淡黑巨藻;醇提取物;糖尿病;肠道菌群;16S rRNA高通量测序
海藻富含多糖类、萜类、蛋白类、多酚类、甾醇类、环状多硫化合物、大环内酯类等活性成分[1],具有抗氧化、抗肿瘤、降低血脂、降血糖以及提高免疫力等生物活性[2]。糖尿病是高发病率疾病之一,可引发各种慢性并发症,严重时更会危及生命。α-葡萄糖苷酶是水解碳水化合物的关键酶,它可以水解低聚糖类底物的非还原端α-1,4糖苷键,产生葡萄糖经小肠吸收进入血液,导致血糖水平上升[3]。故抑制α-葡萄糖苷酶的活性,能有效延缓碳水化合物的消化以及葡萄糖的吸收,达到控制餐后血糖的目的。目前,市场已经出现多种葡萄糖消化酶抑制剂,如阿卡波糖、福格列波糖等,并广泛应用于糖尿病临床治疗。但阿卡波糖等口服降血糖药物存在明显的副作用,如引起多种消化道不适反应。因此,可以通过体外α-葡萄糖苷酶的抑制活性筛选具有降糖天然有效化合物,以减少药物的毒副作用[4]。
肠道菌群(Intestinal microflora)作为寄居于人体肠黏膜表面的细菌和古生菌,参与人体生理代谢、生长发育及疾病自身发展[5]。糖尿病发病率的增加与肠道菌群细菌的变化有密切的关系[6]。正常的成年人的肠道菌群由约100-150个种属的细菌组成,其中占90%的微生物属厚壁菌门及拟杆菌门;其次是变形菌门,还有少量其他的菌群[1]。2型糖尿病患者肠道菌群会发生中度紊乱,条件致病菌、变型菌,以及具有硫酸盐还原能力及抗氧化功能的微生物丰度明显增加,产短链脂肪酸细菌丰度减少[7-8]。越来越多的研究表明,通过活性物质作用于肠道菌群进而干预肠道菌群可有效达到降血糖的效果[9-10]。本研究采用传统的溶剂萃取法结合现代超声波提取技术对13种海藻进行分步提取制备活性成分,其中超声波提取技术是利用超声波产生的高频机械振动和空化作用,产生并传递能量,引起介质进入振动状态,使其结构发生物理改变,促使有效成分溶出,大大提高了溶出率,具有快速、高效和环保等特点[10]。各组分活性物质通过体外α-葡萄糖苷酶抑制活性以及HepG2胰岛素抵抗细胞模型,筛选获得降血糖效果最佳的淡黑巨藻醇提取物,并研究其对2型糖尿病小鼠肠道菌群的影响,旨在为海藻在降血糖营养功能性食品和药品中的应用提供指导。
1 材料与方法
1.1 材料
13种海藻,淡黑巨藻(Lessonia nigrescens)、泡叶 藻(Ascophyllum nodosum)、LF巨 藻(Lessonia trabeculate)、鼠尾藻(Sargassum thunbergii)、海带(Laminaria japonica)、海青菜、杂色麒麟菜(Variegated eucheuma)、海蒿子(Sargassum pallidum)、龙须菜(Asparagus schoberioides)、大叶藻(Zostera marina)、裙带菜(Undaria pinnatifida)、石莼(Ulva lactuca)和泡泡藻(Ventricaria ventricosa)均购买自青岛福兴祥进出口贸易有限公司;HepG2购买自中科院典型培养物保藏委员会细胞库;CCK8试剂盒,上海碧云天生物技术有限公司;α-葡萄糖苷酶、对硝基苯基-a-D-吡喃葡萄糖苷(PNPG)、阿卡波糖,上海源叶生物科技有限公司;DMEM高糖培养基,Hyclone;胎牛血清、100×青-链霉素母液、0.25% 胰蛋白酶,美国Life公司;地塞米松,美国Sigma公司;葡萄糖测定试剂盒,南京建成生物工程研究所;E.Z.N.A.® Stool DNA Kit抽提试剂盒,美国Omega Bio-Tek公司;DNA胶回收试剂盒,美国Axygen公司;TaqDNAPolymerase,美国 Thermo公司;AgencourtAMPureXP,美国Beckman Coulter公司;二甲基亚砜、无水乙醇等试剂均为分析纯。
LABCONCO冻干机(北京照生行仪器设备有限公司),SepectraMax i3X酶标仪(美谷分子仪器有限公司),倒置显微镜(Nikon,Japan),DYY-6C 型电泳仪、DYCZ-21电泳槽、PCR 仪(美国 BIO-RAD 公司),Alliance 6.7凝胶成像系统(英国 UVI 公司)。
1.2 方法
1.2.1 海藻提取物的制备 13种海藻,用蒸馏水漂洗2-3次,除去泥沙和杂质,沥水后置于45℃烘箱烘干,粉碎过100目筛,称取海藻粉末各20 g,分别按照料液比1∶10加入55% 乙醇,45 kHz水浴超声波50℃浸提60 min,过滤并收集滤液,冻干,备用。滤渣按照料液比1∶40加入蒸馏水,45 kHz水浴超声波60℃浸提45 min,离心后收集上清液,加入4倍体积无水乙醇,4℃静置过夜,离心分离上清液与沉淀,收集上清液和沉淀,冻干备用(表1)。

图1 海藻活性物质提取工艺流程
1.2.2 海藻提取物对α-葡萄糖苷酶活性的影响 参照α-葡萄糖酶活性的测定的方法,设置阳性对照和空白对照研究各海藻提取物在浓度为10 mg/mL时对α-葡糖苷酶活性的抑制作用。其反应体系如表1所示,利用酶标仪在波长为405 nm条件下测定其吸光值(OD值)。反应体系如表2。
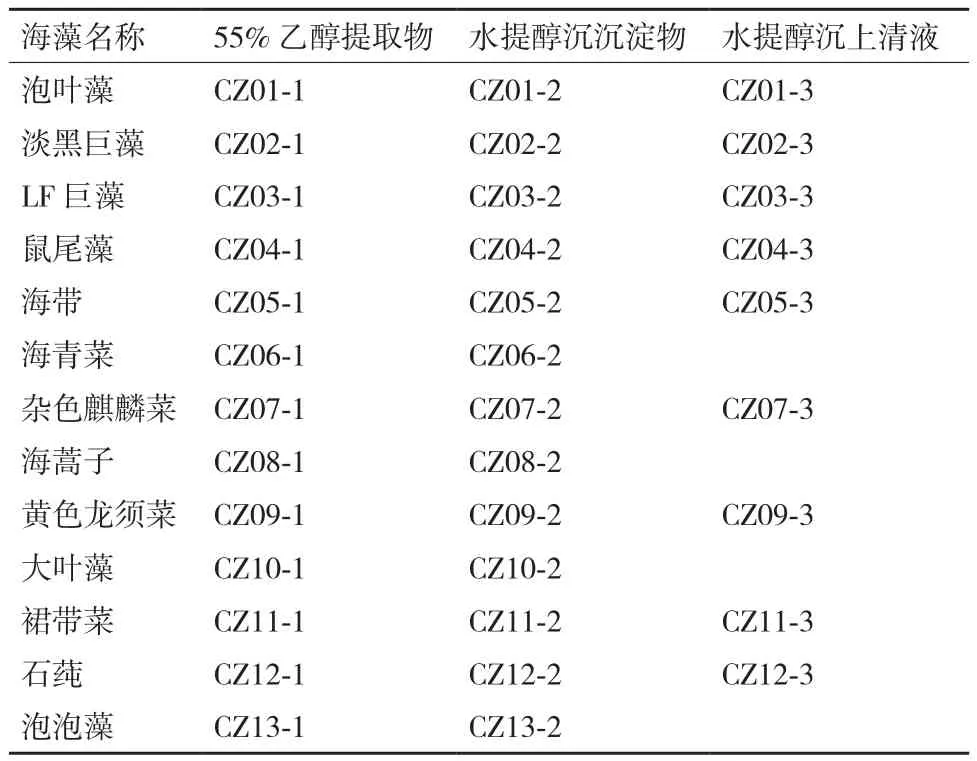
表1 海藻提取物编号表

表2 海藻提取物对α-葡萄糖酶抑制活性检测体系
按照下列公式计算 α-葡萄糖苷酶活性抑制率:
抑制率(%)=(1-A00/A01)×100%
式中:A00= A3-A4,A01= A1-A2。其中,A1:对照组OD值;A2:背景对照组OD值;A3:样品组OD值;A4:背景样品组OD值。
1.2.3 海藻提取物对HepG2细胞胰岛素抵抗模型的影响
1.2.3.1 海藻提取物对细胞的毒性实验 复苏并培养HepG2细胞至铺满单层80%-90%,用胰酶消化后均匀加入96孔板,每孔的细胞密度为104-105,放于37℃、5%CO2的培养箱中过夜培养。待96孔板细胞贴壁后,吸弃旧的培养基,将MEM完全培养基稀释的海藻提取液加入孔中,每孔200 μL。其中设置4个溶度分别为15、20、30及60 μg/mL,每个溶度设置5个复孔,同时设立空白细胞对照组。培养箱中培养48 h 后,向每孔加入20 μL的CCK8溶液,于培养箱中培养1-3 h,用酶标仪在450 nm测定吸光值,根据吸光值计算不同溶度药物对细胞毒性大小,得出细胞存活率。细胞活力的计算:

式中,A加药:具有细胞,CCK 溶液和药物溶液的孔的吸光度;A空白:具有培养基和CCK 溶液而没有细胞的孔的吸光度;A0加药:具有细胞,CCK 溶液而没有药物溶液的孔。
1.2.3.2 建立胰岛素抵抗细胞模型 复苏HepG2细胞,加入含10% FBS的完全培养基,在37℃,5%CO2条件下培养细胞直至细胞贴满瓶底80%-90%,利用胰酶进行消化,取对数生长期的细胞以1×105个/孔接种于 96 孔培养板中。待细胞长满至80%后,分为空白组和模型组。空白组加入含10% FBS完全培养基,模型组加入含有地塞米松浓度1.0 μg/mL的完全培养基,于培养箱中孵育24 h、48 h、72 h和 96 h,分别吸弃培养基,换无FBS的培养液继续孵育12 h后,按照葡萄糖测定试剂盒操作说明检测培养液中葡萄糖的含量。计算空白组与不同地塞米松浓度组细胞的葡萄糖消耗量差值,选择最大差值所对应的地塞米松作用时间建立模型。按照下列公式分别计算葡萄糖浓度、葡萄糖消耗量和葡萄糖消耗率:
葡萄糖浓度(mmol/L)=(OD待测/ OD标准液)× 5.55
葡萄糖消耗量(mmol/L)= 空白组葡萄糖浓度-待测组葡萄糖浓度
葡萄糖消耗率(%)=[(空白组葡萄糖消耗量-待测组葡萄糖消耗量)/ 对照组葡萄糖消耗量]×100%
1.2.3.3 药物干预测定葡萄糖含量 对数生长期HepG2 细胞经胰酶消化后以1×105个/孔接种于96孔板。实验组分为空白组、对照组、模型组和海藻提取物组。除空白组、对照组外,其他各组按照1.3.4.2所述方法复制IR-HepG2 模型,每组设6个重复。造模成功后将20 μg/mL 海藻提取物作用于海藻提取物组,分别在作用24 h、48 h时按照1.3.4.2所述方法测定及计算葡萄糖消耗量。
1.2.4 海藻提取物对2型糖尿病小鼠肠道菌群的影响
1.2.4.1 2型糖尿病小鼠模型建立 将小鼠随机分组,每组10只,在适宜温度和湿度以及光照(12 h光照和12 h黑暗)的条件下喂养一周,期间自由饮水。一周后随机挑选10只作为正常组喂以普通饲料,其余各组喂食高糖高脂饲料。5周后,全部小鼠禁食不禁水12 h,正常组腹腔注射缓冲液,其余小鼠腹腔注射链脲佐菌素(45 mg/kg),每隔1 d注射一次,共3次,进行造模。最后一次注射24 h后禁食12 h,剪尾取血测空腹血糖值(FBG),若FBG≥11.1 mmol/L则认为2型糖尿病小鼠造模成功。造模成功后,药物组灌胃150 mg/kg海藻提取物,正常组和模型组均灌胃生理盐水。灌胃4周后,处死,收集小鼠大肠、小肠等标本。
1.2.4.2 2型糖尿病小鼠肠道菌群结构分析 采集2型糖尿病小鼠肠道内容物,使用E.Z.N.A.®Stool DNA Kit提取肠道内容物细菌DNA。从样品收集的微生
物基因组DNA中扩增出16S rRNA基因V3-V4高变区;设计引物341F:5'-CCTACGGGNGGCWGCAG-3'和805R:5'-GACTACHVGGGTATCTAATCC-3'。PCR反应包含10-20 ng DNA模板,2×Taq master Mix,10 μmol/L Bar-PCR 引 物 F,10 μmol/L 引 物 R 和H2O。使用以下热循环条件:94℃初始变性3 min;94℃ 30 s,45℃ 20 s,60℃ 30 s循环 5 次;94℃ 30 s,55℃ 20 s,72℃ 30 s循环20次;最后在72℃延伸5 min。使用Agencourt AMPure XP纯化扩增子,并使用利用 Qubit2.0 DNA 检测试剂盒对回收的 DNA 精确定量。每个样品 DNA取10 ng,最终上机测序浓度为20 pmol。纯化的文库在Illumina MiseqTM平台上测序。将细菌序列读数与从核糖体数据库项目(RDP)获得的已知16S rRNA基因的参考数据库进行比较。细菌序列根据RDP分类器分类分配。基于不同样品的代表性读数(OTU)之间的系统发育关系,使用FastUniFrac比较不同样品中的微生物群落结构。
1.2.5 数据分析 所有数据表示为至少3次独立实验的平均值±SD。对数据进行方差分析(ANOVA),P<0.05 代表统计学差异显著水平,P<0.01 代表统计学差异极显著水平。
2 结果
2.1 α-葡萄糖苷酶活性抑制筛选结果
2.1.1 海藻55%乙醇提取物对α-葡萄糖苷酶活性的影响 由图2可知,以阿卡波糖作为阳性药物对照,不同海藻55%乙醇提取物,除黄色龙须菜CZ09-1之外,其余提取物均对α-葡萄糖苷酶活性表现出一定的抑制作用。其中淡黑巨藻CZ02-1抑制α-葡萄糖苷酶活性作用最明显,抑制率可达94.33%,其次是泡叶藻CZ01-1,抑制率为80.13%。

图2 不同海藻55%乙醇提取物对α-葡萄糖苷酶活性的影响
2.1.2 海藻水提醇沉沉淀物对α-葡萄糖苷酶活性的影响 以阿卡波糖作为阳性药物对照,不同海藻水提醇沉沉淀物对α-葡萄糖苷酶活性的抑制率如图3所示,泡叶藻CZ01-2显示出最显著的抑制作用,其抑制率为74.39%。与海藻55%乙醇提取物对比,水提醇沉沉淀物对α-葡萄糖苷酶的抑制率均较低,且除了泡叶藻CZ01-2、淡黑巨海藻CZ02-2、鼠尾藻CZ04-2、马尾藻CZ08-2表现出一定的抑制作用外,其余水提醇沉沉淀均呈现促进作用。

图3 海藻水提醇沉沉淀物对α-葡萄糖苷酶活性的影响
2.1.3 海藻水提醇沉上清液对α-葡萄糖苷酶活性 如图4所示,以阿卡波糖作为阳性药物对照,不同海藻水提醇沉上清液中,除CZ01-3外,其余均对α-葡萄糖苷酶活性表现出一定的促进作用,裙带菜CZ11-3最为显著,高达101.28%。此外,海带CZ05-3、杂色麒麟菜CZ07-3和黄色龙须菜CZ09-3对α-葡萄糖苷酶活性的促进率均达70%以上。
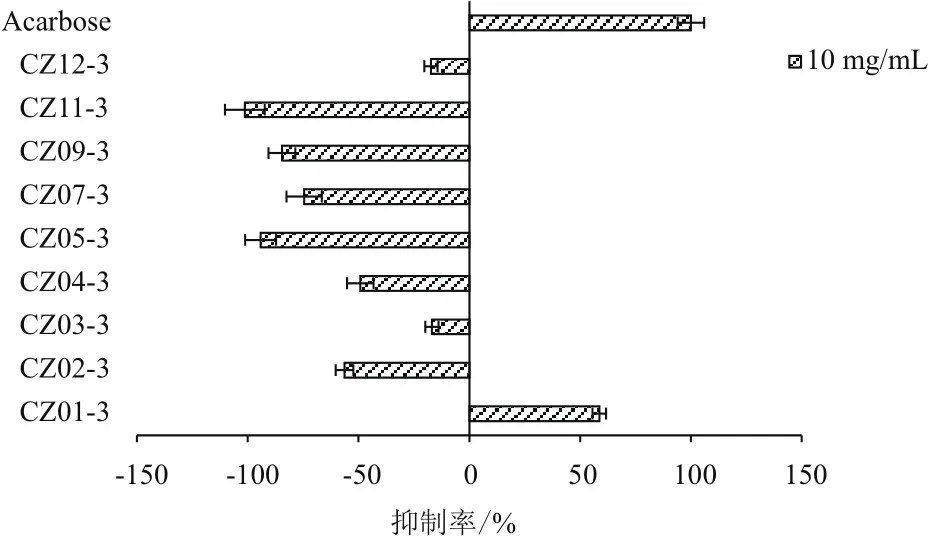
图4 海藻水提醇沉上清液对α-葡萄糖苷酶活性的影响
2.2 CZ01-1和CZ02-1对HepG2胰岛素抵抗细胞葡糖糖消耗的影响
2.2.1 CZ01-1和CZ02-1对HepG2细胞的毒性实验 淡黑巨藻55%醇提CZ02-1和泡叶藻55%醇提CZ01-1对细胞毒性结果如图5所示,CZ02-1与CZ01-1在15、20、30、60 μg/mL 4个浓度作用细胞48 h后,细胞活力在90%上下波动,可以看出这两种提取物对细胞的毒性极小。

图5 CZ01-1与CZ02-1对细胞毒性作用
2.2.2 HepG2细胞胰岛素抵抗模型造模最佳时间 HepG2细胞给予1 μmol/L地塞米松干预后葡萄糖消耗情况如图6所示,在0-96 h内,模型组细胞的葡萄糖消耗量均明显低于正常组。两组细胞的葡萄糖消耗量的差值在地塞米松作用48 h时最大(图7),由此可知建立HepG2细胞胰岛素抵抗模型的最佳作用时间为48 h。

图6 正常组与模型组HepG2葡萄糖消耗量
2.2.3 CZ01-1与CZ02-1对HepG2胰岛素抵抗细胞葡糖糖消耗的影响 CZ01-1与CZ02-1作用后,HepG2胰岛素抵抗细胞葡萄糖消耗情况如图8所示,与模型组相比,浓度为20 μg/mL的CZ01-1与CZ02-1两种醇提物作用下胰岛素抵抗细胞的葡萄糖消耗率显著提升(P<0.01),分别为43.35%和54.03%,表明两者均改善了细胞的胰岛素状态,促进了细胞对葡萄糖的摄取利用。且CZ02-1与CZ01-1相比,细胞葡萄糖消耗量效果更为明显,故选择CZ02-1进行后续研究。

图7 正常组与模型组HepG2葡萄糖消耗量差值

图8 CZ01-1与CZ02-1对HepG2胰岛素抵抗细胞葡萄糖消耗率的影响
2.3 CZ02-1对2型糖尿病小鼠肠道菌群的影响
在门水平上,拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)细菌是2型糖尿病小鼠肠道中的优势细菌(图9)。正常小鼠Bacteroidetes属和Firmicutes属细菌丰度分别为61.76%和31.1%。比较3组的肠道菌群组成,可知与正常组相比,2型糖尿病小鼠肠道内容物中的Firmicutes属细菌丰度增加12.73%,但Bacteroidetes属细菌的含量减少了10.87%。CZ02-1作用后,小鼠肠道内Bacteroidetes属细菌的丰度(58.09%)增加明显,且Firmicutes属细菌数量(33.76%)有所减少。
3 讨论
海藻55%醇提物主要以醇溶性小分子为主,如黄酮和多酚等;水提醇沉的沉淀物主要以海藻多糖、糖蛋白为主;水提醇沉的上清液主要以55%-75%醇溶性物质为主。α-葡萄糖苷酶现已成为糖尿病治疗药物的重要靶点之一[11]。海藻55%醇提物、海藻水提醇沉以及水提醇沉上清液提取物抑制率出现负值,呈现促进的作用,这一结果可能跟底物的浓度[12]、海藻提取物对底物的抑制类型以及提取物中成分存在促进α-葡萄糖苷酶水解的因子有关。35种海藻提取物经过α-葡萄糖苷酶活性抑制筛选后,抑制作用最显著的两种提取物为55%乙醇提取淡黑巨藻(CZ02-1)和55%乙醇提取泡叶藻(CZ01-1),其中淡黑巨藻和泡叶藻均属于褐藻门,褐藻提取物含有丰富的多糖和多酚类物质[13-14],具有明显的降血糖活性[15-16]。故选定二者进一步探究其对HepG2胰岛素抵抗细胞的影响。
肝细胞中的胰岛素抵抗主要导致肝糖原合成减少和肝葡萄糖产生增加[17]。本研究通过构建了胰岛素抵抗HepG2细胞,对经酶筛选得到的泡叶藻和淡黑巨藻的55%乙醇提取物进行降血糖研究发现,其的55%乙醇提取物均显著提高了胰岛素抵抗细胞的葡萄糖消耗量,缓解了肝细胞胰岛素抵抗的状况,促进了肝细胞对葡萄糖的吸收。其中淡黑巨藻的55%乙醇提取物作用更为显著,能有效缓解胰岛素抵抗,促进胰岛素抵抗细胞对葡萄糖的吸收利用,对高血糖的控制可能具有潜在的利用价值。
拟杆菌门(Bacteroidetes)细菌的减少以及厚壁菌门(Firmicutes)的细菌丰度的增加,与膳食能量吸收增加和低水平炎症的发生有关[18-19],这二者的比值与血液葡萄糖浓度呈显著的正相关关系[7]。研究发现2型糖尿病小鼠中Firmicutes细菌相对于正常饮食小鼠增加,而Bacteroidetes细菌显著减少,表明糖尿病小鼠肠道菌群的改变导致了其能量吸收的增加以及糖代谢的紊乱,与糖尿病的发生密切相关。淡黑巨藻55%醇提物作用后Firmicutes属细菌数量显著减少且Bacteroidetes细菌丰度增加,显示出其有效调节肠道菌群平衡的作用,可能对糖尿病的预防和治疗具有重要意义。

图 9 CZ02-1对2型糖尿病小鼠肠道菌群中细菌在门水平上的相对丰度的影响
淡黑巨藻的体内和体外降血糖实验探究了淡黑巨藻对胰岛素抵抗以及肠道菌群的可能机理,为进一步研究利用淡黑巨藻提供有力的基础,同时为其潜在的食药用价值,降糖作用的营养功能性食品的开发提供依据。
4 结论
本研究通过体外α-葡萄糖苷酶和胰岛素抵抗HepG2细胞模型,筛选出能显著提高HepG2胰岛素抵抗细胞的葡萄糖消耗量的淡黑巨藻55%乙醇提取物,并研究其对2-型糖尿病小鼠肠道菌群影响,结果发现淡黑巨藻55%乙醇提取物能调控糖尿病小鼠的肠道菌群,显著增加2型糖尿病小鼠肠道内Bacteroidetes属的丰度,且使Firmicutes属细菌数量明显减少。
[1]韩玲, 张淑平, 刘晓慧. 海藻生物活性物质应用研究进展[J].化工进展, 2012, 31(8):1794-1800.
[2]刘楠, 孙永, 曾帅, 等. 海藻主要活性物质及其生物功能研究进展[J]. 食品安全质量检测学报, 2015, 41(8):2875-2880.
[3]刘莹. α-葡萄糖苷酶活性检测及抑制剂筛选新方法研究[D].上海:上海大学, 2015.
[4] Zhao C, Liao Z, Wu X, et al. Isolation, purification, and structural features of a polysaccharide from Phellinus linteus and its hypoglycemic effect in alloxan-induced diabetic mice[J]. J Food Sci. 2014, 79(5):H1002-1010.
[5]Sommer F, Biickhed F. The gut microbiota--masters of host development and physiology[J]. Nat Rev Microbial, 2013, 11(4):227-238.
[6]Cani PD, Geurts L, Matamoros S, et a1. Glucose metabolism:Focus on gut microbiota the endocannabinoid system and beyond[J].Diabetes Metab, 2014, 40(4):246-257.
[7]Larsen N, Vogensen FK, van den Berg FWJ, et al. Gut microbiota in human adults with type 2 diabetes differs from nondiabeticadults[J]. PLoS One, 2010, 5(2):e9085.
[8]Qin J, Li Y, Cai Z, et al. A metagunome-wide association study of gut microbiota in type 2 diabetes[J]. Nature, 2012, 490(7418):55-60.
[9]Xu J, Lian F, Zhao L, et al. Structural modulation of gut microbiota during alleviation of type 2 diabetes with a Chinese herbal formula[J]. The ISME Journal, 2015, 9(3):552-562.
[10]项昭保, 霍丹群, 任绍光. 超声波在中草药化学成分提取中的应用[J]. 自然杂志 , 2001, 23(5):289-291.
[11]Raj BM, Jonganurakkun N, Hong G, et al. α-Glucosidase andα-amylase inhibitory activities of Nepalese medicinal herb Pakhanbhed(Bergenia ciliata, Haw. )[J]. Food Chemistry,2008, 106(1):247-252.
[12]加帕尔, 闫冬, 何雯, 等. 维药石榴花多酚提取物对α-葡萄糖苷酶和α-淀粉酶抑制作用的研究[J]. 新疆医科大学学报,2013, 36(5):581-583.
[13]Zha XQ, Xiao JJ, Zhang HN, et al. Polysaccharides in Laminaria japonica, (LP):Extraction, physicochemical properties and their hypolipidemic activities in diet-induced mouse model of atherosclerosis[J]. Food Chemistry, 2012, 134(1):244-252.
[14]Nick Pantidos, Ashley Boath, Victoria Lund, et al. Phenolic-rich extracts from the edible seaweed, ascophyllum nodosum, inhibit α-amylase and α-glucosidase :Potential anti-hyperglycemic effects[J]. Journal of Functional Foods, 2014, 10 :201-209.
[15]Apostolidis E, Lee CM. In vitro potential of Ascophyllum nodosum phenolic antioxidant-mediated alpha-glucosidase and alphaamylase inhibition[J]. Journal of Food Science, 2010, 75(3):H97-H102.
[16]Kim KT, Rioux LE, Turgeon SL. Alpha-amylase and alphaglucosidase inhibition is differentially modulated by fucoidan obtained from Fucus vesiculosus and Ascophyllum nodosum[J].Phytochemistry, 2014, 98(1):27-33.
[17]Jain S, Saraf S. Type 2 diabetes mellitus—Its global prevalence and therapeutic strategies[J]. Diabetes & Metabolic Syndrome Clinical Research and Reviews, 2010, 4(1):48-56.
[18]Turnbaugh PJ, Ley RE, Mahowald MA, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J].Nature, 2006, 444(7122):1027-1031.
[19]Ley RE, Bäckhed F, Turnbaugh P, et al. Obesity alters gut microbial ecology[J]. Proc Nail Acad Sci USA, 2005, 102(31):11070-11075.
Anti-diabetic Activity of Alcohol Extracts from Lessonia nigrescens and Its Effects on Intestinal Microflora in Mice
CHEN Yu-qing1YAN Xin1CHEN Ming-jun1LIN Luan5YANG Cheng-feng1,3LI Qiu-zhe1LIU Bin1,2ZHAO Chao1,4,5
(1. College of Food Science,Fujian Agriculture and Forestry University,Fuzhou 350002 ;2. National Engineering Research Center of JUNCAO Technology,Fuzhou 350002 ;3. College of Food Science and Nutrition Engineering,China Agricultural University,Beijing 100083;4. Department of Chemistry,University of California,Davis 95616;5. College of Marine and Food, Quanzhou Normal University,Quanzhou 362000)
The aim of this article is to screen the seaweed active material and study the effect on intestinal flora in mice with type 2 diabetes for providing functional nutrition food with hypoglycemic effect. First,the 35 different extracts from 13 kinds of seaweeds prepared by step-by-step extraction method were screened by evaluating in vitro α-glucosidase activity and using HepG2 insulin resistance cell model.Then,the impacts of extracts with solid hypoglycemic effects on intestinal flora in type 2 diabetic mice were evaluated through 16s rRNA highthroughput sequencing. Among the 35 seaweed extracts,55%-ethanol extracts from Lessonia nigrescens and Ascophyllum nodosum showed the most significant inhibitory effects on α-glucosidase activity ;moreover,the 55%-ethanol extracts from L. nigrescens significantly increased the glucose consumption of insulin-resistant HepG2 cells,also remarkably increased the abundance of Bacteroidetes in the intestine of mice and decreased the number of Firmicutes bacteria. The 55%-ethanol extract of Lessonia nigrescens showed the most significant hypoglycemic activity and the ability to maintain the balance of intestinal microflora,which may have potential medicinal value.
Lessonia nigrescens;alcohol extracts;Diabetes mellitus;intestinal flora;16S rRNA high-throughput sequencing
2017-06-05
福建省杰出青年科学基金项目(2016J06009),福建省海洋藻类活性物质制备与功能开发重点实验室项目(2017FZSK05),福建省高水平大学建设项目(612014043),福建省海洋高新产业发展专项项目(闽海洋高新[2014]17号)
陈玉青,女,研究方向:海藻应用生物学;E-mail:382467216@qq.com
赵超,男,博士,研究方向:海藻应用与糖化学生物学;E-mail:zhchao@live.cn刘斌,男,博士,研究方向:食品生物技术;E-mail:liubin618@hotmail.高转移性肝癌细胞HCCLM3生物学行为的影响com
10.13560/j.cnki.biotech.bull.1985.2017-0464
(责任编辑 朱琳峰)
